2-DG修飾的超順磁性氧化鐵納米粒標記人臍帶間充質干細胞可行性觀察
盧超,單秀紅,熊非,顧寧,陳芹
(1江蘇大學附屬人民醫院,江蘇鎮江 212002;2東南大學生物科學與醫學工程學院)
間充質干細胞(MSCs)是一類來源于中胚層的多能干細胞,具有特異向多種腫瘤及其轉移灶歸巢遷移的能力。目前,MSCs向腫瘤定向遷移的確切機制尚不十分清楚,MSCs促進或抑制腫瘤增殖亦存在爭議[1]。選擇合適的方式對MSCs標記、示蹤,在活體內檢測細胞的遷移、增殖、分化等狀態,有助于解決上述問題。超順磁性氧化鐵(SPIO)為磁共振成像(MRI)陰性對比劑,國內外報道將商用SPIO如Feridex標記MSCs進行體內外示蹤研究,然而SPIO需要借助轉染劑如多聚賴氨酸等標記細胞,但轉染劑可影響細胞活力及分化能力[2]。本研究將2-脫氧-D-葡萄糖(2-DG)修飾的SPIO(γ-Fe2O3@DMSA-DG NPs)直接標記人臍帶間充質干細胞(hUCMSCs),觀察其標記效率,并觀察其對細胞活性、遷移能力的影響及體外磁共振成像,為磁標記hUCMSCs的MRI活體示蹤奠定基礎。
1 材料與方法
1.1 材料 二巰基丁二酸(DMSA)購于上海貝合化工有限公司,1-乙基-3-(3-二甲基氨丙基)-碳化二亞胺(EDC)和N-羥基琥珀酰亞胺(NHS)購于美國Pierce Chemical有限公司,D-氨基葡萄糖鹽酸鹽購于德國Alfa Aesar GmbH&Co KG公司,透射電鏡(JEM-2000EX)購于日本JEOL公司,紅外光譜檢測儀購于美國Nicolet公司。
1.2 γ-Fe2O3@DMSA-DG NPs的制備與鑒定 采用化學共沉淀法合成γ-Fe2O3NPs,將100 mg γ-Fe2O3溶于10 mL氯仿,再加入50 μL三乙胺。將50 mg DMSA溶于10 mL二甲基亞砜,然后添加到γ-Fe2O3溶液。將混合液保持60 ℃振蕩12 h,形成黑色沉積物γ-Fe2O3@DMSA NPs。將1 mL EDC和1 mL NHS、8 mL雙蒸水分別加入10 mL γ-Fe2O3@DMSA NPs,室溫下反應30 min,加入10 mL D-氨基葡萄糖鹽酸鹽,2 h后,用雙蒸水對溶液進行透析純化,形成γ-Fe2O3@DMSA-DG NPs樣品。通過透射電鏡觀察納米粒子形態,計算其平均粒徑。采用紅外光譜檢測儀觀察粒子表面結構。最終成功合成γ-Fe2O3@DMSA-DG NPs,該納米粒呈近球形,粒徑10 nm;水合粒徑為(156.2±28.2)nm。飽和磁化強度為49.67 emu/g,Zeta電位為(-10.22±0.81)mV。紅外光譜圖示γ-Fe2O3@DMSA-DG NPs出現C—N伸縮振動峰(1 107/cm)。納米粒涂層DMSA與2-DG的結合率約為60%(羧基∶2-DG=10∶6)。
1.3 hUCMSCs的分離、培養 健康新生兒臍帶取自江蘇大學附屬人民醫院婦產科足月剖宮產的胎兒,其獲取得到了醫院倫理委員會的批準和患者的知情同意。將臍帶用生理鹽水沖洗干凈,用剪刀鑷子剔去血管,將剝離的華氏膠組織剪碎至1 mm3大小,加入低糖DMEM培養液,于37 ℃、5% CO2培養箱中培養。培養液中含10% FBS、100 U/mL青霉素、100 U/mL鏈霉素。待細胞長滿后,用0.25%胰蛋白酶消化傳代。組織塊貼壁后1周可見組織塊周圍爬出細小梭形細胞;14 d時細胞貼滿瓶底,此時呈漩渦狀、輻射狀或網狀排列。傳代后細胞生長迅速,呈梭形或成纖維狀,3 d可傳1代。
1.4 γ-Fe2O3@DMSA-DG NPs體外標記hUCMSCs的效率測算 采用普魯士藍染色。于37 ℃、5% CO2、飽和濕度下,將hUCMSCs置于γ-Fe2O3@DMSA-DG NPs鐵濃度分別為0、8、16、32、64、128 μg/mL的含10%胎牛血清的低糖DMEM培養液連續孵育24 h,以未與納米鐵孵育(鐵濃度為0 μg/mL)的細胞作為對照組。將磁標記hUCMSCs接種于12孔板,吸取上清,用PBS洗滌3次,以4%多聚甲醛固定10 min,加入等量10%亞鐵氰化鉀、20%鹽酸混合液,30 min后雙蒸水沖洗3次,核固紅復染15 min,再用雙蒸水充分清洗。于顯微鏡200倍鏡下觀察,hUCMSCs細胞核呈紅色,納米鐵呈藍色位于細胞內,表明標記成功。任意選取5個視野,標記率=總標記細胞/總視野中所有細胞×100%。
1.5 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs細胞活力檢測 采用CCK-8法。取第3代hUCMSCs按2 000個/孔接種96孔板,待細胞貼壁后,將梯度鐵濃度γ-Fe2O3@DMSA-DG NPs(0、8、16、32、64、128 μg/mL)培養基與細胞孵育24 h后棄上清液,PBS清洗3遍,每孔加入含10%胎牛血清的低糖DMEM培養液100 μL及10 μL CCK-8試劑,置于溫箱孵育2 h,于450 nm波長測量OD值。每個濃度設3個復孔,以鐵濃度0 μg/mL為對照組,空白組僅含低糖DMEM培養液及CCK-8試劑,取全部結果的平均值。細胞活力(%)=(OD實驗組-OD空白組)/(OD對照組-OD空白組)×100%。
1.6 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs遷移能力檢測 采用Transwell遷移實驗。將梯度鐵濃度γ-Fe2O3@DMSA-DG NPs(8、16、32、64、128 μg/mL)培養基與細胞孵育24 h后將hUCMSCs細胞制成單細胞懸液,細胞計數,離心后棄上清,用含1%胎牛血清的低糖DMEM培養基重懸細胞沉淀,并調整細胞密度為1×106個/mL。取24孔板,向孔中鋪入三陰性乳腺癌細胞BT549,待細胞貼壁融合80%時,吸棄上清,加入600 μL含10%胎牛血清的低糖DMEM培養基,然后將Transwell小室放入孔中。取上述磁標記hUCMSCs細胞懸液200 μL分別加入已備好的不同小室中,將24孔板置于37 ℃、5% CO2孵箱中孵育24 h。隨后甩去上層液體,PBS清洗小室,用濕棉簽輕輕擦拭除去小室膜上層的細胞,多聚甲醛固定10 min后,普魯士藍染色30 min,伊紅復染20 min,200倍鏡下取上下左右中5個視野計數細胞個數。
1.7 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs細胞群MRI成像觀察 將梯度鐵濃度γ-Fe2O3@DMSA-DG NPs(8、16、32、64、128 μg/mL)培養基與hUCMSCs連續孵育24 h,吸去培養基,用PBS洗滌3次,胰蛋白酶消化,將4.2×105個細胞均勻混懸于0.5%瓊脂糖中固定,置于EP管中,其中鐵濃度0 μg/mL為對照組。采用Siemens Avanto 1.5T MR掃描儀,相控陣8通道頭線圈,軸位T2WI采用TR 5 500 ms,TE 100 ms,層厚2 mm,矩陣256×256,觀測圖像信號變化。采用自旋多回波脈沖序列(TR=3 000 ms,TE=22~352 ms,16個回波,矩陣256×256,層厚3 mm),將圖像傳輸到MRI系統配備工作站,生成T2圖,選擇3個大小一致的感興趣區測量橫向弛豫時間(T2),取均值,計算橫向弛豫率(R2),R2=1/T2。
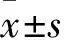
2 結果
2.1 γ-Fe2O3@DMSA-DG NPs體外標記hUCMSCs的效率 鐵濃度為8、16、32、64、128 μg/mL時,hUCMSCs標記率分別為80.74%、90.80%、96.91%、99.56%、99.58%,細胞內藍染顆粒數量隨鐵濃度升高而逐級增加。
2.2 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs細胞活力 空白組、對照組及8、16、32、64、128 μg/mL鐵標記hUCMSCs OD值分別為0.163±0.005、0.291±0.011、0.277±0.007、0.273±0.024、0.274±0.004、0.276±0.008、0.273±0.003。8、16、32、64、128 μg/mL鐵標記hUCMSCs細胞活力分別為90.5%、87.3%、88.1%、89.7%、87.3%,各鐵濃度標記細胞活力與對照組比較差異均無統計學意義。
2.3 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs遷移能力 對照組及8、16、32、64、128 μg/mL鐵標記hUCMSCs遷移細胞數分別為(151.4±9.89)、(141.4±5.55)、(154.6±4.83)、(152.4±7.77)、(150.6±8.38)、(47.8±2.28)個,128 μg/mL鐵標記細胞與對照組相比P<0.01。
2.4 γ-Fe2O3@DMSA-DG NPs標記hUCMSCs MRI檢測結果 對照組及8、16、32、64、128 μg/mL鐵標記hUCMSCs T2圖測的T2值分別為(115.83±2.24)、(88.70±1.97)、(82.87±1.52)、(80.70±0.78)、(62.36±1.70)、(52.50±1.65)ms,各濃度鐵標記細胞T2值與對照組相比差異均有統計學意義(P均<0.05)。相關性分析顯示,hUCMSCs細胞群R2值與培養基γ-Fe2O3@DMSA-DG NPs鐵濃度呈正相關(r=0.964,P<0.05)。
3 討論
MSCs可以定向遷移至靶組織,如損傷、炎癥及腫瘤部位。SPIO與MRI成像相結合能夠標記和示蹤MSCs。hUCMSCs取材方便、無免疫排斥、分化能力強,本研究探討利用2-DG標記的SPIO孵育hUCMSCs,在有效磁標記hUCMSCs的前提下,最大程度維持hUCMSCs的活力和遷移能力。
SPIO的生物相容性及攝取同納米直徑和表面特性相關[3]。本研究中SPIO核心為γ-Fe2O3,水合粒徑為156 nm,表面修飾物DMSA不影響細胞活力,與細胞具有良好的親和性[4],可增加SPIO在細胞中的吸收[5]。同時包被DMSA的納米鐵進一步標記葡萄糖類似物2-DG,借助靶向配體2-DG與細胞膜葡萄糖轉運蛋白(GLUT)的特異性結合,增強了受體介導的胞吞。前期研究顯示,2 h內,γ-Fe2O3@DMSA-DG NPs可被高葡萄糖代謝的乳腺癌MDA-MB-231及MCF-7細胞[6]、前列腺癌PC3細胞[7]靶向吸收。本研究顯示,無需借助轉染劑,該納米鐵24 h可被hUCMSCs有效吸收,當鐵濃度為32 μg/mL時,hUCMSCs標記率即可近97%。
研究[8]表明,適當濃度下SPIO標記MSCs后不會對細胞活力、增殖及分化能力造成明顯影響。理想狀態下,細胞內鐵含量越高,磁共振信號變化越大。然而,安全標記濃度條件下,細胞內鐵負重可影響細胞遷移能力,進而影響活體成像的追蹤觀察。本研究顯示,2-DG標記的納米鐵在8~128 μg/mL鐵濃度條件下,細胞活力均未見顯著性降低。MSC特異性遷移到靶器官,需跨越血管內皮細胞和細胞外基質。hBMSCs穿過骨髓內皮細胞時,hBMSCs在形態上展開并伸出偽足,以足絲狀突起的形式鉆進內皮細胞。懸浮的MSCs的平均直徑為15~19 μm[9],本研究中Transwell膜孔徑為8 μm,上室中的磁標記hUCMSCs穿過小孔到達下室,模擬了體內MSCs跨內皮細胞游出內皮的過程。本研究結果顯示,當培養液鐵濃度為128 μg/mL時,hUCMSCs遷移能力顯著下降。
在不影響細胞遷移能力的前提下,hUCMSCs細胞內SPIO含量越高,T2馳豫時間縮短越明顯,即MRI T2信號差異越大。SPIO可顯著降低T2弛豫時間,很小濃度的SPIO即可使T2信號降低。本研究各濃度鐵標記細胞T2值均較對照組低。相關研究[10]常采用MRI掃描序列中信號強度變化檢測不同鐵濃度SPIO。T2值可對物質信號強度量化表達。李春燕等[11]應用MRI多回波掃描并測量T2值,并計算R2值,發現含鐵水模T2值與含鐵水模鐵濃度呈函數關系,含鐵水模R2值與含鐵水模鐵濃度呈直線相關,認為R2值能夠對體外不同鐵濃度進行定量評估。本研究中,隨著鐵濃度升高,細胞內鐵顆粒逐級增加,磁標記hUCMSCs R2值同標記鐵濃度呈直線相關,符合這一規律。
Baghchechi等[12]將30 μg/mL鐵的Feridex直接與人神經干細胞孵育24 h,細胞磁標記率達到85%。吳莉等[8]將25、50、75、100 μg/mL鐵的SPIO(Sigma公司)-PLL混合液,張瑞平等[13]將25、50、100和150 μg/mL鐵SPIO(德國Schering公司)-PLL混合液,分別用于標記BMSCs,發現各組細胞標記率可達到100%,但100 μg/mL鐵標記濃度均影響細胞活性。Mishra等[14]研究顯示,50 μg/mL鐵的氧化鐵-PLL混合液為最適標記鐵濃度。本課題組合成γ-Fe2O3@DMSA-DG NPs較商用SPIO-PLL混合液具有更好的生物相容性,更高的安全標記濃度下,細胞內鐵含量更高。在64 μg/mL鐵標記濃度條件下,標記率達到99.56%,納米鐵標記細胞T2值較低濃度標記細胞明顯降低,說明細胞內鐵含量較低濃度標記細胞明顯增多,而干細胞遷移能力仍未受明顯影響,因此該納米鐵顆粒是較為理想的hUCMSCs標記材料。
可見,本研究制備的γ-Fe2O3@DMSA-DG NPs易于被hUCMSCs攝取,鐵濃度為64 μg/mL即可達到有效標記,對細胞活力及遷移能力無明顯影響,又可被MR T2WI序列檢測。

