老年OSAHS伴2型糖尿病患者血ET-1/NO比值變化及其與血糖和睡眠監測指標的相關性分析
李真真 付愛雙 戈艷蕾
阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)是一種常見的睡眠呼吸節律紊亂,其臨床特征為患者在夜間睡眠由于上氣道阻塞而引發的夜間間歇性低氧,導致夜間頻繁覺醒或微覺醒,從而出現日間嗜睡等情況,成人發病率在20%~40%[1],2型糖尿病伴OSAHS患者發病率約為10%,而2型糖尿病患者中,OSAHS發病率約20%。目前認為肥胖是OSAHS與糖尿病共同發病的危險因素[2-3],而肥胖、高血糖狀態及間歇性低氧導致的全身炎癥反應,可以互為因果,導致患者全身血管內皮功能受損,從而出現動脈粥樣硬化、高血壓、腦梗死等血管并發癥。目前有研究表明[4],血管內皮可以釋放內皮素-1(ET-1)、一氧化氮(NO),兩者相互作用,從而保證血管收縮功能。當機體在各種疾病狀態下,出現血管內皮障礙時,可以導致ET-1、NO釋放障礙,出現ET-1/NO異常。因此通過ET-1/NO比值,可以間接反映患者血管內皮細胞功能。本研究通過探討ET-1/NO比值變化及其與血糖和睡眠監測指標的相關性分析,為臨床從血管內皮功能角度干預OSAHS伴2型糖尿病患者提供依據。
1 對象與方法
1.1 研究對象 選取2016年3月至2017年6月于本院住院治療的多導睡眠監測(PSG)及空腹血糖檢測確診的老年OSAHS伴2型糖尿病患者78例,單純老年2型糖尿病患者41例,單純老年OSAHS患者37例。納入標準:均符合1999年WHO制定的糖尿病診斷標準[5]及2011年修訂版《阻塞性睡眠呼吸暫停低通氣綜合征診治指南》中OSAHS診斷標準[6]。排除標準:除外高血壓急癥、急性冠脈綜合征、急性腦血管意外、糖尿病酮癥酸中毒、嚴重肝腎疾病、惡性腫瘤病史患者。
1.2 研究方法 入組的所有患者均檢測血漿ET-1及血清NO,計算ET-1/NO比值,比較三組ET-1/NO比值變化及其與血糖和睡眠監測指標的相關性。
1.3 統計學處理 采用SPSS 22.0版統計軟件進行數據處理,其中,計量資料用(±s)表示,三組間比較,計量資料采用方差分析,計數資料采用χ2檢驗,采用Pearson相關分析ET-1/NO比值變化及其與血糖和睡眠監測指標的相關性,P<0.05為差異有統計學意義。
2 結果
2.1 三組患者一般臨床資料比較 三組患者年齡、性別、BMI的比較差異無統計學意義(P>0.05,表1)。
表1 三組患者一般臨床資料比較(±s)

表1 三組患者一般臨床資料比較(±s)
組別 例數 年齡/歲 性別 BMI男女老年OSAHS伴2型糖尿病組 78 68.78±11.37 47 31 24.13±3.28老年2型糖尿病組 41 71.24±10.23 23 18 25.61±3.84老年OSAHS組 37 69.56±11.75 21 16 24.53±3.12
2.2 三組患者血糖、睡眠監測指標(SpO2、AHI)及ET-1/NO比值比較 與老年2型糖尿病組患者比較,老年OSAHS伴2型糖尿病組、老年OSAHS組患者SpO2、ET-1/NO明顯降低,AHI增高(P<0.05),其中,老年OSAHS伴2型糖尿病組患者SpO2、AHI、ET-1/NO改變更為顯著(P<0.05);老年糖尿病組患者AHI值在正常范圍,老年OSAHS組患者血糖值在正常范圍,老年2型糖尿病組與OSAHS伴2型糖尿病組患者血糖比較差異無統計學意義(P>0.05,表2)。
表2 三組患者血糖、睡眠監測指標(SpO2、AHI)及ET-1/NO比值比較(±s)
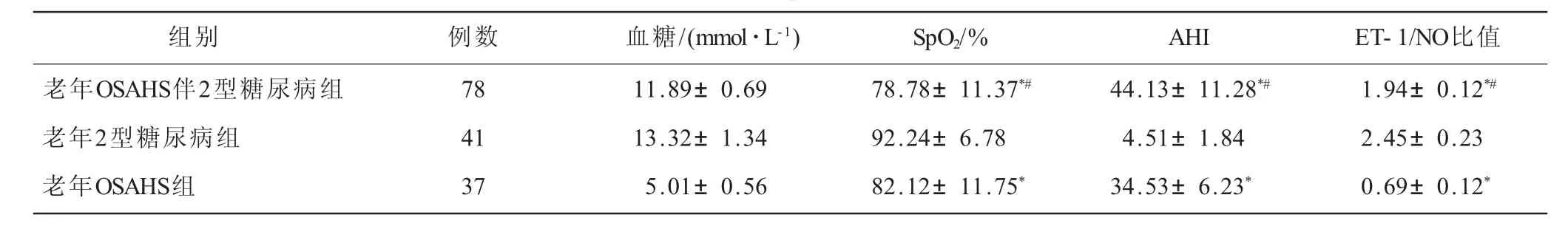
表2 三組患者血糖、睡眠監測指標(SpO2、AHI)及ET-1/NO比值比較(±s)
組別 例數 血糖/(mmol·L-1) SpO2/%老年OSAHS伴2型糖尿病組 78 11.89±0.69 78.78±11.37*#老年2型糖尿病組 41 13.32±1.34 92.24±6.78老年OSAHS組 37 5.01±0.56 82.12±11.75*AHI ET-1/NO比值44.13±11.28*# 1.94±0.12*#4.51±1.84 2.45±0.23 34.53±6.23* 0.69±0.12*
2.3 老年OSAHS伴2型糖尿病患者ET-1/NO與血糖及AHI相關性分析 直線相關分析顯示,老年OSAHS伴2型糖尿病患者血ET-1/NO比值與與血糖呈負相關(r=-0.612,P<0.05),與AHI呈負相關(r=-0.646,P<0.05,表3)。
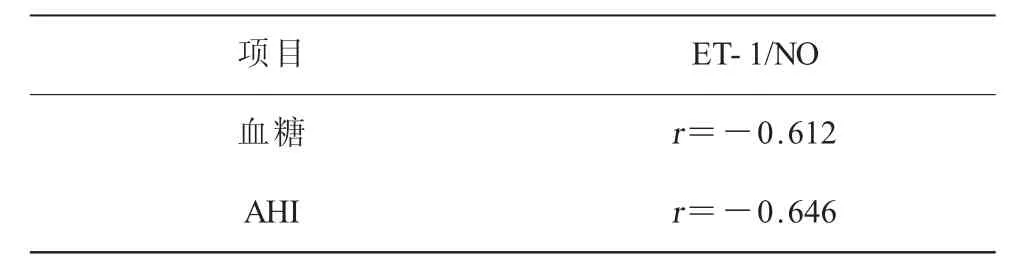
表3 老年OSAHS伴2型糖尿病患者ET-1/NO與血糖及AHI相關性分析直線相關分析
3 討論
OSAHS是一種常見的睡眠呼吸節律紊亂,其臨床特征為患者在夜間睡眠由于上氣道阻塞而引發的夜間間歇性低氧,導致夜間頻繁覺醒或微覺醒,從而出現日間嗜睡等情況。目前研究發現[7-8],OSAHS伴2型糖尿病患者發病率約為10%。由于OSAHS伴2型糖尿病患者多存在肥胖,同時伴隨的高血糖狀態及間歇性低氧等因素,可以導致患者血管內皮功能受損,繼發性導致患者出現體內高凝、血小板聚集、血流速度緩慢等,出現微小栓塞、動脈粥樣硬化等,引發多種心血管并發癥[9]。
目前研究發現[10-13],血管內皮細胞可以生成ET-1和NO,當內皮功能受損,會影響ET-1和NO生成,從而影響血管收縮舒張。但單獨ET-1和NO變化有時并不一致,因此,通過ET-1/NO比值,可以間接反映患者血管內皮細胞功能。本研究通過探討ET-1/NO比值變化及其與血糖和睡眠監測指標的相關性分析,為臨床從血管內皮功能角度干預OSAHS伴2型糖尿病患者提供依據。
本研究發現,與2型糖尿病組患者比較,OSAHS伴2型糖尿病組、OSAHS組患者SpO2、ET-1/NO明顯降低,AHI增高(P<0.05),其中,OSAHS伴2型糖尿病組患者SpO2、AHI、ET-1/NO改變更為顯著(P<0.05);直線相關分析顯示,OSAHS伴2型糖尿病患者血ET-1/NO比值與血糖呈負相關 (r=-0.612,P<0.05),與AHI呈負相關(r=-0.646,P<0.05)。這提示OSAHS伴2型糖尿病患者與單純OSAHS患者和糖尿病患者比較,血糖和睡眠監測指標紊亂更為嚴重,血ET-1/NO比值顯著降低,提示OSAHS伴2型糖尿病患者血管內皮受損程度更加嚴重。分析OSAHS伴2型糖尿病組患者損傷更為嚴重原因如下:①一方面由于糖尿病本身,患者存在明顯糖代謝異常,而血葡萄糖是ET釋放劑,可以導致ET-1釋放增加;同時,糖尿病患者合并存在脂代謝異常,可以導致血液黏稠度增高,血流緩慢,微小循環血液黏滯,損傷血管內皮[14-15];而當患者同時存在OSAHS,患者糖脂代謝異常更為顯著,因此,血管內皮受損亦較為明顯。②除了血糖、血脂影響之外,由于OSAHS還可以引發間歇性低氧及復氧狀態,可以出現體內氧化應激反映,同時可以導致血管緊張素Ⅱ、血栓素B2等分泌,進一步促進ET-1的生成增多[16]。
綜上所述,本研究中發現在OSAHS伴2型糖尿病患者ET-1/NO比值失調,并且與患者血糖及睡眠紊亂指標相關,這提示OSAHS伴2型糖尿病患者存在較為嚴重的血管內皮功能損傷,因此,早期針對血管內皮功能損傷的治療,可以避免進一步心腦血管并發癥的發證,有利于優化臨床支持及治療[17]。但具體針對血管內皮功能損傷的藥物干預療效還需進一步研究。

