尼美舒利原料藥含量的2種測定方法的比較
羅 誠,陳 莉,朱躍芳
尼美舒利是一種非甾體抗炎藥,能選擇性地抑制環氧化酶COX2,在發揮解熱鎮痛消炎作用的同時,減少了消化性潰瘍等非甾體抗炎藥物常見的不良反應。臨床上常用于慢性關節炎、術后或急性創傷后疼痛、急性上呼吸道感染等疾病的治療[1,2]。 尼美舒利分子中含磺酰胺結構,具有弱酸性,《中國藥典》2015年版二部采用電位滴定法,以氫氧化鈉滴定液測定尼美舒利原料藥的含量[3]。其他文獻中,尼美舒利制劑的含量測定以及血藥濃度監測常采用高效液相色譜法、紫外分光光度法、薄層掃描法等[4-6],少有以高效液相色譜法測定尼美舒利原料藥含量的報道。
筆者采用高效液相色譜法測定尼美舒利原料藥的含量,并與《中國藥典》2015年版二部中的電位滴定法進行比較,現報告如下。
1 儀器與試藥
Agilent 1260高效液相色譜儀(美國安捷倫公司);Agilent TC-C18色譜柱(250.0mm×4.6mm,5μm)、Inertsil ODS-3 色譜柱(250.0 mm×4.6 mm,5 μm)、資生堂 CAPCELL PAK C18色譜柱(250.0 mm×4.6 mm,5 μm)、Waters XTerra C18色譜柱(250.0 mm×4.6 mm,5 μm);916 Ti-Touch 自動電位滴定儀(瑞士萬通公司);888 Titrino自動電位滴定儀(瑞士萬通公司);ZDJ-3D全自動電位滴定儀 (北京先驅星科技發展有限公司);848 Titrino plus自動電位滴定儀(瑞士萬通公司);AG-135電子分析天平(梅特勒-托利多)。
尼美舒利對照品 (批號100555-201202,含量100.0%,中國食品藥品檢定研究院);尼美舒利原料藥(批號 141182、141183,以下分別用 1#、2# 代替,天津藥物研究院藥業);丙酮(批號200808、201012,分析純,中國醫藥集團上海化學試劑公司)、丙酮(批號201205、201307,色譜純,天津市化學試劑研究所),磷酸、氨水均為分析純,水為超純水。
2 方法與結果
2.1 高效液相色譜法
2.1.1 色譜條件 采用Agilent TC-C18色譜柱(250 mm×4.6 mm,5 μm); 流動相為 0.1%磷酸溶液(用氨水調 pH 至 7.0)-乙腈 (60∶40); 流速 1.0 ml/min,檢測波長 393 nm,進樣量 10 μl。
2.1.2 溶液的配制 對照品溶液的配制:精密稱取經105℃干燥2 h的尼美舒利對照品約20 mg,置100 ml量瓶中,加流動相溶解并稀釋至刻度,得對照品儲備液,精密量取對照品儲備液10 ml置20 ml量瓶中,加流動相稀釋至刻度,搖勻,得到濃度約為100 μg/ml的對照品溶液。同法制備供試品溶液。
2.1.3 專屬性試驗 取2.1.2項下制備的對照品溶液和供試品溶液各10 μl,注入高效液相色譜儀,記錄色譜圖和光譜圖。圖1~4表明,供試品和對照品在該色譜條件下出峰時間吻合,峰型良好,光譜圖一致,說明該方法專屬性良好。
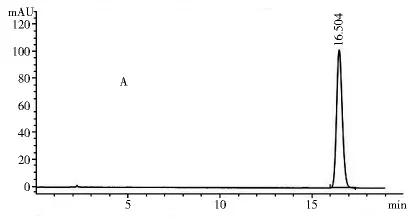
圖1 對照品色譜圖
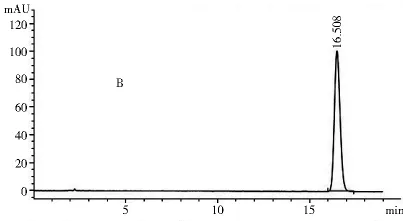
圖2 供試品色譜圖
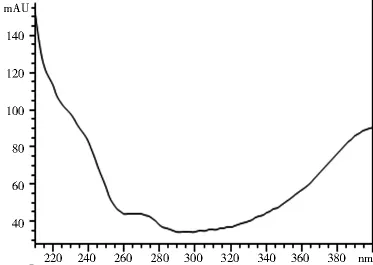
圖3 對照品光譜圖
2.1.4 線性范圍考察 精密量取2.1.2項下的對照品儲備溶液適量,用流動相稀釋成濃度為10、40、80、120、160、200 μg/ml的梯度對照品溶液。 精密量取各梯度對照品溶液10 μl,注入液相色譜儀,以尼美舒利濃度為橫坐標(X),色譜峰面積為縱坐標(Y)進行回歸分析,得到回歸方程為:Y=21.109X-1.583,r=1.000,說明尼美舒利在 10.00~200 μg/ml的濃度范圍內線性關系良好。
2.1.5 精密度試驗 取同一供試品溶液(批號1#),按2.1.1項下的方法連續進樣6次,記錄色譜圖,色譜峰面積RSD(n=6)為0.2%,說明儀器精密度良好。
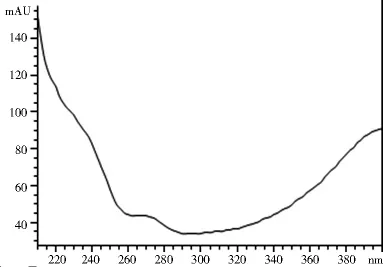
圖4 供試品光譜圖
2.1.6 重復性試驗 取同一批尼美舒利原料藥(批號1#),按2.1.2項下的方法制備供試品溶液共6份,進行平行測定,結果6次測定的平均含量為99.73%,RSD(n=6)為 0.2%,說明該方法重復性良好。
2.1.7 穩定性試驗 取同一供試品溶液,在室溫下放置 0、2、4、6、12、24 h 后進樣, 記錄色譜峰面積,RSD(n=6)為 0.4%,說明供試品溶液在 24 h內穩定。
2.1.8 加樣回收率試驗 將供試品(批號1#,含量99.73%)稱樣量減半,共稱取9份,分成3組,每組分別加入相當于供試品80%、100%、120%的尼美舒利對照品,配制成供試品溶液。按2.1.1的條件進行測定,計算加樣回收率,結果9份供試品加樣回收率為98.61%~100.61%,平均加樣回收率為99.52%,RSD(n=9)為 0.7%。 見表 1。
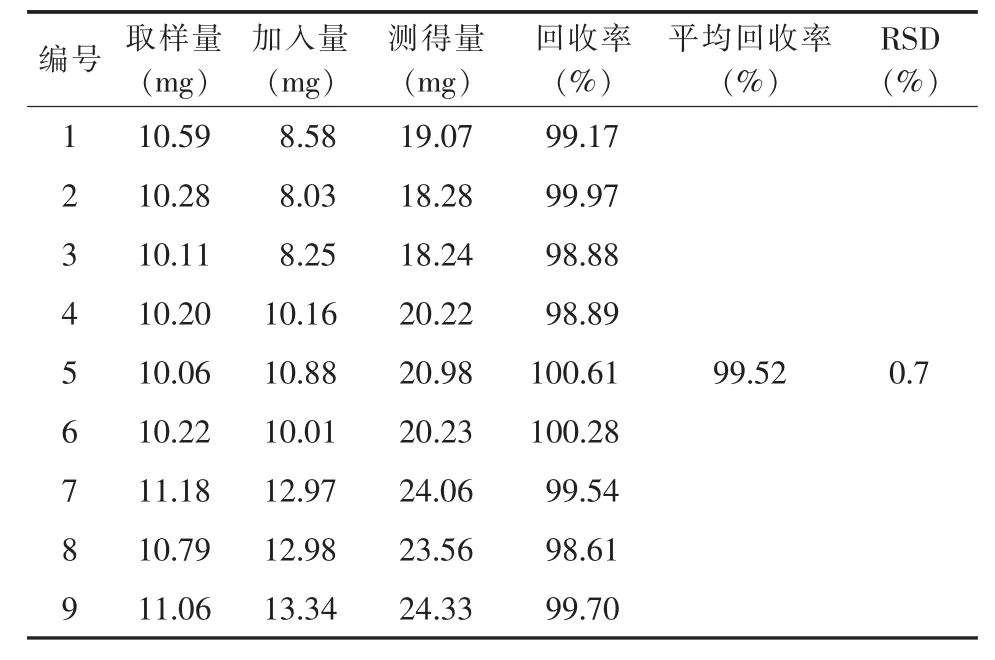
表1 HPLC法加樣回收率測定結果
2.1.9 方法耐用性考察 采用同一批尼美舒利原料藥(批號 1#),按 2.1.2 項下的方法制備供試品溶液,分別使用Agilent TC-C18色譜柱 (250 mm×4.6 mm,5 μm)、Inertsil ODS-3 色譜柱 (250 mm×4.6 mm,5 μm)、 資生堂 CAPCELL PAK C18色譜柱(250 mm×4.6 mm,5 μm)、Waters XTerra C18色譜柱(250 mm×4.6 mm,5 μm)測定供試品含量,結果含量分別為 99.73%、100.12%、99.79%、99.68%,RSD 為0.2%。將上述供試品溶液,采用 Agilent TC-C18色譜柱(250 mm×4.6 mm,5 μm), 在柱溫為 25 ℃、30 ℃、35℃、40℃下分別進樣,計算含量,結果分別為99.80%、99.92%、100.06%、99.71%,RSD 為 0.2%。改變流動相 pH 值為 6.8、7.0、7.2 測定供試品含量,每個pH值下各平行測定兩次,結果主峰拖尾因子均<2, 含量分別為 99.87%、99.75%、99.89%、100.00%、100.03%、99.51%,RSD 為 0.2%。 改變流動相比例為(55∶45)、(60∶40)、(65∶35)測定供試品含量,每個條件下各平行測定兩次,結果主峰與各雜質峰達到基線分離,拖尾因子均<2,含量分別為 99.96%、99.77%、99.90%、100.15%、99.74%、100.04%,RSD 為 0.2%。說明該方法耐用性良好。
2.2 電位滴定法
2.2.1 電位滴定參數 樣品滴定參數:采用DET動態滴定模式,等當點判據標準30 mV,信號漂移20 mV/min,等當點后體積 1.0 ml。空白滴定參數:采用MET等量滴定模式,等當點判據標準5 mV,滴定液增量 0.005 ml/min,信號漂移 10 mV/min,等當點后體積 0.5 ml。
2.2.2 測定方法[3]精密稱取尼美舒利原料藥約0.25 g,加中性丙酮(對酚酞指示液顯中性)40 ml使其溶解,加水20 ml,照電位滴定法(《中國藥典》2015年版四部通則 0701),用氫氧化鈉滴定液(0.1 mol/L)滴定,并將結果用空白試驗校正。每1 ml氫氧化鈉滴定液(0.1 mol/L)相當于 30.83 mg 的 C13H12N2O5S。
2.2.3 重復性試驗 取同一批尼美舒利原料藥(批號 1#),精密稱取 6 份,按 2.2.2 的方法在 916 Ti-Touch自動電位滴定儀上測定,得到平均含量為100.04%,RSD(n=6)為 0.5%。
2.2.4 加樣回收率試驗 取已知含量的同一批尼美舒利原料藥(批號 1#,含量 100.04%),按 2.2.2 項下的方法稱取供試品6份,供試品取樣量減半,加入相當于供試品100%的對照品后,在916 Ti-Touch自動電位滴定儀上測定,計算回收率,結果見表2。
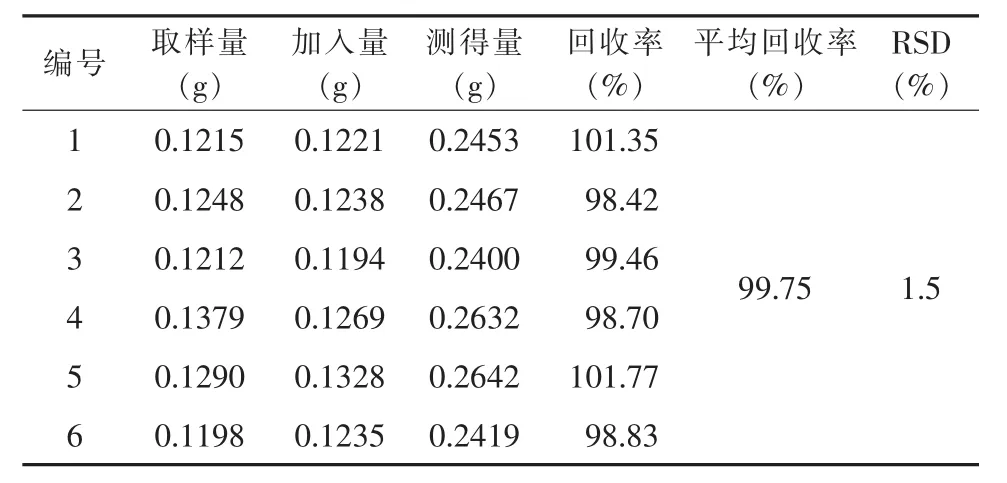
表2 電位滴定法加樣回收率測定結果
2.2.5 中性丙酮的考察 在調制中性丙酮(對酚酞指示液顯中性)時發現,酚酞在丙酮中顯色不明顯,終點難以判斷。若滴加的氫氧化鈉滴定液過量,多余的氫氧化鈉會與尼美舒利反應造成結果偏低。該次實驗考察了中性丙酮(顯微紅)、中性丙酮(稍顯微紅)及不調中性丙酮對結果的影響,結果見表3。可以看出,當電位滴定參數設置合理時,由于空白已扣除,丙酮是否調中性對結果幾乎無影響,但調過頭會導致結果偏低。由于空白滴定突躍不明顯,應適當將“等當點后體積”適當設大,以防出現偽終點。
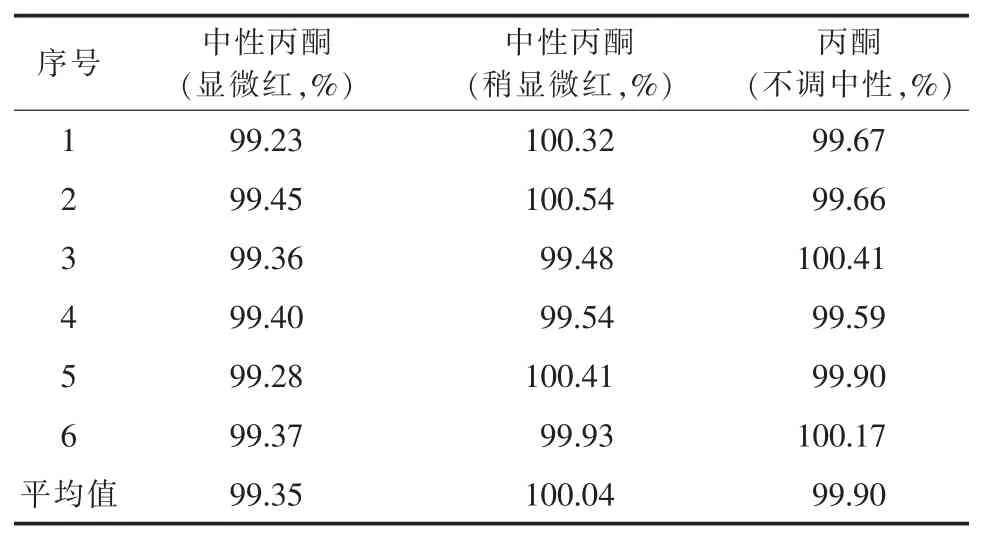
表3 中性丙酮考察結果
2.2.6 方法耐用性考察 采用同一批尼美舒利原料藥(批號 1#),按 2.2.2 項下的方法制備供試品溶液,分別使用916 Ti-Touch自動電位滴定儀(瑞士萬通公司)、888 Titrino自動電位滴定儀(瑞士萬通公司)、848 Titrino plus自動電位滴定儀(瑞士萬通公司)、ZDJ-3D全自動電位滴定儀 (北京先驅星科技發展有限公司)測定供試品含量,結果含量分別為100.04%、100.53%、99.68%、99.62%,RSD為0.5%;分別使用兩廠家共四批次的丙酮 (分析純和色譜純各兩批)作為溶劑,按2.2.2項下的方法測定,結果分別為 100.26%、99.57%、99.83%、100.37%,RSD為0.4%;分別使用4份不同人員調制的中性丙酮作為溶劑,按2.2.2項下的方法測定,結果分別為100.07%、99.43%、99.78%、100.28%,RSD 為 0.4%。
2.3 兩種方法測定結果比較[7]取兩批尼美舒利原料藥(批號1#,2#),用高效液相色譜法和電位滴定法分別測定含量,結果如表4所示。將兩組結果進行F檢驗,得到在95%置信水平上兩批樣品F值均小于F臨界值,說明兩種方法在精密度上無明顯差異。進而用t檢驗分析,結果兩批樣品t值分別為2.141 和 1.460,均小于臨界值 (t0.05/2,5=2.571),表明兩種方法測得的尼美舒利含量無統計學差異 (P>0.05)。
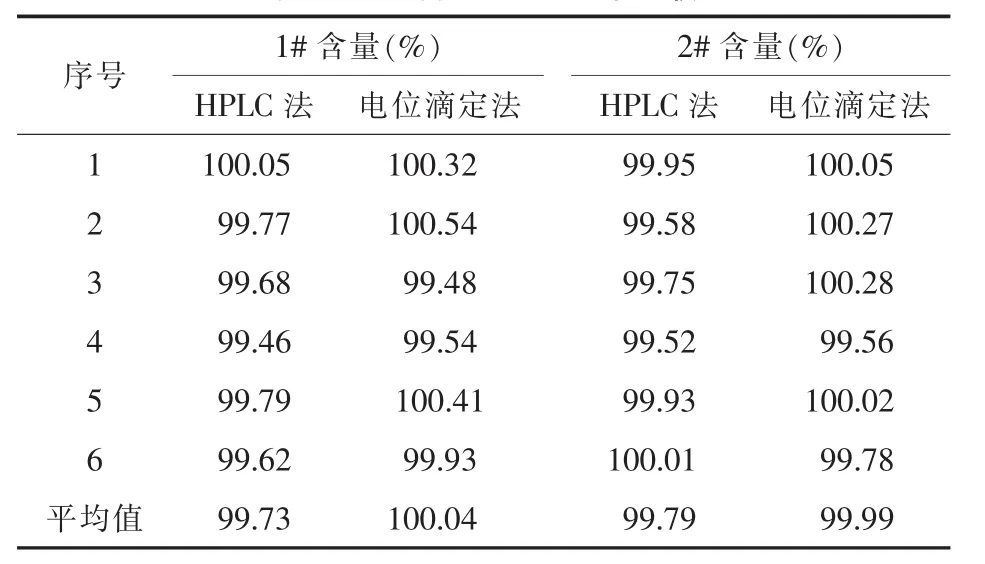
表4 兩種方法測定結果比較
3 討論
3.1 高效液相色譜法 雖然中國、英國等多國藥典常采用滴定法測原料藥的含量,ICH(international councilpor harmonization,人用藥品注冊技術要求國際協調會)也認可容量法[8,9],但與容量法相比,HPLC法具有專屬性強、靈敏度高、準確性好、取樣量少和方便大批量分析等優點。特別是當原料藥中存在雜質或儲存期降解產生雜質,對滴定造成潛在干擾時,HPLC法更顯示出獨特的優勢。通過對兩批尼美舒利原料進行測定,發現HPLC法和電位滴定法測定結果無統計學差異,但HPLC法專屬性更強、重復性及耐用性更佳。
3.2 電位滴定法 電位滴定法是容量法中的一種,具有操作簡便、分析時間短、準確度高等優點[10]。2017年中國食品藥品檢定研究院發起了《尼美舒利含量測定能力驗證》,檢驗方法是電位滴定法,參與此次能力驗證的實驗室為141家,取得滿意結果的為 109家[11],通過率 77.30%,低于同年其他項目通過率的平均值,提示該方法可能耐用性較差。該文研究發現,用電位滴定法測定尼美舒利含量時應注意兩點:一是滴定參數的設置。空白滴定應設置成MET等量滴定模式,將滴定液增量設置成最小,以防過量,同時應適當調高等當點后體積,以防止得到的是偽終點。二是中性丙酮的配制。方法中使用到中性丙酮 (對酚酞指示液顯中性),該次研究發現,當滴定參數設置合理時,丙酮是否調中性對測定結果沒有影響,但由于調中性時丙酮變色不明顯,容易調過頭導致結果偏低。
兩種方法均可用于尼美舒利原料藥的質量控制,各有優勢,采用電位滴定法時應注意參數的設置以及中性丙酮的配制。

