載芬維A銨脂質體體外對惡性黑素瘤細胞增殖、凋亡和遷移的影響
崔艾麗 金哲虎
133000吉林省延吉市,延邊大學附屬醫院皮膚科
惡性黑素瘤是源自黑素細胞的惡性腫瘤,雖然其發生率僅占皮膚腫瘤的5%左右,但因增殖快、轉移快、易復發的特點,成為皮膚腫瘤致死的首位原因,占所有致死病例的75%[1]。芬維A銨[N-(4-hydroxyphenyl)retinamide,4-HPR]是一種維A酸類衍生物,具有廣譜抗腫瘤作用,與傳統維A酸類抗腫瘤藥物相比,具有高效、低毒的特點。但是水溶性低及靶向性差等缺點導致其生物利用度低,限制其在臨床上的進一步應用。有學者認為納米靶向治療技術有可能是克服目前治療困難的一個潛在途徑[2-3]。脂質體是靶向制劑中的一種,具有毒性低、用藥劑量低等優點,并且能有效避免耐藥性,使被包封藥物得到有效保護,藥物釋放控制更有效。本課題組在前期實驗中已經成功制備4-HPR脂質體,大幅度提高藥物的生物利用度[4]。本研究觀察4-HPR脂質體對A375及B16F10黑素瘤細胞的抑制作用及機制。
材料與方法
一、材料
1.細胞來源:人黑素瘤細胞A375和小鼠黑素瘤細胞B16F10均來自中國醫學科學院基礎醫學研究所細胞中心。
2.試劑:4-HPR(美國Sigma-aldrich公司,純度98%),CCK-8(日本同仁化學研究所),Hoechst33258(上海碧云天生物技術研究所),碘化丙錠染液(北京賽馳生物科技有限公司),示蹤劑C6(美國Sigma-Aldrich公司)。膜聯蛋白V-異硫氰酸熒光素/碘化丙錠凋亡檢測試劑盒(南京凱基生物發展公司)。
3.儀器:激光共聚焦顯微鏡(Carl Zeiss LSM 710,德國蔡司公司),流式細胞儀(FACSAria,美國BD公司),酶標儀(Spectra Max190,美國MD公司)。
二、方法
1.細胞增殖抑制實驗(CCK-8法):用CCK-8法檢測空白脂質體對A375和B16F10細胞的增殖抑制,驗證載體材料的生物相容性及毒性高低。結果顯示,空白脂質體在濃度0.1~70 g/L范圍內的細胞增殖抑制率均小于5.67%,說明載體材料的生物相容性良好,無毒副作用。將細胞分為對照組(只加等量的細胞和培養基,不加藥)、4-HPR原料藥物組(4-HPR組)和4-HPR脂質體組(4-HPR-L組)。收集對數生長期A375細胞、B16F10細胞,接種于96孔板,細胞密度為2 × 103/孔(200 μl)。37 ℃、5%CO2培養箱中孵育24 h。分別更換含不同濃度(0.1、1、15、30、50、70 mg/L)4-HPR和4-HPR-L的新鮮培養基繼續孵育48 h,設對照孔和調零孔。吸去培養液,加入10%CCK-8無血清DMEM培養液,100 μl/孔,置培養箱內培養2 h后取出,酶標儀波長設定為450 nm,測定每孔吸光度(A值)。細胞存活率(%)=(A實驗組-A調零組)/(A對照組-A調零組)×100%。
2.Hoechst33258染色觀察細胞細胞凋亡:將A375、B16F10細胞置于24孔板內制備爬片,細胞密度為2 × 104/孔,37 ℃、5%CO2培養箱中孵育24 h,吸去培養液,分為3組,對照組只加新鮮培養液,其他兩組分別更換含30 mg/L 4-HPR(根據CCK-8結果,選取細胞存活率50%時對應的藥物濃度進行體外藥效學評價)的4-HPR和4-HPR-L的培養液繼續孵育48 h,吸去培養液,冷PBS洗2次,每孔加300 μl 4%多聚甲醛避光固定10 min,再用PBS洗2次,每次3 ~ 5 min。加入Hoechst33258(1 mg/L)300 μl室溫暗室染核10 min,PBS清洗3次(5 min/次),取出爬片,將細胞附著面朝下,蓋于滴有10 μl抗熒光淬滅封片劑的載玻片上,熒光顯微鏡下觀察細胞核形態。
3.流式細胞儀檢測細胞凋亡:取對數生長期A375、B16F10細胞,以15 × 104/孔(2 ml)的密度置于6孔板內,37℃、5%CO2培養箱中孵育24 h,吸去舊培養液,將A375細胞和B16F10細胞分別分為空白組、4-HPR組和4-HPR-L組,4-HPR和4-HPR-L組分別加入含有30 mg/L 4-HPR的4-HPR和4-HPR-L的培養液,對照組只加新鮮培養液,繼續孵育48 h后,收集各孔培養液于EP管內,離心(4℃,500×g,5 min),收集細胞。冷PBS沖洗6孔板1~2次,用0.25%不含乙二胺四乙酸的胰酶消化,收集細胞,同之前收集的細胞一起再次離心,棄上清液,冷PBS清洗1~2次,再離心,每個EP管內加入結合緩沖液500 μl,混勻,避光,加入5 μl膜聯蛋白V-異硫氰酸熒光素,混勻后再加入5 μl碘化丙錠染液,混勻,室溫下靜置10 min,過尼龍網,流式細胞儀檢測,記錄各組細胞凋亡數據并分析。
4.細胞劃痕實驗:取對數生長期A375、B16F10細胞,以10×104/孔的密度置于12孔板內,37℃、5%CO2培養箱中孵育24 h,用無菌槍頭(200 μl槍頭)在12孔板內做人工劃痕,吸去舊培養液并用PBS清洗3次,分為3組,兩組分別加入新鮮的含有30 mg/L 4-HPR的4-HPR和4-HPR-L培養液1 ml,對照組加入1 ml新鮮培養液,倒置顯微鏡拍照記錄給藥后即刻、24 h、48 h劃痕愈合情況。
5.激光共聚焦顯微鏡觀察脂質體入胞情況:將A375、B16F10細胞置于24孔板內制備爬片,細胞密度為2×104/孔,37℃、5%CO2培養箱中孵育24 h后給含有示蹤劑C6脂質體(終濃度為5 mg/L)的培養液繼續孵育,根據給藥時間分為1、5、15、60 min組,分別于給藥后不同時間,用冷PBS漂洗3次,每孔加入300 μl 4%多聚甲醛避光固定10 min,再用PBS清洗2次,加入300 μl DAPI工作液染核10 min,PBS清洗3次,取出爬片,將細胞附著面朝下,蓋于滴有10 μl抗熒光淬滅封片劑的載玻片上,在488 nm波長激發光條件下,于激光共聚焦熒光顯微鏡下觀察脂質體進入細胞的情況。
三、統計學處理
所有數據采用SPSS22.0軟件進行統計分析,計量資料以±s表示,多組間數據比較采用單因素方差分析,兩兩組間比較采用t檢驗。以P<0.05為差異有統計學意義。
結 果
一、細胞增殖抑制實驗
結果顯示,4-HPR與4-HPR-L對A375和B16F10的增殖具有抑制作用。給藥48 h后,0.1、1、15、30、50、70 mg/L 4-HPR-L組A375和B16F10細胞存活率低于同濃度4-HPR組,差異均有統計學意義(A375細胞組t值分別為 8.019、8.298、11.455、19.978、33.672、16.314,均P< 0.01;B16F10細胞組t值分別為 3.573、3.153、9.953、4.019、8.097、7.53,P< 0.05或0.01)。見圖1、2。

圖1 CCK-8法觀察同濃度芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)對A375細胞的增殖抑制作用(n=5) a:同濃度4-HPR、4-HPR-L組比較,均P<0.01
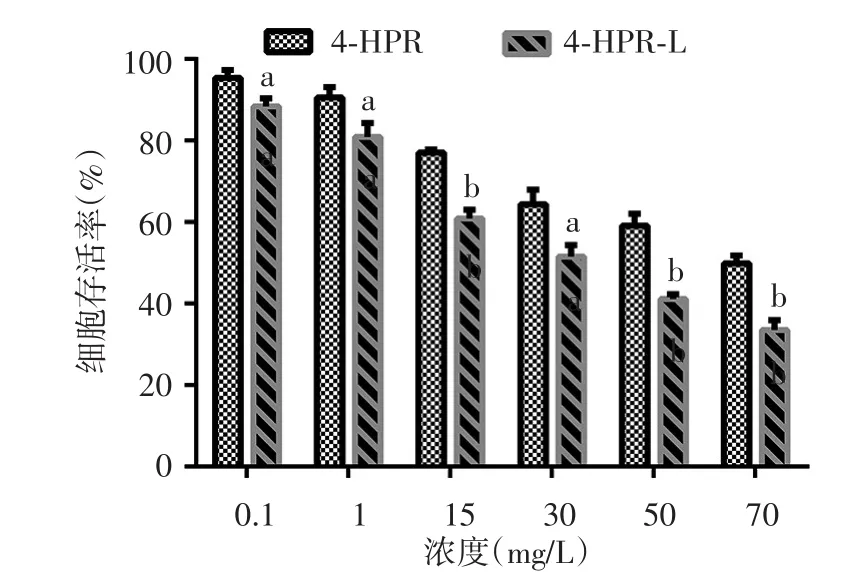
圖2 CCK-8法觀察同濃度芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)對B16F10細胞的增殖抑制作用(n=5) 同濃度4-HPR、4-HPR-L組比較,a:P < 0.05;b:P < 0.01
二、Hoechst33258染色
對照組、4-HPR組A375和B16F10細胞無明顯變化,染色質均勻分散在細胞核中,4-HPR組細胞質略呈亮藍色,而4-HPR-L組細胞體積變小,細胞質濃縮,細胞核裂解為碎塊(圖3箭頭所示),產生凋亡小體等凋亡特征。

圖3 Hoechst 33258染色觀察兩種黑素瘤細胞在芬維A銨(4-HPR)組、載4-HPR脂質體(4-HPR-L)誘導下凋亡細胞核的形態(×40) 黃色箭頭示凋亡小體
三、細胞凋亡檢測結果
給藥48 h后,4-HPR組、4-HPR-L組和對照組之間A375和B16F10細胞凋亡率差異均有統計學意義(F值分別為206.236、128.204,均P<0.001)。其中,A375細胞對照組凋亡率顯著低于4-HPR組和4-HPR-L組(t值分別為6.999、22.933,均P<0.01),4-HPR組顯著低于4-HPR-L組(t值為11.412,P<0.01)。3組B16F10細胞凋亡率變化趨勢與A375細胞類似,其中對照組與4-HPR組和4-HPR-L組相比,t值分別為5.409、15.850,4-HPR組和4-HPR-L組相比,t值為9.372,均P< 0.01。見圖4、5。
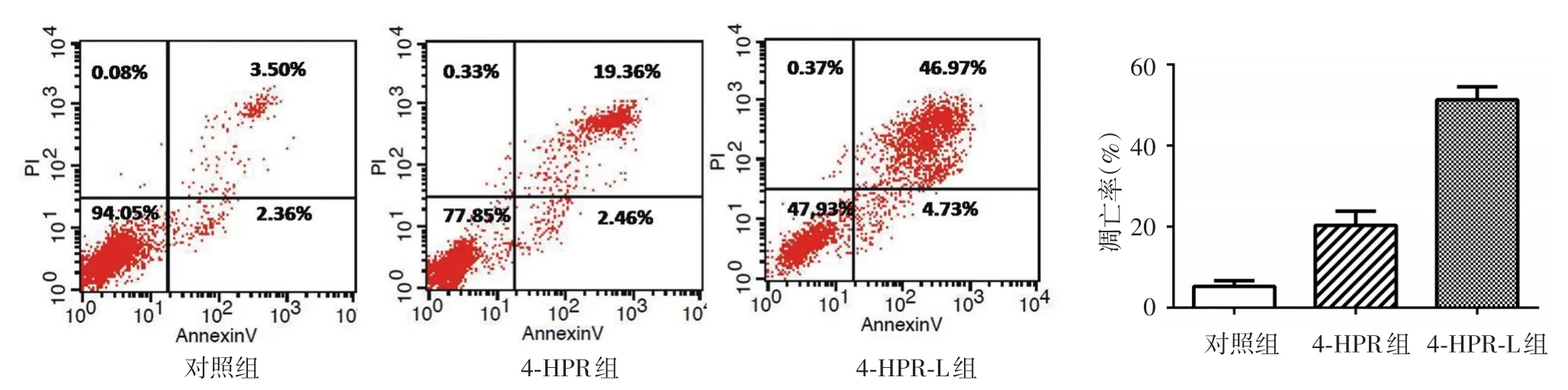
圖4 流式細胞儀檢測芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)對A375細胞凋亡率的影響 4-HPR-L組細胞凋亡率顯著高于4-HPR組和對照組(P<0.01)

圖5 流式細胞儀檢測芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)對B16F10細胞凋亡率的影響 4-HPR-L組細胞凋亡率顯著高于4-HPR組和對照組(P<0.01)
四、細胞劃痕實驗
A375和B16F10細胞與4-HPR或4-HPR-L共孵育后均出現了不同程度劃痕愈合。對照組在孵育48 h后幾乎完全愈合,4-HPR組也出現了明顯的劃痕愈合,而4-HPR-L組劃痕的寬度沒有明顯改變,劃痕依舊清晰可見。見圖6、7。

圖6 相同濃度芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)作用不同時間對A375細胞平面遷移的影響(×40)

圖7 相同濃度芬維A銨(4-HPR)、載4-HPR脂質體(4-HPR-L)在不同時間對B16F10細胞平面遷移的影響(×40)
五、激光共聚焦顯微鏡觀察脂質體入胞情況
給藥1 min后,細胞內有少量C6綠色熒光,5 min和15 min時細胞內綠色熒光增多,60 min時,細胞內有很強的綠色熒光,細胞核內也可見綠色熒光,說明脂質體包載的藥物能成功進入細胞,且入胞速度很快。見圖8。

圖8 共聚焦顯微鏡觀察不同時間點A375和B16F10細胞對C6脂質體的攝取情況 C6顯示綠色熒光,為脂質體示蹤劑;DAPI顯示藍色熒光,為細胞核染色劑
討 論
近年來,關于4-HPR對腫瘤細胞的抑制作用成為眾多學者研究的熱點。4-HPR通過抑制細胞增殖、促進細胞分化并誘導其凋亡、影響某些信號途徑的傳導等機制來抑制腫瘤細胞增殖[5]。有研究報道,4-HPR可通過PI3K-Akt-mTOR通路[6]、FAK/AKT/GSK3β通路、NF-κB通路的多個環節產生影響,或者調控細胞周期和應激反應作用于細胞[7],也可通過改變細胞內活性氧的生成及引發自噬[8]、線粒體膜電位的變化、細胞色素C的分泌等多種因素共同發揮作用[9]。
本文細胞增殖抑制實驗中,先進行大范圍濃度初篩,多次實驗后確定濃度范圍在0.1~70 mg/L內。實驗證實制備的4-HPR-L生物相容性良好,且4-HPR-L與4-HPR原料藥相比,藥物的細胞毒性作用提高,可更有效地抑制腫瘤細胞增殖。Hoechst33258染色顯示,給藥后A375和B16F10細胞出現了凋亡的顯著特征,而流式細胞儀檢測的結果也顯示4-HPR-L組腫瘤細胞的凋亡率顯著高于HPR組,與上述細胞增殖實驗結果相一致。
侵襲和遷移在惡性腫瘤轉移過程中發揮著重要的作用,侵襲和遷移能力往往是檢測腫瘤惡性程度的指標之一[10]。我們通過在體外培養的單層A375和B16F10細胞上制造人工劃痕,觀察兩種細胞向空白劃痕處遷移的情況,發現4-HPR-L能更好地抑制A375細胞和B16F10細胞平面遷移,具有體外抗轉移的能力。共聚焦顯微鏡觀察也證實,細胞能很快對脂質體進行攝取。下一步我們將進行動物體內實驗研究,進一步驗證4-HPR-L生物利用度及對細胞凋亡和遷移能力的影響。
綜上所述,4-HPR-L能更好地進入A375細胞、B16F10細胞,且能有效抑制A375細胞、B16F10細胞的增殖并誘導其凋亡,為今后4-HPR-L用于治療黑素瘤提供了理論依據。

