M13-IN5重組噬菌體的構建與鑒定及其對沙眼衣原體的作用研究
練婷婷 魏世娟 劉原君 任杰 王生 郭媛麗 郭睿 劉全忠 邵麗麗
300052天津醫科大學總醫院皮膚性病科
沙眼衣原體(Ct)泌尿生殖道感染的發病率逐年增高,已居性傳播疾病的首位[1]。據WHO統計,全世界每年大約新發沙眼衣原體感染約9 200萬例[2]。約2/3的沙眼衣原體感染者沒有臨床癥狀,易被忽視,導致衣原體在宿主體內持續感染,引起一系列嚴重的并發癥和后遺癥[3]。雖然許多學者把精力投入到衣原體疫苗研究中,但迄今為止尚未獲得具有免疫保護作用的疫苗[4],而且目前抗生素治療效果不佳,難以將衣原體徹底清除[5]。衣原體噬菌體是一種以衣原體為宿主的噬菌體,能引起衣原體始體裂解性感染,并依靠簡單的黏附作用傳給下一代原體,目前衣原體噬菌體已因為能夠引起衣原體病變并裂解而作為生物制劑用于衣原體感染的治療[6]。但是迄今仍沒有發現Ct的噬菌體。我們前期將純化的衣原體噬菌體衣殼蛋白VP1作用于Ct,發現其能明顯抑制Ct,對VP1蛋白進行分析推測IN5環為最重要的功能區[7]。本研究通過構建帶有IN5環蛋白序列的重組噬菌體,觀察其體外對Ct的作用,希望為Ct感染提供精準、特異、有效的生物治療。
材料與方法
一、實驗材料
Hela細胞株、Ct E型標準株和鼠抗VP1多克隆抗體由天津性傳播疾病研究所提供。M13噬菌體及大腸桿菌E.coliK12標準株ER2738和ECORI限制性內切酶產自美國NEB公司,In-Fusion HD克隆試劑盒和Taq DNA聚合酶為日本TaKaRa公司產品,預染蛋白分子量標記物為美國Thermo公司產品,堿性磷酸酶綴合的Affinipure山羊抗小鼠IgG產自美國Proteintech公司,兔抗FD段噬菌體抗體產自美國R&D公司,異硫氰酸熒光素(FITC)標記的山羊抗兔IgG二抗及Alexa Fluor594標記的山羊抗鼠IgG二抗產自北京索萊寶公司,CCK8試劑盒產自美國MCE公司,所有引物均由蘇州金唯智(北京)生物科技有限公司合成。
二、細胞培養
取對數生長期Hela細胞,制備Hela細胞懸液接種至24孔板,細胞密度4 × 105/ml,每孔500 μl,置于37℃、5%CO2孵箱中培養至70%~80%的密集度。
三、構建重組噬菌體
利用DNA重組技術,構建表達衣原體噬菌體phiCPG1衣殼蛋白VP1的IN5環蛋白的重組M13噬菌體,將外源基因直接連接至pIII蛋白編碼基因的5′端,在噬菌體裝配過程中展示在噬菌體表面,產生與pIII蛋白融合的外源蛋白質,見圖1。具體步驟如下:采用PCR技術擴增獲得線性M13載體,正向引物 5′-GATTTAGGTTCGACTTCTTCGGCCGAAACTG TTGAAAGTTG-3′,反向引物5′-AACAGGAACAATA CCAGAGTGAGAATAGAAAGGTACCACTAAAGG-3′;反應條件為94℃ 4 min,94℃ 30 s、65℃ 40 s、72℃40 s共30個循環,72℃10 min。根據IN5基因序列設計引物,引物5′端包含將要連接的DNA片段末端完全同源的15個堿基,正向引物5′-GTACCTTTCTATTCTCACTCTGGTATTGTTCCTGTTCAAGGTTTAGG-3′,反向引物5′CTTTCAACAGTTTCGGCCGAAGAA GTCGAACCTAAATCTACATAAGCCC-3′,反應條件為94 ℃4 min,94 ℃30 s、65 ℃40 s、72 ℃ 40 s共30個循環,72℃10 min。采用10 g/L瓊脂糖凝膠電泳檢測PCR產物,通過凝膠提取分離目的片段進行離心柱純化。建立In-Fusion克隆反應體系,包括5×In-Fusion高保真PCR酶2 μl、線性化載體1 μl、純化的DNA插入片段2 μl、去離子水5 μl,混合均勻后在50℃孵育15 min,然后轉入ER2738大腸桿菌感受態細胞,加入500 μl LB培養基,混勻后置于37℃,160 r/min振蕩培養1 h,然后將已轉化的感受態細胞加到50 mg/L LB瓊脂培養基上,倒置平板,37℃過夜。
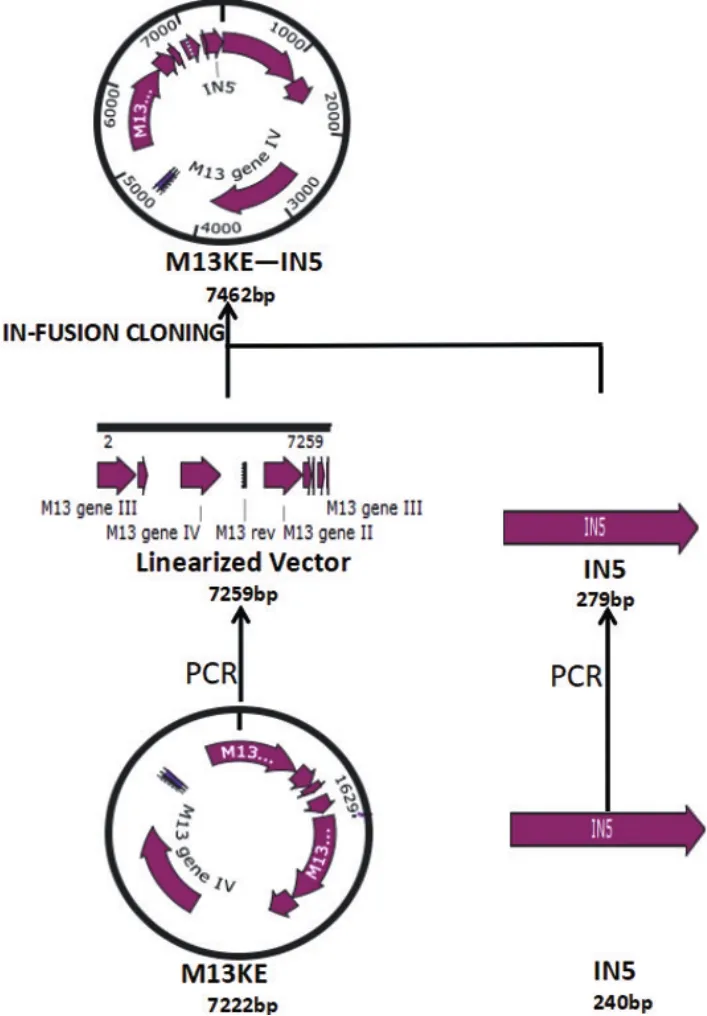
圖1 M13-IN5重組噬菌體構建策略圖
四、重組噬菌體目的基因檢測
1.PCR擴增IN5環目的片段:從實驗平板中挑取重組噬菌體單克隆,用試劑盒(北京索萊寶科技有限公司)提取噬菌體DNA,進行PCR擴增。正向引物5′-GTACCTTTCTATTCTCACTCTGGTATTGTTC CTGTTCAAGGTTTAGG-3′,反向引物5′-CTTTCAAC AGTTTCGGCCGAAGAAGTCGAACCTAAATCTACA TAAGCCC-3′。PCR反應體系為50 μl,包括高保真擴增酶25 μl、上下游引物各1 μl、重組噬菌體DNA 2 μl,加入無酶水至總體積50 μl。擴增條件:98 ℃2 min;98 ℃ 10 s,56 ℃ 10 s,72 ℃ 20 s,30個循環;72℃5 min。將PCR產物進行10 g/L瓊脂糖凝膠電泳。
2.酶切驗證:將重組噬菌體陽性克隆DNA進行ECORI單酶切,反應體系 50 μl,包括 DNA 4 μl、ECORI酶1 μl、10 × NE 緩沖液5 μl、無酶水 40 μl。60℃水浴1 h,瓊脂糖凝膠電泳,凝膠影像分析儀觀察電泳條帶。酶切驗證正確的重組噬菌體DNA由蘇州金唯智(北京)生物科技有限公司測序。
五、重組噬菌體活性檢測
用LB培養基稀釋重組噬菌體至效價108~1011噬斑形成單位(PFU)/ml,將10 μl噬菌體液加入90 μl含對數生長中期大腸桿菌ER2738的菌懸液,室溫孵育5 min,加入3 ml 45℃頂層瓊脂糖凝膠,混勻,立即傾倒至預熱的LB平板上,37℃倒置培養過夜。計數噬菌斑,噬菌體效價(PFU/ml)=噬菌斑數×稀釋倍數×10。
六、細胞增殖活性檢測
向96孔板中加入Hela細胞懸液,每孔100 μl(4× 105/ml),37℃、5%CO2培養箱中預培養24 h,加入10 μl效價為1011PFU/ml的M13噬菌體或M13-IN5重組噬菌體,同時以未感染衣原體的Hela細胞作為空白對照組,每組設置3個復孔,將培養板在37℃、5%CO2培養箱中孵育24 h。向每孔加入10 μl CCK8溶液,孵育4 h,Bio-Rad酶標儀檢測450 nm波長處各孔吸光度(A值)。每個實驗重復3次。
七、重組噬菌體目的蛋白表達的檢測
取重組噬菌體液、M13噬菌體液、對數期ER2738菌液各100 μl,噬菌體效價均為1011PFU/ml,加入1 μl苯甲基磺酰氟(PMSF)和100 μl RIPA裂解液,振蕩10 s,冰上孵育5 min,重復3次,15 450 ×g4℃離心10 min,取上清液。加5×十二烷基硫酸鈉(SDS)蛋白樣品上樣緩沖液95℃孵育10 min變性蛋白。免疫印跡鑒定目的蛋白,操作如下:15%SDS-聚丙烯酰胺凝膠電泳(PAGE)分離蛋白,濕轉(300 mA、1 h)至聚偏二氟乙烯(PVDF)膜上,1×TBST緩沖液洗滌3次,3%牛血清白蛋白室溫封閉2 h,加入一抗(小鼠源性VP1多克隆抗體,1∶1 000稀釋),4℃封閉過夜,TBST洗滌3次,每次10 min,加入二抗(堿性磷酸酶綴合的Affinipure山羊抗小鼠IgG,1∶1 000稀釋),室溫封閉2 h,TBST洗滌3次,每次10 min,顯影目的蛋白。
八、共聚焦顯微鏡定位噬菌體
將500 μl Hela細胞(4× 105/ml)接種至24孔板,在37℃、5%CO2孵箱中培養至70%密集度時,分為3組,即衣原體對照組、M13噬菌體組、M13-IN5噬菌體組,各組每孔均按照MOI[衣原體原體(EB)數/Hela細胞數]為1加入E型Ct標準株,同時M13噬菌體組、M13-IN5噬菌體組加入200 μl效價為1011PFU/ml的M13噬菌體和M13-IN5重組噬菌體,32℃ 206×g離心1 h,37℃、5%CO2孵箱培養,衣原體對照組不加噬菌體,直接培養,每組設3個復孔。在衣原體感染后36 h,棄培養液,PBS沖洗3次,每次5 min,待完全干燥;加冰甲醇固定15 min,按上述方法用PBS沖洗;加入0.1%TritonX-100作用10 min,PBS沖洗;加入細胞培養液500 μl/孔,室溫封閉1 h,PBS沖洗;同時加入鼠抗EB單克隆抗體(1∶2 000稀釋)及兔抗FD段噬菌體抗體(1∶2 000稀釋)200 μl/孔,4 ℃孵育過夜,PBS沖洗;加入FITC標記的山羊抗兔IgG二抗及Alexa Fluor594標記的山羊抗鼠IgG二抗(1∶80稀釋)50 μl/孔,37℃避光孵育1 h,PBS沖洗;滴加DAPI避光孵育5 min,對標本進行染核,PBS洗4次,每次5 min,用防淬滅封片劑將玻片固定在載玻片上,共聚焦顯微鏡觀察重組噬菌體的位置。
九、重組噬菌體對CtE株生長的影響
Hela細胞干預方法同“八、共聚焦顯微鏡定位噬菌體”,在衣原體感染后36、48、60、72 h,無水冰甲醇固定15 min,風干,加入盧戈氏碘液,作用1 min,400×光鏡下觀察包涵體,每孔計數40個視野下的包涵體數目,計算平均值。實驗重復3次。
十、干預實驗各時段噬菌體效價測定
Hela細胞分組及處理方法同“八、共聚焦顯微鏡定位噬菌體”,在干預后12、24、36、48、60、72 h收集細胞和培養基,加入數顆無菌小玻璃珠,然后劇烈振蕩1 min,825×g離心5 min。取上清液做噬菌體滴度測定,用LB培養基倍比稀釋含噬菌體的上清液至效價為105~108PFU/ml,雙層平板法測定噬菌體滴度,具體同“五、重組噬菌體活性檢測”。計數噬菌斑,計算PFU。
十一、數據分析
應用SPSS17.0軟件進行數據處理,結果用±s表示。兩樣本均數間比較采用t檢驗,多組樣本均數比較采用方差分析,兩兩組間比較采用Bonferroni檢驗,以P<0.05為差異有統計學意義。
結 果
一、重組噬菌體目的基因鑒定與測序
將重組噬菌體陽性克隆進行PCR擴增,成功擴增出IN5基因,擴增產物分子長度250 bp,與目的條帶分子長度一致(圖2)。ECORI單酶切酶將重組噬菌體陽性克隆DNA分成3個片段,分子長度分別為4 827、2 622、13 bp(拷貝數太少,電泳結束時已脫膠,所以曝光分析時未見該條帶)(圖3)。基因測序顯示,重組噬菌體含有目的IN5環序列。

圖2 PCR擴增鑒定重組噬菌體 1:DNA標準參照物;2:陽性對照(本實驗室前期成功構建的VP1質粒IN5環基因PCR片段);3:M13-IN5重組噬菌體

圖3 重組噬菌體酶切鑒定 1:DNA標準參照物;2:M13噬菌體(7 225 bp);3:M13-IN5重組噬菌體(7 462 bp);4:M13-IN5重組噬菌體單酶切后形成的DNA片段,長度分別為4 827、2 622 bp
二、重組噬菌體活性
LB平板培養顯示,M13-IN5重組噬菌體效價為3.05×1011PFU/ml,提示重組噬菌體具有生物活力。
三、噬菌體對細胞的毒性作用
處理24 h后,CCK8試劑盒檢測顯示,空白對照組、M13噬菌體組、M13-IN5重組噬菌體組A450值分別為3.63±0.01、3.55±0.02、3.70±0.01,差異無統計學意義(F=12.0,P>0.05)。
四、重組噬菌體目的蛋白的表達
M13-IN5重組噬菌體在相對分子質量約55000處有一較濃的蛋白條帶(圖4),其大小正好與IN5環和M13噬菌體pIII外殼蛋白的融合蛋白(相對分子質量582 000)大小相當,M13噬菌體和大腸桿菌ER2738在相應位置無條帶。

圖4 重組蛋白免疫印跡鑒定 M:蛋白分子量標記物;1:IN5環/pIII融合蛋白;2:M13噬菌體;3:大腸桿菌ER2738
五、共聚焦顯微鏡定位噬菌體
噬菌體和衣原體同時干預Hela細胞36 h后,在共聚焦顯微鏡下觀察噬菌體的定位情況,結果見圖5。衣原體對照組中衣原體綠色熒光分布在Hela細胞核附近,M13噬菌體組和M13-IN5噬菌體組中衣原體和噬菌體熒光均分布在Hela細胞核附近,并且部分衣原體熒光和噬菌體熒光有重合。

圖5 共聚焦顯微鏡定位噬菌體(63×油鏡) 紅色代表噬菌體,綠色代表沙眼衣原體,藍色代表Hela細胞核。衣原體對照組中沙眼衣原體分布在Hela細胞核周圍,兩噬菌體組中沙眼衣原體和噬菌體均分布在Hela細胞核周圍,并且部分噬菌體和衣原體熒光相互重疊。圖中標尺=20 μm
六、重組噬菌體對衣原體生長的作用
見圖6、表1。衣原體感染后36、72 h,M13噬菌體組、M13-IN5噬菌體組包涵體數目較衣原體對照組降低(均P<0.05),且M13-IN5噬菌體組包涵體數目較M13噬菌體組降低明顯(均P<0.05);而衣原體感染后48、60 h,M13噬菌體組、M13-IN5噬菌體組與衣原體對照組包涵體數目差異無統計學意義(P>0.05)。

圖6 噬菌體干預沙眼衣原體實驗(碘染色,×400) 黑色箭頭示沙眼衣原體包涵體
表1 噬菌體干預實驗中各時段Hela細胞中包涵體數(±s)

表1 噬菌體干預實驗中各時段Hela細胞中包涵體數(±s)
注:n=3。a與對照組比較,P<0.05;b與M13噬菌體組比較,P<0.05或0.01
組別對照組M13噬菌體組M13-IN5重組噬菌體組F值P值36 h 49.00±4.36 29.67±2.08a 18.00±1.73a b 58.32<0.05 48 h 613.33±2.52 594.67±5.51 590.00±5.29 119.30>0.05 60 h 326.00±3.61 312.00±4.58 316.00±3.61 5.20>0.05 72 h 232.67±3.21 180.00±2.52a 118.00±6.56a b 433.90<0.05
七、干預實驗各時段噬菌體效價
隨著干預時間的增加,噬菌體滴度有所降低,結果見圖7。

圖7 干預實驗各時段噬菌體效價測定
討 論
1985年,Smith首次將外源基因插入絲狀噬菌體基因Ⅲ,使目的基因編碼的多肽以融合蛋白的形式展示在噬菌體表面,從而創建了噬菌體展示技術[8],現已廣泛應用于抗原抗體庫的建立、藥物設計、疫苗研究、病原檢測、基因治療、抗原表位研究及細胞信號轉導研究等[9]。M13噬菌體是一種溫和噬菌體,是較常見的噬菌體展示系統,包含PⅢ、PⅧ及其他展示系統等,并且容易擴增[10]。
目前在鸚鵡熱衣原體、家畜衣原體與肺炎衣原體中已經成功發現其對應噬菌體的存在,但是Ct的對應噬菌體卻仍未發現。近來,Ct抗生素耐藥與持續感染報道屢見不鮮,由于治療效果欠佳、缺少有效疫苗,對Ct有治療作用的噬菌體成為研究的重點。目前已知Vp1蛋白是衣原體噬菌體中最大的衣殼蛋白,前期關于衣原體噬菌體phiCPAR39和phiCPG1對衣原體的研究顯示,衣原體噬菌體能引起網狀體停止分裂,但是不停止復制,不能產生新的原體,電鏡下可以觀察到形態異常且體積明顯增大的形式,稱為變異體,從而導致衣原體進入持續感染[11-12]。我們前期實驗發現,衣原體噬菌體phiCPG1的衣殼蛋白Vp1對Ct有較強抑制作用,可能在噬菌體的黏附、侵襲、毒力等生物學特性方面具有重要作用,其中IN5環部分可能是潛在的特異結合區[13]。
我們利用基因重組技術,成功構建M13-IN5重組噬菌體,酶切、PCR、測序、Western印跡顯示,IN5片段成功連接至M13噬菌體,且IN5-pIII融合蛋白在噬菌體裝配過程中展示在噬菌體表面,重組噬菌體效價達1011PFU/ml,提示構建的M13-IN5重組噬菌體具有生物活性。通過共聚焦顯微鏡觀察噬菌體在Hela細胞中的位置,發現衣原體的熒光和噬菌體熒光存在很大程度的重疊,提示噬菌體不僅進入細胞,而且進入衣原體包涵體內。且衣原體干預實驗各時段噬菌體效價均大于2×108PFU/ml,提示噬菌體的活性可以維持一定時間。
我們在噬菌體干預實驗中發現,衣原體感染36、72 h時,M13-IN5噬菌體組和M13噬菌體組的包涵體數目較衣原體對照組降低,而且M13-IN5噬菌體組包涵體數目較M13噬菌體組有明顯降低,而感染48、60 h時M13-IN5噬菌體組、M13噬菌體組、衣原體對照組包涵體數目無明顯區別。衣原體感染36 h時處于網狀體時期,為衣原體增殖時期,此時噬菌體對衣原體的抑制作用明顯;感染48~60 h時衣原體處于原體時期,不增殖,噬菌體對衣原體無明顯抑制作用;而72 h衣原體又重新處于增殖期[14],因此,我們認為噬菌體對增殖期的衣原體抑制作用更明顯。衣原體增殖階段,重組噬菌體較M13噬菌體的抑制作用更明顯,可能的機制為重組噬菌體進入包涵體內,其衣殼蛋白中表達的IN5蛋白促進重組噬菌體與Ct識別[15],加速噬菌體對衣原體的侵襲過程,噬菌體引起網狀體停止分裂,不能產生新的原體,從而導致衣原體感染率降低,然而是否形成與其他衣原體噬菌體類似的變異體以及具體機制還需要更加深入的探索。
Ct感染一直是全球性的醫療難題,我們構建的重組噬菌體對Ct有明顯的抑制作用,為臨床治療Ct慢性感染、持續感染及應對治療抵抗提供了新的思路,但是重組噬菌體的作用機制還未明確,需要進一步研究。

