川黃連不同炮制品改善四氧嘧啶小鼠糖及脂代謝紊亂比較研究*
時曉媞,吳曉青,任瑤瑤,蔣合眾,魏 屹,譚 睿
(西南交通大學生命科學與工程學院 成都 610031)
黃連為毛茛科植物黃連Coptis chinensisFranch、三角葉黃連Coptis deltoideaC. Y. Cheng et Hsiao.或云連Coptis teeta Wall.的干燥根莖[1]。《神農本草經》列為上品,是歷代著名醫家常用清熱燥濕藥。主產于四川、重慶、貴州、西藏、湖南、云南、陜西等省區,川黃連一直以來被認為是黃連的道地產區,因基源不同,藥材分為“味連”、“雅連”和“鳳尾連”。
川黃連用于“消渴”,自古在多部醫書中就有記載。唐代名醫孫思邈所著的《千金要方》中就記載用黃連配伍生地治療消渴癥。川黃連炮制入藥,最早記載可見于南北朝的《雷公炮炙論》,各種炮制品多為適應其臨床需要或者緩和黃連的苦寒之性。由于雅連瀕危,人工栽培要求極高,價格昂貴,藥效研究較少,關于黃連降糖、降脂的藥效研究實際多以味連和云連的生品和炮制品為主[2-5],鮮有雅連及其炮制品療“消渴”的藥效研究[6,7],更缺乏味連、雅連及其不同炮制品降糖、降脂藥效的比較研究。本研究選擇3 種收載于《中華人民共和國藥典》(2015 版)的黃連炮制品,研究其降糖、降脂的藥效,重點考察雅連、味連及其炮制品之間糖、脂代謝的藥效差異,旨在為川黃連的臨床合理用藥和資源的可持續開發和利用提供科學依據。
1 材料
1.1 實驗藥物及試劑
雅連、味連均購置于四川省洪雅縣瓦屋山藥業,經西南交通大學宋良科教授鑒定為黃連(Coptis ChinesisFranch)、三角葉黃連(Coptis deltoideaC.Y.Cheng et Hisao)的干燥根莖。酒雅連、酒味連、姜雅連、姜味連、萸雅連、萸味連均為實驗室自制。鹽酸二甲雙胍片,0.5 克/片,國藥準字H20023370,生產企業:中美上海施貴寶制藥有限公司。
四氧嘧啶(Alloxan)購自Sigma 公司。生理鹽水購自四川科倫藥業有限公司。實驗所用小鼠TC 測試試劑盒、TG 測試試劑盒、MDA 測試試劑盒、小鼠胰島素酶聯測試試劑盒均購置南京建成。
羅氏活力型血糖儀(ACCU-CHEK Active,德國羅氏診斷有限公司);全功能酶標儀(MK3 型,美國Thermo Fisher 儀器有限公司);高速低溫離心機(TGL-16G-A,上海安亭科學儀器廠);全自動生化分析儀(Chemray 240,深圳雷杜生命科技);數碼三目攝像顯微鏡(BA400Digital,麥克奧迪實業集團有限公司)
1.2 實驗動物
KM 小鼠,SPF 級,20±2 g,雌性各半,動物許可證號:SCXK[川]2013-15,購于四川省醫學科學院動物研究所。
飼養環境為:西南交通大學生命學院的動物實驗專用實驗室,室內安靜、清潔、采光通風良好。實驗期間,自由飲食進水。
2 方法
2.1 動物分組及給藥方案
2.1.1 動物分組
昆明(KM)小鼠200 只,SPF 級,雌雄各半,要求體重18-22 g。實驗室適應性喂養1 周。按體重隨機分為2組,1組取10只小鼠作為空白組,其余小鼠用于四氧嘧啶造模,造模前1 天對各組小鼠禁食不禁水18 h后,稱體重,按體重尾靜脈注射四氧嘧啶溶液(注射劑量40 mg/10 g),空白組小鼠(10 只)按體重尾靜脈注射相同體積的生理鹽水。造模小鼠在造模后24 h和48 h灌胃50%葡萄糖,造模72 h 后,對各組小鼠禁食不進水12 h,小鼠尾尖取血,使用血糖儀測定小鼠空腹血糖(FBG)。以空腹血糖≥11.0 mmol·L-1視為造模成功,挑選出所有造模成功小鼠,待用。
將所有造模成功小鼠按體重隨機分為11組,即模型對照組、二甲雙胍對照組、味連組、雅連組、葛黃組、酒雅連組、酒味連組、姜雅連組、姜味連組、萸雅連組、萸味連組。
2.1.2 給藥方案
依據《藥理實驗方法學》(魏偉主編)中“標準體重動物劑量這算表”確定小鼠給藥的劑量。二甲雙胍雙胍組給藥劑量計算得0.7 g·kg-1。各黃連組給藥劑量為生藥材9 g·kg-1。
稱取二甲雙胍粉末適量,用0.5%CMC-Na 溶液溶解,放置過夜,配制成70 mg·mL-1的二甲雙胍混懸液。稱取各黃連適量,每次加10 倍,煎煮3 次,每次1 h,合并濃縮至生藥材0.9 g·kg-1的水煎液。
二甲雙胍組和各黃連給藥組按0.1 mL/10 g 灌胃給藥,每天1 次,連續給藥6 周。模型組和空白組每天灌胃相同劑量的純凈水。實驗期間自由進食飲水。
2.2 川黃連不同炮制品對小鼠體重的影響
分別在第7 d,第14 d,第21 d,第28 d,第35 d,第42 d稱量小鼠體重,觀察各治療組與空白組,模型組相比,小鼠體重的變化,制作體重變化曲線。
2.3 川黃連不同炮制品對小鼠空腹血糖(FBG)的影響
第7 d,第14 d,第21 d,第28 d,第35 d,第42 d 將各組動物禁食不禁水8 h,小鼠尾尖取血后用血糖儀測定小鼠空腹血糖(FBG)。
2.4 川黃連不同炮制品糖耐量試驗
糖耐量實驗(OGTT):連續給藥第40 d,將各組動物禁食不禁水8 h,50%葡萄糖灌胃小鼠,0.2 g/100g BW。于灌胃葡萄糖前(0 min),及灌葡萄糖后30,60,120 min,分別測定各時間點血糖,繪制OGTT曲線。
2.5 川黃連不同炮制品對小鼠血液生化相關指標的影響
連續給藥第6 周后,將各組動物禁食不禁水8 h,給藥1 h 后,對小鼠進行眼眶取血,靜置20 min 后離心(3000 r·min-1)10 min,分離血清備測。取上述血清,參照試劑盒測定說明書分別測定小鼠甘油三酯(TG)、血清膽固醇(TC)、MDA、HDL-C、LDL-C、GSP的含量。
2.6 血清胰島素測定
采用酶聯免疫法,按照試劑盒說明對小鼠血清胰島素進行檢測。
2.7 川黃連不同炮制品對小鼠胰腺組織病理的影響
小鼠取血處死后,立即摘取胰腺組織,用生理鹽水沖洗干凈,固定于4%多聚甲醛溶液,過夜后使用乙醇逐級脫水,做透明處理,包埋機石蠟包埋;使用輪轉式切片機切片;HE染色;加拿大樹膠封片供鏡檢。
2.8 統計學分析
采用SPSS19.0進行統計分析。采用ANOVA 法進行單因素方差分析,以單因素方差分析行組間比較,方差齊采用LSD 檢驗,方差不齊則采用Tamhane’s T2檢驗;當P<0.05時,則認為其組間差異有顯著性。
3 結果
3.1 對四氧嘧啶致糖尿病小鼠體重的影響
在實驗過程中,各治療組及模型組、空白組、二甲雙胍組小鼠的體重變化如表1所示。2周內,與空白組相比,模型組、二甲雙胍組、各黃連給藥組在兩周內體重有較大程度的下降。四周內,空白小鼠體重增加,模型組體重出現較大程度的增加,各黃連給藥組體重變化不大。六周內,空白組小鼠體重顯著增加,模型組小鼠小鼠體重增加,各黃連給藥組小鼠體重較小范圍的波動,變化不顯著。
3.2 對四氧嘧啶致糖尿病小鼠空腹血糖(FBG)的影響
在實驗過程中,各治療組及模型組、空白組、二甲雙胍組小鼠的FBG 變化如表2,圖2 所示。給藥前,與空白組小鼠相比,模型組、二甲雙胍組與各黃連給藥組,均有顯著的升高(P<0.01)。給藥2 周后,與模型組相比,二甲雙胍組、味連組、雅連組和萸雅連組顯著降低(P<0.05)。
表1 對糖尿病小鼠體重的影響(± S)

表1 對糖尿病小鼠體重的影響(± S)
注:與空白比較*P <0.05,**P <0.01
組別空白對照組模型對照組二甲雙胍組味連組雅連組葛黃組酒雅連酒味連姜雅連姜味連萸雅連萸味連動物數/只10 10 10 10 10 10 10 10 10 10 10 10劑量/(g·kg-1)體重/g 6周43.37±6.33 37.81±3.83 33.90±5.02 31.23±3.85**30.59±3.64**31.94±6.23**33.02±5.83*30.36±6.23**30.72±5.99**29.86±5.44**32.77±5.35*29.42±7.36**——0.5 90 90 90 90 90 90 90 90 90給藥前35.22±4.70 33.17±1.85 34.71±6.81 34.69±4.90 33.45±2.36 34.74±6.09 34.14±5.79 31.89±5.65 31.92±5.04 32.63±4.29 32.63±4.50 33.77±3.49 2周37.48±5.34 29.77±4.72 33.09±6.38 31.41±4.98*30.71±5.52*32.88±6.71 30.96±5.23*31.31±5.47*28.74±5.52**27.86±4.43**31.26±5.32*30.20±3.94**4周37.64±4.74 37.04±4.54 31.57±4.21 30.13±4.78*29.95±3.79*30.03±6.21*31.95±6.44 28.60±4.50**32.11±4.50 28.81±5.18**32.00±3.59 31.01±4.30*

表2 對糖尿病小鼠FBG的影響(χ± S)
給藥4周后,與模型組相比,二甲雙胍組與各黃連給藥組血糖均降低,其中,雅連組、味連組顯著降低(P<0.05);與給藥2 周FBG 相比,二甲雙胍組和各黃連給藥組均在較小范圍內波動;其中,二甲雙胍組、味連組、雅連組、酒味連組、姜雅連組、萸雅連組小鼠FBG 稍有升高,酒雅連組、姜味連組、萸味連組小鼠FBG稍有下降。
給藥6 周后,與模型組相比,二甲雙胍組、各黃連給藥組均有顯著性差異(P<0.01,P<0.05),與給藥4周小鼠FBG 相比,二甲雙胍組和各黃連給藥組均有不同程度的下降。與給藥前小鼠FBG 相比,二甲雙胍組和各黃連給藥組均由不同程度的下降,說明各黃連生品、炮制品、對糖尿病小鼠FBG 均由不同程度的降低的作用。與二甲雙胍組相比,味連組、雅連組、姜雅連、姜味連、萸雅連組降糖效果較好,酒味連組、酒雅連組、萸味連組降糖效果較差,其中,以萸雅連組降糖效果最為顯著。
3.3 對四氧嘧啶致糖尿病小鼠血脂水平的影響
各治療組及模型組、空白組、二甲雙胍組小鼠的血清膽固醇(TG)、甘油三酯(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)含量結果如表3所示。對空白組相比,模型組小鼠血清TG、TC、LDL-C含量顯著升高(P<0.01),HDL-C顯著降低(P<0.01),說明糖尿病小鼠存在糖脂代謝紊亂。與模型組比較,各黃連給藥組及二甲雙胍組小鼠血清TC 均有降低,雅連組、葛黃組、酒味連組、萸味連組、酒雅連組、姜味連組、萸雅連組降低顯著(P<0.01,P<0.05)。各黃連給藥組中,以酒味連組小鼠血清TC含量最低。
與模型組相比,各黃連給藥組及二甲雙胍組小鼠血清TG均顯著降低(P<0.05);各黃連給藥組相比,雅連組小鼠血清TG 含量最低。雅連組和萸味連組HDL-C含量明顯升高(P<0.05)。各黃連給藥組相比,雅連組小鼠血清HDL-C 含量最高。姜雅連組、葛黃組、萸雅連組LDL-C含量顯著降低(P<0.01,P<0.05)。
3.4 對四氧嘧啶致糖尿病小鼠MDA、GSP、Ins的影響
各組小鼠血清丙二醛(MDA)、糖化血清蛋白(GSP)、血清胰島素(Ins)含量如表4所示。
與空白組比較,模型組MDA 的含量有顯著提高,表明糖尿病小鼠模型的氧化應激反應較強,抗氧化能力明顯降低,這也是各種糖尿病并發癥的誘因。與模型組比較,各黃連給藥組及二甲雙胍組小鼠血清MDA的含量均有顯著降低(P<0.01,P<0.05),以雅連組小鼠血清MDA含量最低,抗氧化能力增強最顯著。

圖1 小鼠FBG的變化情況
與空白組相比,模型組小鼠GSP 顯著升高,說明糖尿病小鼠模型糖代謝紊亂顯著。與模型組相比,各黃連給藥組與二甲雙胍組小鼠GSP 均有降低,味連組、雅連組、葛黃組、姜味連組、萸雅連組降低較顯著(P<0.05)。各黃連給藥組相比,小鼠GSP含量差異較小,以味連組小鼠血清糖化蛋白含量最小,表明對小鼠糖代謝調節效果較好。
與空白組相比,模型組血清Ins 含量顯著降低,胰島細胞損傷導致糖尿病小鼠胰島素分泌減少。與模型組相比,各黃連給藥組及二甲雙胍組血清Ins 含量均有升高,味連組、萸味連組升高較明顯。各黃連給藥組相比,各組小鼠血清Ins 含量差異較小,以味連組含量最高,說明在一定程度上對胰島細胞有修復作用
3.5 對四氧嘧啶致糖尿病小鼠葡萄糖糖耐量(OGTT)的影響
各組小鼠灌胃葡萄糖后,30、60、120 min 血糖變化如表5 所示。灌胃30 min 后,各組小鼠血糖均明顯升高,60 min 后血糖均有降低,120 min 后血糖繼續下降但仍高于0 min 血糖。與空白組相比,模型組血糖持續較高且下降不明顯。各黃連給藥組及二甲雙胍組血糖在升高之后均在60 min 之后出現明顯下降,且與模型組相比下降顯著(P<0.01,P<0.05)。各黃連給藥組相比,血糖變化趨勢及下降程度無明顯差異,說明各組小鼠糖耐量無明顯差異,且優于模型組。說明黃連能改善胰島抗性,增加胰島素敏感性。
3.6 對四氧嘧啶致糖尿病小鼠胰腺組織病理的影響
表3 對糖尿病小鼠TC、TG、HDL-C和LDL-C的影響(± S)
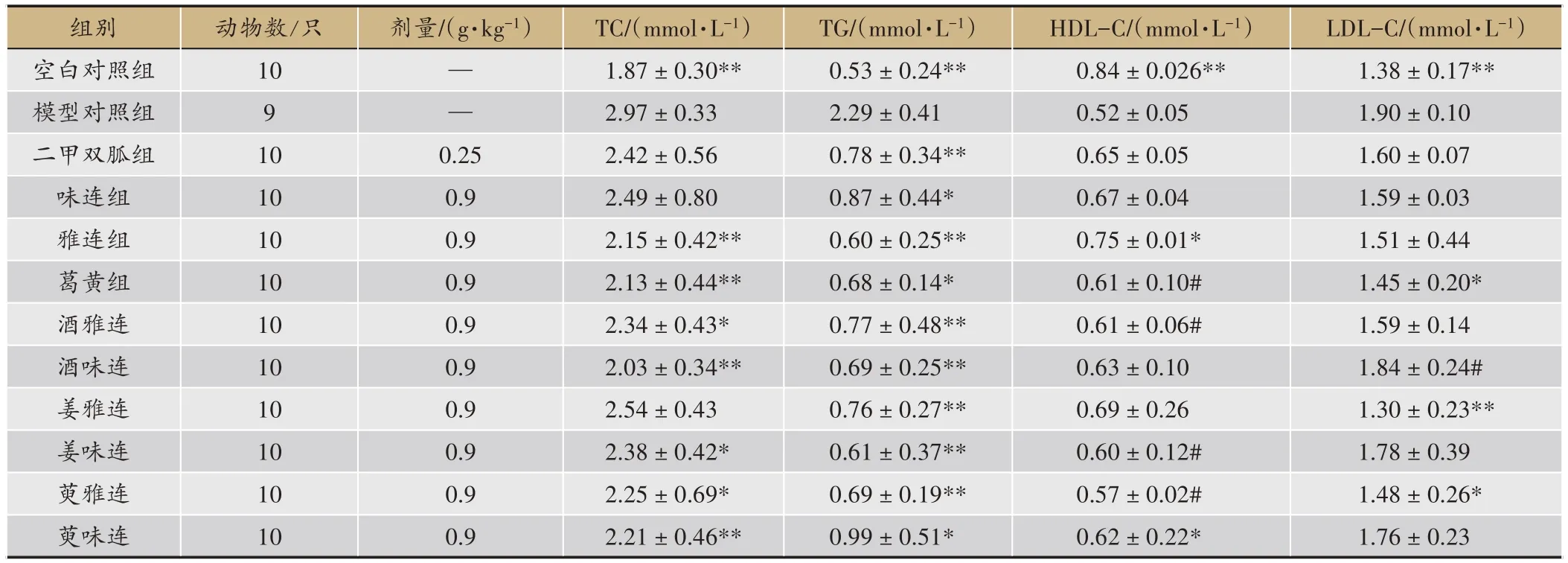
表3 對糖尿病小鼠TC、TG、HDL-C和LDL-C的影響(± S)
注:與模型組比較*P <0.05,**P <0.01;與空白組比較#P <0.05,##P <0.01
LDL-C/(mmol·L-1)1.38±0.17**1.90±0.10 1.60±0.07 1.59±0.03 1.51±0.44 1.45±0.20*1.59±0.14 1.84±0.24#1.30±0.23**1.78±0.39 1.48±0.26*1.76±0.23組別空白對照組模型對照組二甲雙胍組味連組雅連組葛黃組酒雅連酒味連姜雅連姜味連萸雅連萸味連動物數/只10 9 10 10 10 10 10 10 10 10 10 10劑量/(g·kg-1)——0.25 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 TC/(mmol·L-1)1.87±0.30**2.97±0.33 2.42±0.56 2.49±0.80 2.15±0.42**2.13±0.44**2.34±0.43*2.03±0.34**2.54±0.43 2.38±0.42*2.25±0.69*2.21±0.46**TG/(mmol·L-1)0.53±0.24**2.29±0.41 0.78±0.34**0.87±0.44*0.60±0.25**0.68±0.14*0.77±0.48**0.69±0.25**0.76±0.27**0.61±0.37**0.69±0.19**0.99±0.51*HDL-C/(mmol·L-1)0.84±0.026**0.52±0.05 0.65±0.05 0.67±0.04 0.75±0.01*0.61±0.10#0.61±0.06#0.63±0.10 0.69±0.26 0.60±0.12#0.57±0.02#0.62±0.22*
表4 對丙二醛(MDA)的影響(± S)
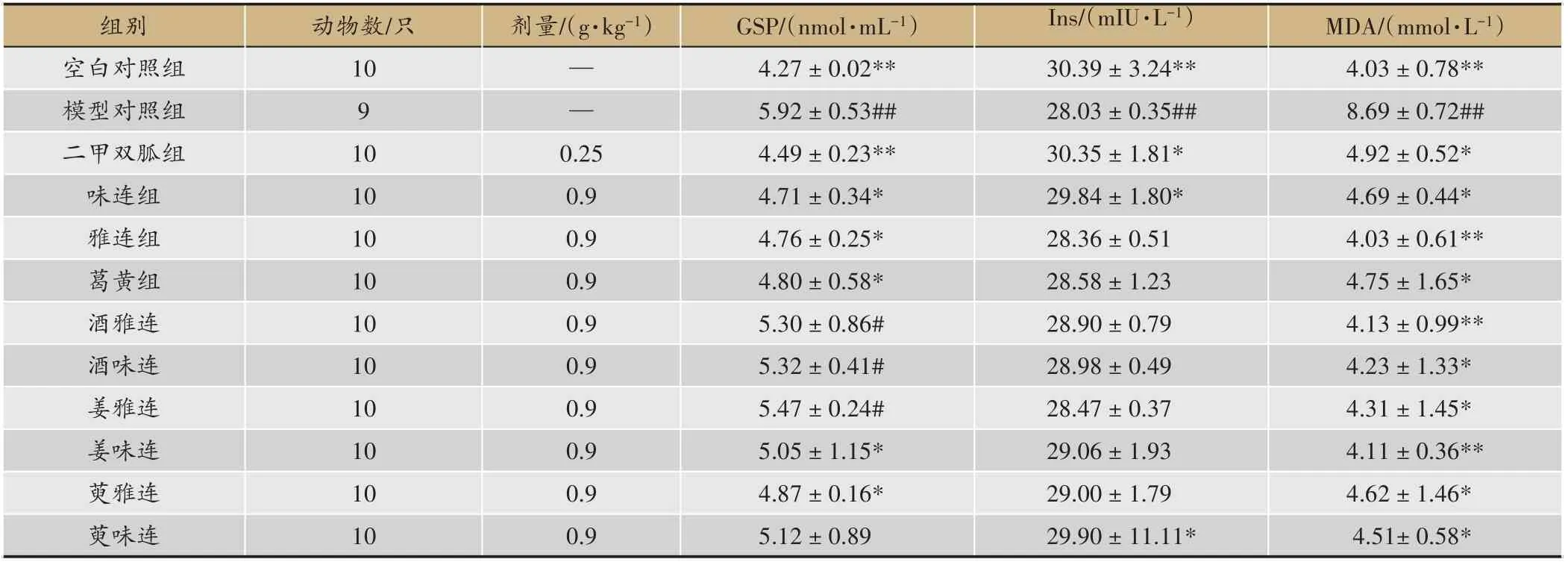
表4 對丙二醛(MDA)的影響(± S)
注:與模型組比較*P <0.05,**P <0.01;與空白組比較#P <0.05,##P <0.01
組別空白對照組模型對照組二甲雙胍組味連組雅連組葛黃組酒雅連酒味連姜雅連姜味連萸雅連萸味連動物數/只10 9 10 10 10 10 10 10 10 10 10 10劑量/(g·kg-1)Ins/(mIU·L-1)30.39±3.24**28.03±0.35##30.35±1.81*29.84±1.80*28.36±0.51 28.58±1.23 28.90±0.79 28.98±0.49 28.47±0.37 29.06±1.93 29.00±1.79 29.90±11.11*——MDA/(mmol·L-1)4.03±0.78**8.69±0.72##4.92±0.52*4.69±0.44*4.03±0.61**4.75±1.65*4.13±0.99**4.23±1.33*4.31±1.45*4.11±0.36**4.62±1.46*4.51±0.58*0.25 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 GSP/(nmol·mL-1)4.27±0.02**5.92±0.53##4.49±0.23**4.71±0.34*4.76±0.25*4.80±0.58*5.30±0.86#5.32±0.41#5.47±0.24#5.05±1.15*4.87±0.16*5.12±0.89
表5 對糖尿病小鼠OGTT的影響(± S)

表5 對糖尿病小鼠OGTT的影響(± S)
注:與模型組比較*P <0.05,**P <0.01;與空白組比較#P <0.05,##P <0.01
組別空白對照組模型對照組二甲雙胍組味連組雅連組葛黃組酒雅連酒味連姜雅連姜味連萸雅連萸味連動物數/只10 10 10 10 10 10 10 10 10 10 10 10劑量/(g·kg-1)血糖/(mmol·L-1)120 min 7.80±1.13 30.17±4.75##20.13±7.61*17.20±9.94**18.71±9.64**16.66±11.53**21.73±10.47*19.16±11.83**21.54±8.54*20.42±8.95*17.40±11.39**22.92±12.13*——0.5 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0 min 7.96±1.29 31.67±4.09##18.31±8.92 16.90±8.65 16.46±9.09 15.50±10.16 20.30±8.80 18.26±10.97 17.28±10.47 15.03±8.19 14.75±10.58 20.38±10.08 30 min 14.40±2.17 34.80±0.97##33.30±6.82 34.14±2.71 32.89±3.61 32.73±5.62 34.72±4.25 34.16±5.97 32.87±4.62 32.00±7.29 31.51±5.11 34.36±5.79 60 min 10.50±0.92 33.95±4.88##28.64±9.10 27.73±3.85*29.84±8.63 27.30±9.91*28.87±7.54 25.49±8.57**27.48±9.61*29.37±9.26 27.41±10.46*27.24±12.32*

圖2 小鼠胰腺組織病理圖(HE,× 100)
小鼠胰腺組織病理圖如圖2 所示,空白對照組小鼠鼠胰腺組織結構完好,細胞數量多,細胞質飽滿,細胞結構完整,邊緣清晰,排列精密。未出現明顯的脂肪變性,無增厚增生,未見出血、炎性細胞浸潤及壞死等病理改變。胰島(如圖2箭頭所示)廣泛分布于胰泡之間,無萎縮、壞死、變性等病理現象。與空白組相比較,模型對照組大鼠胰腺組織出現嚴重的細胞壞死、萎縮、變性,胰泡內出現明顯的炎性細胞浸潤,胰島形狀不規則,邊緣模糊,細胞排列松散。與模型組相比,各治療組均出現形態正常,形狀規則,細胞排列較緊密,細胞數量多且細胞質飽滿的胰島組織,但也有炎性細胞浸潤的胰島組織。由此可說明,各黃連給藥組的小鼠胰島組織被部分修復,說明黃連可能具有修復胰島組織的功能。
3 討論
黃連“止消渴”在歷代本草中均有記載,現代的相關基礎研究及臨床應用確立了黃連在降血糖方面的重要地位[8-11]目前,黃連的炮制品較多,不同的黃連炮制品的功效也有不同,為中醫臨床處方用藥所困惑,清《修事指南》就指出“炮制不明,藥性不確,則湯方無準而病癥不驗也”。鑒于2 型糖尿病(T2DM)患者均伴有機體脂代謝紊亂,故本文在研究降糖作用的同時,對比了雅連、味連及其炮制品在降糖和調節糖脂代謝紊亂方面的藥效差異。在評價降糖作用時,增加了對糖化血清蛋白的檢測。實驗結果表明,萸雅連降糖效果最為明顯,調節糖脂代謝紊亂和抗氧化,雅連效果最佳。
本研究采用四氧嘧啶制作小鼠糖尿病模型。四氧嘧啶可破壞小鼠胰島β細胞,引起實驗性高血糖。此方法造模穩定,操作簡單,但四氧嘧啶用量各報道均有差異。預實驗采用60 mg·kg-1、90 mg·kg-1、120 mg·kg-1腹 腔 注 射 四 氧 嘧 啶,發 現60 mg·kg-1、90 mg·kg-1劑量組的小鼠成模率低,而120 mg·kg-1腹腔注射四氧嘧啶,發現成模率高但死亡率也高,因此推斷腹腔注射可能不適用于四氧嘧啶糖尿病小鼠造模,最終采用40 mg·kg-1四氧嘧啶尾靜脈注射,成模率高且死亡率較低。四氧嘧啶造模的小鼠在造模后24-48 h由于胰島β細胞被嚴重破壞,大量胰島素被釋放,可能出現短時低血糖而致驚厥死亡,因此在造模后灌胃葡萄糖以降低小鼠的死亡率。成模之后,各造模小鼠均出現明顯的“三多一少”的糖尿病典型癥狀,且小鼠精神萎靡,活動減少,皮毛暗黃無光澤。在給藥第1-2 周模型組與各治療小鼠體重出現明顯的下降,而之后幾周內,各給藥組小鼠體重稍有增長但波動較小,以陽性組小鼠體重增加最多,而模型組小鼠體重在多飲多食的狀態下體重回升顯著,但仍低于空白組小鼠體重。造成非正常狀況的原因可能主要有以下幾個方面:第一,黃連苦寒,對胃腸道有一定毒性,可能會導致腹瀉等癥狀,因此抑制小鼠體重增加。第二,每日灌胃給藥,可能影響了治療組小鼠正常進食。第三,每日灌胃對小鼠食道咽喉口腔等部位均有損傷,這些損傷影響小鼠的正常進食,導致了小鼠體重增加緩慢。由此可看出,由于黃連大苦大寒之性,可能不利于小鼠體重的恢復。
由空腹血糖的變化情況可以看出,各組黃連均有一定的降糖效果的,其中萸味連組、酒味連組、酒雅連組降糖藥效低于二甲雙胍組,其余各黃連組降糖藥效高于二甲雙胍組,其中以萸雅連降糖藥效最佳。通過比較空腹血糖得出的降糖藥效順序為:萸雅連>姜味連>葛黃>雅連>味連>酒味連>姜雅連>二甲雙胍>酒雅連>萸味連。但總體來說,各組差異并不很明顯,僅存在微弱的差異。因此,此降糖藥效的最終結果存在一定的偶然性和局限性。首先,所有炮制藥材均為實驗室自制,為小試產品,不具有代表性,無法代表車間大生產的飲片炮制品。其次,小鼠本身體質脆弱,狀態十分不穩定,易受各種客觀條件的影響,在試驗過程中各治療組小鼠均出現一定數量的小鼠死亡,尤以萸味連組小鼠死亡率最高,萸雅連組小鼠死亡率最低,部分小鼠因體質較弱發病嚴重死亡,也存在小鼠血糖降為正常而死因不明的情況。再次,由于小鼠血糖狀態的不穩定,僅通過空腹血糖的大小無法準確反映胰島破壞狀態,由此可能造成分組不均等情況。因此,此結論還需進一步的重復驗證,如采用基因缺陷型糖尿病小鼠模型重復驗證。
高血糖造成的高水平氧化應激反應[12],會破壞胰島β細胞,惡化病情,同時也是造成胰島素敏感性降低的主要誘因,形成胰島素抵抗[13]。氧化應激反應還可能導致動脈粥樣硬化從而誘發多種心腦血管的并發癥。抗氧化已經成為臨床治療糖尿的一種公認有效的手段[14]。血清MDA 含量結果顯示,各黃連給藥組均降低血清MDA 的水平,雅連組小鼠血清MDA 含量最低,抗氧化效果最佳。黃連能調節糖脂代謝紊亂,在降糖的同時可減小心血管并發癥的發病率。由空腹血糖的變化情況可以看出,萸雅連降糖藥效最佳。血清GSP、Ins 生化指標的結果表明,各黃連給藥組均有糖代謝調節作用,其中味連組在調節糖代謝方面效果最好,優于二甲雙胍組。這可能與其生物堿含量較高有關。HA Jung[15]等研究證明,表小檗堿、黃連堿、和格林蘭黃連堿對大鼠RLAR、HRAR 產生中等強度的抑制作用,有效治療和預防糖尿病及其并發癥。綜合比較TG、TC、HDL-C、LDL-C 四項血脂指標,各黃連給藥組對血脂水平具有一定的調節作用,尤以雅連效果最好。
萸雅連降血糖和調節糖脂代謝紊亂表現優異,具有良好的臨床應用前景,其作用機理有待進一步研究。

