基于Notch1信號通路探討白藜蘆醇對人結腸上皮細胞炎癥損傷的保護作用
趙 麗,華 夏,譚 曄,胡承蓮,熊 剛
(恩施土家族苗族自治州中心醫院 急診科,湖北 恩施 445000)
“腸粘膜屏障”遭到破壞會引起腸道上皮粘膜的持續性受損,進一步引發潰瘍性結腸炎[1]。然而研究報道結腸上皮細胞分化異常是導致腸粘膜屏障破損的主要致病機制[2-3]。早期發現Notch1信號傳導能介導結腸上皮細胞的分化過程[4-5],提示Notch1信號傳導激活會誘發靶基因Hes-1活化而介導信號向下游傳導,誘導腸道祖/干細胞增殖,調控結腸上皮細胞的分化,從而修復腸粘膜屏障損傷及促使結腸上皮再生,是治療潰瘍性結腸炎的重要環節[6]。白藜蘆醇(Resveratrol,Res)主要分布于葡萄、虎杖、花生、桑葚等多種植物,在抗腫瘤、降血脂及抗炎等方面表現出較強的生物活性[7]。近期報道Res能抑制結腸癌細胞的遷移及侵襲,降低了結腸癌細胞的增殖,起著抗腫瘤的作用[8];還發現Res能通過抑制Notch1信號傳導降低肝缺血/再灌注損傷大鼠的炎性反應及氧化損傷,從而起著保護作用[9]。但是Res是否通過調節Notch1信號傳導來影響結腸上皮細胞分化尚不清楚,于是本文采用人結腸上皮(NCM460)細胞為模型,探討了Res對LPS誘導細胞炎性損傷的保護作用及其對Notch1信號通路的影響。
1 材料與方法
1.1 儀器與材料 SPX-250型細胞培養箱及DNM-9602G酶標儀(美國Thermo公司);CX31-P型倒置顯微鏡(中國奧林巴斯公司);BBS-V800型單人超凈臺(香港Heal Force公司); NCM460細胞株(中國Auragene公司);胎牛血清、1640培養基(美國Hyclone公司);雙抗(美國MP公司);白藜蘆醇(湖北盛天恒創生物有限公司,經HPLC測定含量高于98%);Notch1激動劑(NSC 22423,美國Sigma公司);脂多糖(LPS,Sigma公司);IL-6、IL-1β 及TNF-α ELISA試劑盒(武漢華美生物有限公司);SDS-PAGE凝膠配制試劑盒(武漢谷歌生物有限公司);兔抗鼠β-actin、iNOS、COX-2、Notch1、Hes-1及Math-1一抗均購自美國CST公司;HRP標記山羊抗兔IgG二抗購自武漢谷歌生物有限公司。
1.2 細胞培養及分組 采用1640培養基培養NCM460細胞,條件為37 ℃、5% CO2恒濕培養箱,待細胞長滿至95%左右時用PBS清洗后加入胰酶消化,顯微鏡下觀察待細胞變圓后加入培養基終止消化,分裝于3個培養瓶進行傳代培養。待細胞生長狀態較佳,用對數生長期細胞進行后續實驗。實驗分為空白對照組、LPS誘導組、LPS+低劑量Res組、LPS+高劑量Res組、LPS+高劑量Res+NSC組。采用LPS(1 mg/L)干預細胞構建炎性損傷模型,低、高劑量Res(40、120 μmol/L)及Notch1激動劑NSC 22423(2 μmol/L)處理細胞24 h后,收集細胞及培養液進行相關指標檢測。
1.3 CCK8實驗 按照“1.2”分組將適量密度細胞接種于96孔板,培養過夜后進行相關藥物干預,24 h后棄去舊培養液,每孔加入10 μL CCK8試劑,繼續培養2 h后,在酶標儀中于450 nm波長處測定吸光度A值,每組實驗設置3個復孔。細胞相對存活率(%)=A實驗組/A對照組×100%。
1.4 ELISA實驗 按照“1.2”分組將適量密度細胞接種于6孔板,培養24 h后進行相關藥物干預,24 h后收集培養液及細胞,每組設置3個復孔。細胞培養液用于ELISA檢測,細胞用于Western Blot檢測。細胞培養液中炎性因子IL-6、IL-1β及TNF-α水平檢測步驟按照ELISA試劑盒說明書進行操作。具體操作如下:將細胞培養液離心,取標準品及標本上清100 μL加入酶標板中,37 ℃孵育2 h;棄去上清液,加入100 μL生物素化抗體工作液,37 ℃孵育1 h;洗滌3次,加入100 μL酶結合物工作液,37 ℃孵育1 h;洗滌5次,加入90 μL底物溶液,37 ℃孵育10 min;加入50 μL終止液;5 min內在450 nm波長處測量OD值。
1.5 Western blot實驗 將“1.4”項收集的細胞用RIPA裂解液冰上充分裂解制備勻漿,超聲破碎、12 000 rpm離心12 min后收集上清,BCA試劑盒測定上清蛋白濃度。每個樣本上樣50 μg進行凝膠電泳,待蛋白完全分離后進行轉膜實驗。結束后加入5%脫脂奶粉封閉液于搖床上室溫封閉1h后,分別加入iNOS、COX-2、Notch1、Hes-1及Math-1抗體(體積稀釋比例均為1∶1 000)4 ℃反應過夜。次日TBST洗膜3次后加入HRP標記的山羊抗兔IgG(體積稀釋比例為1∶3 000),室溫反應1 h。再用TBST洗膜3次,每次10 min,以ECL試劑顯影后進行蛋白條帶灰度值分析。每組設置1個復孔,重復實驗3次,以β-actin作為內參,蛋白相對表達量=目的蛋白灰度值/內參蛋白灰度值。
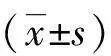
2 結果
2.1 Res對NCM460細胞增殖的影響 CCK8實驗結果提示LPS干預能明顯抑制NCM460細胞增殖,而不同劑量Res能促使NCM460細胞增殖,其相對存活率顯著高于LPS誘導組(P<0.05);然而加入Res和NSC共同孵育NCM460細胞,發現細胞相對存活率與LPS誘導組相比沒有明顯差異(P>0.05,見圖1)。
2.2 Res對NCM460細胞培養液中炎性因子釋放的影響 ELISA實驗結果提示:LPS干預能明顯促使NCM460細胞分泌炎性因子IL-6、IL-1β及TNF-α,細胞培養液中炎性因子水平顯著高于空白對照組(P<0.05);NCM460細胞經過低、高劑量Res處理后培養液中IL-6、IL-1β及TNF-α水平相對LPS誘導組顯著降低(P<0.05);而經Res和NSC共同干預后培養液中炎性因子水平與LPS誘導組相比沒有顯著差異(P>0.05,見表1)。

與空白對照組比較,*:P<0.05;與LPS誘導組比較,#:P<0.05;與LPS+高劑量Res組比較,+:P<0.05。圖1 各組細胞相對存活率比較
表1各組炎性因子水平比較

組別IL-6(pg/mL)IL-1β(pg/mL)TNF-α(pg/mL)空白對照612.6±104.760.8±11.486.3±12.4LPS誘導1526.4±295.4?156.4±28.6?182.6±17.3?LPS+低劑量Res1131.5±253.9#116.3±21.5#136.1±15.2#LPS+高劑量Res825.7±185.6#76.4±14.6#103.8±12.7#LPS+高劑量Res+NSC1452.8±305.7+160.8±31.4+195.6±20.7+
與空白對照組比較,*:P<0.05;與LPS誘導組比較,#:P<0.05;與LPS+高劑量Res組比較,+:P<0.05。
2.3 Res對NCM460細胞iNOS及COX-2蛋白表達的影響 Western blot實驗結果顯示:LPS干預能明顯促使NCM460細胞表達炎性蛋白iNOS及COX-2,細胞中炎性蛋白iNOS及COX-2表達顯著高于空白對照組(P<0.05);NCM460細胞經過低、高劑量Res處理后細胞中炎性蛋白iNOS及COX-2表達相對LPS誘導組顯著降低(P<0.05);而經Res和NSC共同干預后細胞中炎性蛋白iNOS及COX-2表達與LPS誘導組相比沒有顯著差異(P>0.05,見圖2)。

與空白對照組比較,*:P<0.05;與LPS誘導組比較,#:P<0.05;與LPS+高劑量Res組比較,+:P<0.05;A:Western blot檢測iNOS、COX-2、β-actin蛋白的表達水平;B:各組iNOS/β-actin蛋白的表達比較;C:各組COX-2/β-actin蛋白的表達比較。圖2 各組間iNOS及COX-2蛋白表達比較
2.4 Res對NCM460細胞Notch1、Hes-1及Math-1蛋白表達的影響 Western blot實驗結果顯示:LPS干預能明顯促使NCM460細胞表達Notch1和Hes-1、抑制Math-1蛋白表達(P<0.05);NCM460細胞經過低、高劑量Res處理后細胞中Notch1和Hes-1表達相對LPS誘導組顯著降低,而Math-1蛋白表達顯著升高(P<0.05);而經Res和NSC共同干預后細胞中Notch1、Hes-1及Math-1蛋白表達與LPS誘導組相比沒有顯著差異(P>0.05,見圖3)。

與空白對照組比較,*:P<0.05;與LPS誘導組比較,#:P<0.05;與LPS+高劑量Res組比較,+:P<0.05;A:Western blot檢測Notch1、Hes-1、Math-1、β-actin蛋白的表達水平;B:各組Notch1/β-actin蛋白的表達比較;C:各組Hes-1/β-actin蛋白的表達比較;D:各組Math-1/β-actin蛋白的表達比較。圖3 各組間Notch1、Hes-1及Math-1蛋白表達比較
3 討論
潰瘍性結腸炎屬于常見的消化道疾病,主要表現為結腸粘膜持續性損傷,其可能的病理機制與腸上皮細胞分化異常有關。因此,本文采用NCM460細胞株為模型探討了白藜蘆醇對細胞炎性損傷及相關分化蛋白表達的影響。實驗結果發現Res能促使NCM460細胞增殖,并降低細胞培養液中炎性因子IL-6、IL-1β及TNF-α的釋放,并抑制細胞中炎癥蛋白iNOS及COX-2表達。
早期報道腸道上皮細胞分化受多個信號傳導影響,主要包括Notch、Wnt及BMP等[10],然而研究證實Notch1蛋白是結腸上皮層分化、再生的關鍵性解控因子,在調節上皮細胞增殖、分化、維持上皮層微環境穩定及維持上皮層抗菌信號通路的活性等方面具有重大作用[11]。研究發現Notch1基因表達水平能夠關鍵性調控腸道上皮細胞中分泌型及吸收型細胞的命運[12]。Notch1作用的下游靶基因屬于堿式螺旋-環-螺旋家族轉錄因子,而Hes-1及Math-1屬于介導人類腸道上皮細胞分化方向的關鍵因子[13],Hes-1蛋白高表達可誘導腸上皮細胞分化為吸收型細胞,Math-1蛋白高表達可誘導腸上皮細胞分化為分泌型細胞。當Notch1信號傳導活化時可誘導Hes-1蛋白表達升高、Math-1蛋白表達降低,從而誘導吸收型細胞增多、分泌型細胞減少,改變了腸上皮細胞功能[14]。分泌型細胞可分泌黏蛋白、上皮結膜蛋白、三葉因子多肽及抵抗素樣因子β、Fc-γ結合蛋白等,這些因子在腸道上皮層起著防御作用,可抵制腸道內微生物的侵害[15]。研究發現在潰瘍性結腸炎部位分泌型細胞數明顯減少,而且上述因子表達水平也明顯降低,破壞了上皮層正常的防御功能,從而引起微生物入侵導致炎性反應[16]。本研究實驗結果提示,Res對Notch1信號通路有一定的調節作用,能夠抑制Notch1的活化,進一步抑制Hes-1蛋白表達、誘導Math-1蛋白表達,從而促使細胞向分泌型分化,降低LPS誘導的炎癥反應。并且采用Notch1激動劑與Res共同干預細胞后,發現Notch1激動劑能夠逆轉Res對Notch1蛋白表達的抑制作用,說明Res可能通過Notch1信號通路調節結腸上皮細胞的分化及炎癥反應。激動劑誘導Notch1信號通路活化及相關蛋白表達,Res能夠抑制Notch1信號通路活化及相關蛋白表達,可能是二者競爭性與Notch1結合,哪個結合能力更強,那么發揮的相關作用就越顯著。本文發現Notch1激動劑能夠逆轉Res對Notch1蛋白表達的抑制作用,說明該激動劑與Notch1相互作用的強度更強。綜上所述,Res可通過Notch1信號通路調節人結腸上皮細胞的增殖和分化,對潰瘍性結腸炎具有保護作用。

