雙shRNA表達載體對HSV-2復制的干擾作用
向紅英,蘭小松,呂延成
(遵義醫學院珠海校區 生物化學教研室,廣東 珠海 519040)
Ⅱ型單純皰疹病毒(herpes simplex virus 2,HSV-2)是一種具有包膜的DNA病毒,是造成皮膚、黏膜和神經等外胚層慢性感染和經常性生殖器潰瘍的主要病毒之一[1],利用短發卡RNA(small hairpin RNA,shRNA)表達載體轉入哺乳動物細胞產生小干擾RNA(small interference RNA,siRNA)可以干擾HSV-2基因的表達[2-5]。本研究利用帶有多個啟動子的表達質粒,針對HSV-2的UL27和UL54構建了一種可同時表達雙短發卡RNA(Duo-shRNA)的重組載體,通過與單-shRNA重組表達載體進行比較,探討其對HSV-2病毒復制的影響。
1 材料與方法
1.1 材料與儀器 HSV-2333病毒株標準品購于廣州博特生物技術公司,人胚腎293細胞株(HEK293)和E.coliDH5α由本校區生物化學與分子生物學實驗室提供,帶有多個啟動子的pGenesil10-3p質粒(見圖1)及用于表達shRNA的寡核苷酸鏈由武漢市淅瑪生物技術有限公司提供并進行連接構建。 限制性內切酶BbsI、BamH I和PstI、TRIzol試劑購自日本Takara公司,SYBR Green PCR Master Mix試劑盒購自日本Toyobo公司,新生牛血清購自中國杭州四季青公司,質粒小量提取試劑盒購自中國杭州愛思進生物技術有限公司,HSV-2 gB和ICP27抗體分別購于美國Santa Cruz Biotechnology公司和Abcam公司,Lipofectamine2000轉染試劑盒和DMEM分別購自美國Invitrogen公司和Gibco公司。
主要儀器有產自中國蘇州凈化設備廠的YJ-1450型醫用凈化工作臺,德國徠卡公司的Elx-800型全自動酶標儀,德國eppendorf公司的5810R臺式冷凍離心機及美國SHEL公司的CO2培養箱等。
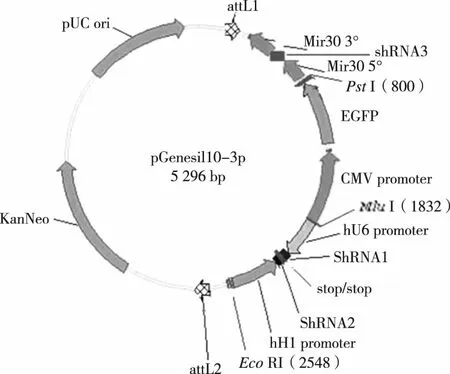
圖1 pGenesil10-3p質粒結構
1.2 方法
1.2.1 HSV-2UL27、UL54干擾靶位點的選擇和shRNA表達載體的構建 從GenBank上檢索HSV-2(NC_001798)UL27和UL54編碼序列,參照shRNA設計原則,對其保守區域序列進行篩選,合成干擾靶序列,采用pGenesil10-3p質粒分別構建表達單、雙shRNA的表達載體。另構建兩條不干擾任何基因的隨機序列作為陰性對照組(Negative control,NC)。選擇的干擾基因靶序列及構建的質粒表達載體(見表1)。
表1反義靶點的DNA模板序列
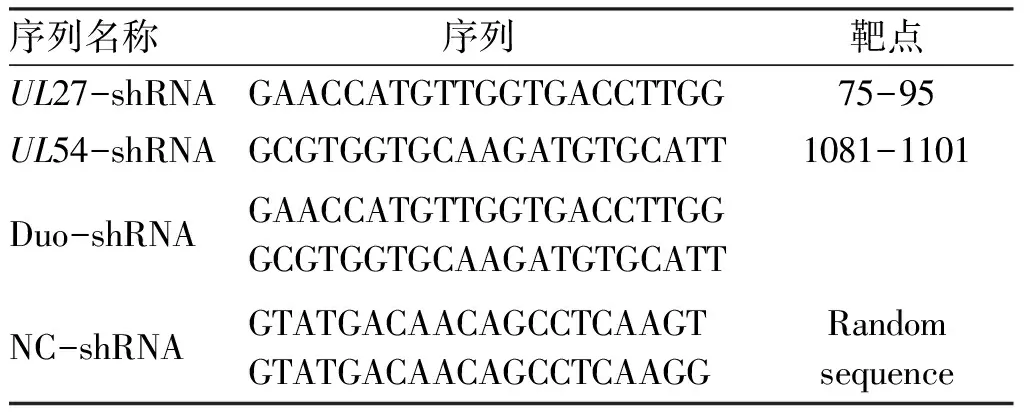
序列名稱序列 靶點UL27-shRNAGAACCATGTTGGTGACCTTGG75-95UL54-shRNAGCGTGGTGCAAGATGTGCATT1081-1101Duo-shRNAGAACCATGTTGGTGACCTTGGGCGTGGTGCAAGATGTGCATTNC-shRNAGTATGACAACAGCCTCAAGTGTATGACAACAGCCTCAAGGRandom sequence
1.2.2 HEK293細胞的轉染 HEK293在37 ℃,5% CO2條件下,在含10%胎牛血清(FBS)的DMEM完全培養液中按常規方法進行培養(下同)。取對數生長期的細胞接種于24孔培養板中(每孔約4×104~5×104個細胞)。實驗分為NC-shRNA(陰性對照組)、空載體(空白對照組)和干擾組;干擾組包括:單干擾組(UL27-shRNA和UL54-shRNA組)、單干擾聯合組(UL27-shRNA+UL54-shRNA)和Duo-shRNA組,每組設3個復孔。培養24 h至細胞生長至一定豐度后,分別取上述構建的單、雙shRNA表達質粒配制質粒轉染混合物(質粒與Lipofectamin2000比為0.8 μg:2 μL),每孔細胞中加入100 μL質粒轉染混合物后再培養48 h,熒光顯微鏡觀察轉染情況。
1.2.3 HEK293細胞接種病毒 HSV-2在HEK293中進行擴增培養,收集病毒并用終點滴定法檢測病毒滴度,HSV-2的滴度用半數組織培養感染劑量(TCID50)表示。1.2.2中的轉染質粒的細胞培養48 h后,去掉細胞上清后加入TCID50為10-5.25/0.1 mL的病毒懸液100 μL/孔,繼續培養1~2 h后去掉病毒液,后加入2% DMEM進行培養,48 h后收集細胞上清液進行病毒滴度檢測,收集細胞提取總RNA和總蛋白進行mRNA和靶蛋白分析。
1.2.4 子代病毒滴度的測定和細胞存活率檢測 收集各孔細胞培養上清液,同上用終點滴定法測定上清病毒滴度并計算各組TCID50,剩余的細胞用MTT法測定細胞存活率,以檢驗表達的siRNA對HSV-2復制的抑制效果。
1.2.5 實時熒光定量PCR檢測靶基因mRNA的表達水平 抽提細胞總RNA,用DNase Ⅰ去除非特異性DNA片段并檢測RNA純度和完整性,采用隨機引物法進行反轉錄,實時熒光定量PCR儀進行PCR 擴增。UL27上游引物:5'-CAAAGACGTGACCGTGTCGCAG-3',下游引物:5'-GCGGTGGTCTCCATGTTGTTCC-3';UL54上游引物:5'-CCAGGACCCTATCATCGGAACG-3',下游引物:5'-AGTATTTCAATGAGACCCGCCAT-3';內參GAPDH上游引物:5'- AGAAGGCTGGGGCTCATTTG-3',下游引物:5'-AGGGGCCATCCACAGTCTTC-3'。引物由上海生物工程公司合成,PCR參數為:95 ℃ 5 min;95 ℃ 15 s;60 ℃ 15 s;72 ℃ 32 s,共42個循環。以GAPDH為內參標準,△△比較法計算各組UL27和UL54 mRNA的相對表達量并計算對靶基因表達的抑制率。
相對mRNA表達量 =(Ct靶基因- Ct內參)干擾組-(Ct靶基因- Ct內參)對照組。
mRNA抑制率(%)=(1-干擾組相對mRNA表達量/對照組相對mRNA表達量)×100%。
1.2.6 蛋白質印跡法檢測gB和ICP27蛋白表達 提取細胞總蛋白,BCA法進行蛋白定量分析。12% 聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,電轉移法將電泳蛋白條轉至PVDF 膜,加入一抗4 ℃孵育12 h,漂洗后加入二抗,37 ℃作用40 min。用ECL試劑盒對WB條帶進行化學熒光顯色,X線膠片經ImageJ圖像分析軟件對蛋白條帶進行定量分析。gB和ICP27蛋白表達量以管家基因表達的蛋白(GAPDH)為參照計算。并按如下公式計算:相對表達量(%)= 目的條帶灰度值/內參條帶灰度值×100%。
2 結果
2.1 細胞上清液中病毒滴度 接種病毒48 h后檢測細胞培養上清病毒滴度(見表2)。其中NC-shRNA與空白對照組無差異(P>0.05),單、雙-shRNA表達載體與空白對照相比均能使細胞上清液中的病毒滴度降低(P<0.05),且單干擾聯合組(UL27-shRNA +UL54-shRNA)和Duo-shRNA組比單干擾組降低病毒滴度的效果更好(P<0.05),表明對于雙基因的干擾能夠更有效的抑制HSV-2的復制,但單干擾聯合組與雙干擾組之間對于病毒滴度的影響無顯著性差異(P>0.05)。
表2接種48 h后各試驗組HSV-2病毒滴度

組別HSV-2 病毒滴度/100 μL空白對照10-6.2±0.3NC-shRNA10-6.3±0.3UL27-shRNA10-3.2±0.3 ?UL54-shRNA10-3.4±0.1 ?UL27-shRNA +UL54-shRNA10-2.0±0.2 ?△#Duo-shRNA10-2.2±0.3 ?△#※
*:P<0.05,與空白對照組相比; △:P<0.05,與UL27-shRNA相比; #:P<0.05,與UL54-shRNA相比; ※:P>0.05,與UL27-shRNA+UL54-shRNA相比。
2.2 細胞存活率 通過MTT法檢測各實驗組細胞存活率(見圖2)。NC-shRNA組與空白對照相比無顯著差異(P>0.05),單、雙-shRNA干擾組與NC-shRNA組相比均有顯著差異(P<0.05),且干擾聯合組和Duo-shRNA組的細胞存活率明顯高于單干擾組(P<0.05),但干擾聯合組與Duo-shRNA組比較無顯著差異(P>0.05)。表明采用shRNA干擾技術能夠提高細胞的存活率,而且對于雙基因的同時干擾會更有效。
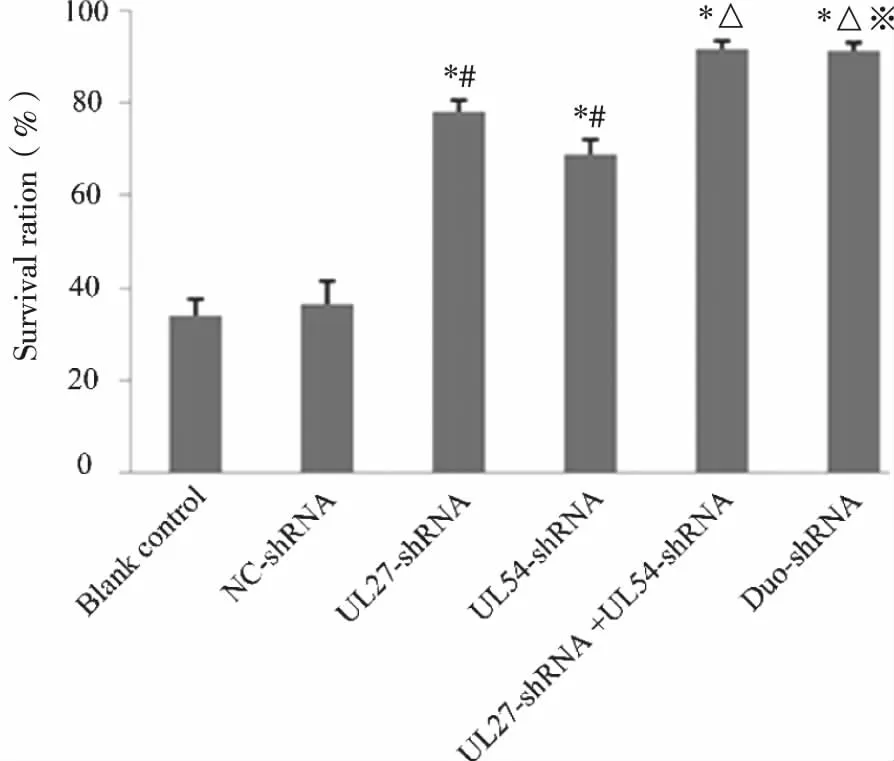
*:P<0.05,與陰性對照組相比; #:P<0.05,與Duo-shRNA相比; △:P<0.05,與UL27-shRNA,UL54-shRNA相比; ※:P>0.05,與UL27-shRNA+UL54-shRNA。圖2 MTT法測定HEK293細胞存活率
2.3 靶基因 mRNA的抑制效率 從接種HSV-2病毒48 h后計算得出各實驗組靶基因mRNA表達抑制率(見表3)。單、雙-shRNA干擾組與空白對照相比均具有顯著性差異(P<0.05),表明單、雙-shRNA表達載體均能在一定程度上干擾其靶mRNA的表達;且單干擾組對UL27mRNA和UL54 mRNA抑制率明顯低于干擾聯合組和Duo-shRNA組(P<0.05),表明對多個靶基因的干擾能夠在mRNA水平上降低每一個基因的表達量;而干擾聯合組與Duo-shRNA組之間對UL27、UL54 mRNA抑制率無顯著差異(P>0.05)。
表3各試驗組UL27、UL54 mRNA抑制率

組別UL27mRNA抑制率(%)UL54mRNA抑制率(%)Blank control——NC-shRNA33UL27-shRNA65?—UL54-shRNA—72?UL27-shRNA+UL54-shRNA85?△81?#Duo-shRNA84?△※88?#※
*:P<0.05,與空白對照組相比;△:P<0.05,與UL27-shRNA相比; #:P<0.05,與UL54-shRNA相比; ※:P>0.05,與UL27-shRNA+UL54-shRNA相比。
2.4 靶基因蛋白表達水平 采用Western blot檢測UL27編碼的gB蛋白和UL54編碼的ICP27蛋白表達水平(見圖3~4)。從實驗結果可以看出,
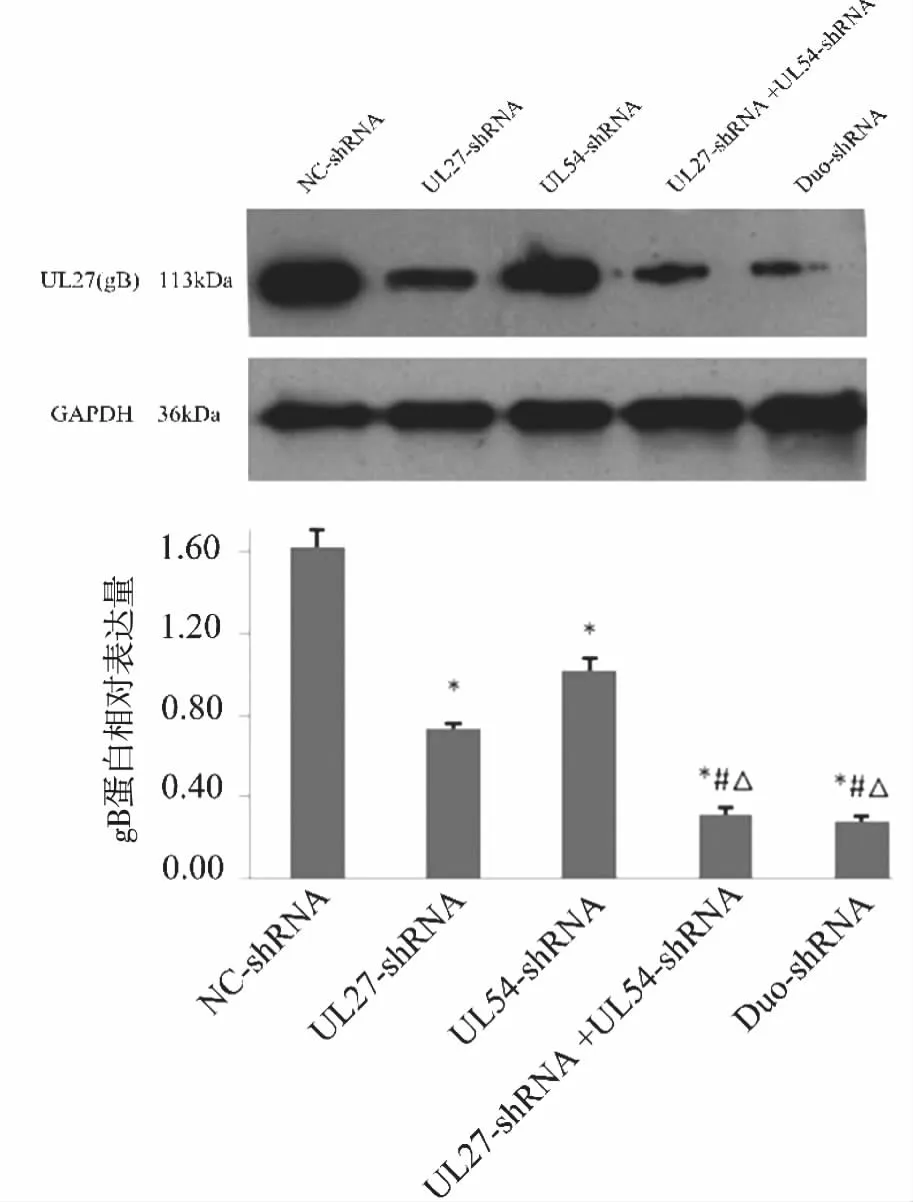
*:P<0.05,與陰性對照組相比;△:P<0.05,與UL27-shRNA相比; #:P<0.05,與UL54-shRNA相比。圖3 Western-blot檢測gB蛋白表達水平
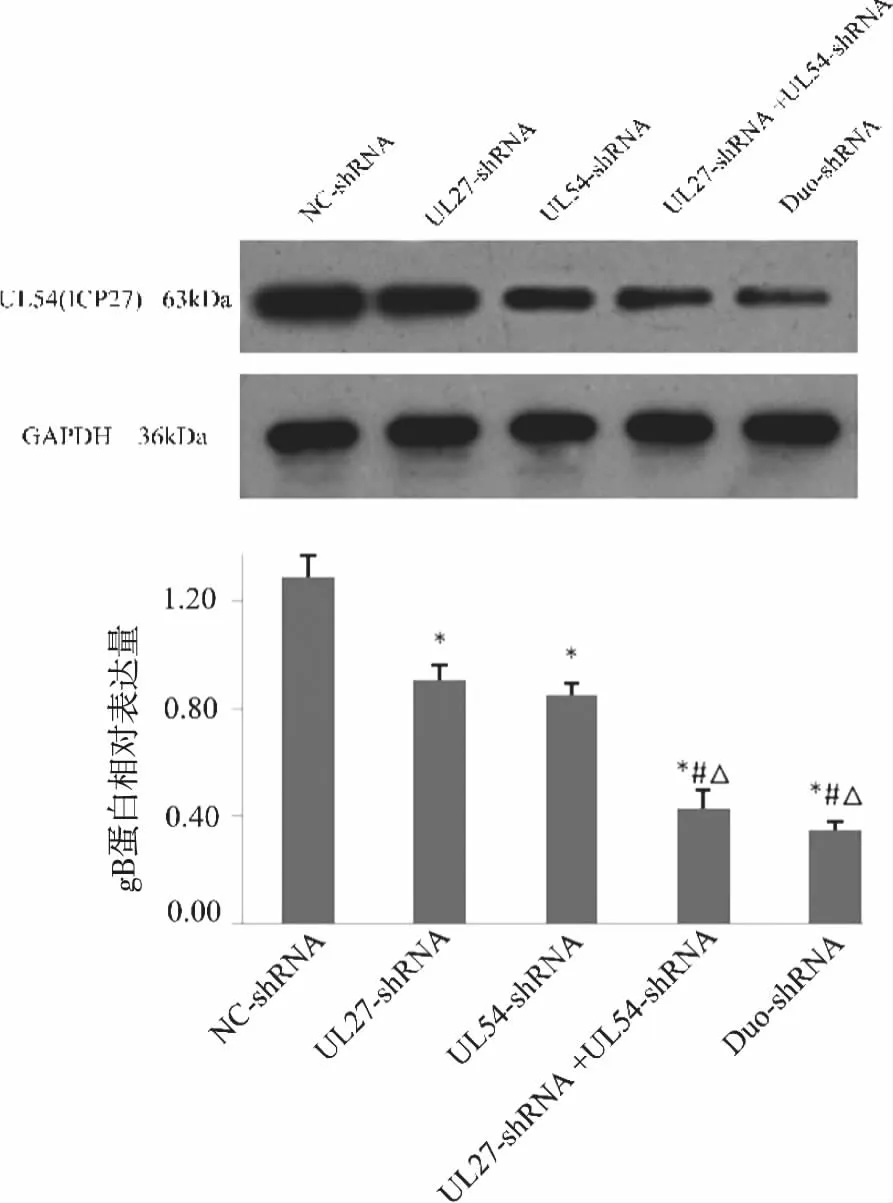
*:P<0.05,與陰性對照組相比;△:P<0.05,與UL27-shRNA相比; #:P<0.05,與UL54-shRNA相比。圖4 Western-blot檢測 ICP27蛋白表達水平
各shRNA干擾組與NC-shRNA組相比gB和ICP27蛋白的表達都明顯降低(P<0.05),表明無論是對兩個靶基因還是對其中的任何靶一個基因干擾,都會影響到靶蛋白的表達;干擾聯合組和Duo-shRNA組與單基因干擾組相比,降低靶蛋白的效果更為明顯(P<0.05),表明雙基因的干擾優于單基因的干擾,但干擾聯合組和Duo-shRNA組之間無顯著差異(P>0.05)。數值用靶蛋白GAPDH條帶的灰度值表示。
3 討論
實驗利用帶有多個不同啟動子的框架,在hU6啟動子后連接針對UL27的shRNA表達序列,同時在hH1啟動子后連接針對UL54的shRNA表達序列,構成反式表達雙shRNA的表達載體質粒,構建經脂質體轉染HEK293細胞后再感染病毒,通過對細胞存活率、子代病毒滴度、靶基因的mRNA轉錄水平和蛋白表達水平檢測結果表明,這種串聯反式雙shRNA的表達載體,在抑制HSV-2復制、干擾靶基因的表達,提高對宿主HEK293細胞保護作用方面都明顯優于單-shRNA表達載體,并可以達到利用兩個單-shRNA表達載體相同的干擾效果。雖然利用化學合成的siRNA導入細胞或載體介導shRNA的方式產生RNAi[6-7]取得不錯的效果,但對病毒成功實施RNAi的關鍵是如何使細胞內的siRNA具有長期持久的作用以及對病毒基因發揮有效的干擾作用,然而化學合成的siRNA 所致的基因沉默具有暫時性的特點,使其在抑制病毒復制應用上受到一定限制。而使用shRNA序列的表達載體就能克服這一缺點,shRNA轉人細胞后在Dicer酶作用下轉化成siRNA,此方法持續時間長,但通過產生單個shRNA的方式對病毒的單個基因實施干擾,很難完全抑制病毒的復制[3]。因此提高siRNA對病毒基因的干擾效率,可能的途徑之一是對病毒多個靶基因同時實施干擾,針對病毒不同的靶基因構建多個shRNA表達載體,然后同時轉染細胞,表達產生不同的siRNA。這種由多個shRNA表達載體實施的聯合干擾作用可以有效抑制病毒的增值[8],但該過程需要構建不同的shRNA重組表達載體,并經過多步轉染,操作繁瑣,而且質粒上攜帶的綠色熒光蛋白(Green fluorescent protein,GFP)具有的“毒性效應”可導致細胞死亡率增加[9-10]。
因此實施多靶位點RNAi具有一定的優勢[11],利用多啟動子的表達載體對病毒進行多靶點的基因干擾能夠達到多基因干擾的目的,不僅能夠提高干擾效率,有效抑制病毒復制,保護宿主細胞,同時具有操作簡便易行的特點。雖然現在對這種多基因干擾中病毒基因之間的相互作用和影響的機制還不完全清楚,但它可能成為抑制病毒復制的一種有效方法。
綜上所述,本文利用雙啟動子的方法構建了針對HSV-2的UL27和UL54的shRNA質粒表達載體。并比較了雙shRNA表達載體和UL27-shRNA+UL54-shRNA聯合介導的雙基因干擾、UL27-shRNA和UL54-shRNA介導的單基因干擾對抑制HSV-2病毒靶基因mRNA表達水平以及病毒在HEK293細胞中增殖。結果表明雙shRNA對HSV-2病毒的抑制效率較單基因干擾好,同時解決了雙載體雙基因介導基因沉默在轉染細胞后可能出現的載體數量上的差異和均一性問題。

