構建命題聯想系統 提高化學解題能力
摘 要:本文舉例說明“什么是命題聯想系統”“為什么要構建命題聯想系統”以及“如何構建命題聯想系統”等問題。通過調查了解學生命題聯想能力的現狀,從而提出幫助學生建構命題聯想系統提高化學解題能力的教學建議。
關鍵詞:命題聯想系統;聯想能力;化學;習題教學;解題能力
一、 問題的提出
評講習題時,教師常常會把自己的解題思路演示給學生,“由已知條件……(a),可以看出……(b),然后就可以……(c)”,其實這就是一個命題聯想過程,它可以在已知與未知之間架設橋梁。但問題的關鍵是,學生在解題時,就是沒能從a想到b,所以造成思維短路,雖然c所涉及的知識點或方法學生可能是具備的,卻仍然無法順利給出正確的解答。現在聽了教師的講解,貌似茅塞頓開,可下一次遇到類似問題,依然會被卡住,因為他自己想不到。
如何幫助學生解決“想不到”的困難呢?指導學生進行命題聯想,進而幫助學生構建自己的命題聯想系統,是一個具有可操作性的辦法。有了這樣一個系統,學生才有可能從中檢索到所需要的解題思路和素材,從而進行正確的解題。
二、 什么是命題聯想系統
“命題”一詞在現代哲學、數學、邏輯學、語言學中均有涉及,其意是指一個判斷的語義,通俗地說就是一句陳述性語句所實際表達的意思,如“硫酸溶液顯酸性”就是一個命題(命題A)。
“命題聯想”即由某一命題聯想到其他的相關命題,與之相關的能力通常被稱為聯想能力或直覺思維能力。依據知識水平、認知能力、理解能力的差異,不同的人對同一命題產生的聯想存在較大差異。如由上述命題A可聯想產生下述命題中的部分、全部甚至更多:
命題B——硫酸是一種酸;
命題C——硫酸能電離產生H+;
命題D——硫酸溶液能使石蕊變紅;
命題E——硫酸溶液能與活潑金屬、堿、堿性氧化物、某些鹽溶液(如Na2CO3、BaCl2反應……
這些命題之間由此及彼、相互關聯,聯結成知識的線索或網絡——即形成“命題聯想系統”。化學解題過程往往就是通過命題聯想將問題不斷轉換的過程,特別是在解答綜合性、開放性試題時,豐富的命題聯想系統以及對其中有用命題的快速準確定位是提高解題速度、準確性的根本保障。
三、 命題聯想系統的構成
命題聯想系統的建構體現了思維的廣闊性和開放性,但它并非不著邊際天馬行空,了解命題系統的分類有助于教師在日常教學中有效地指導學生進行命題聯想。
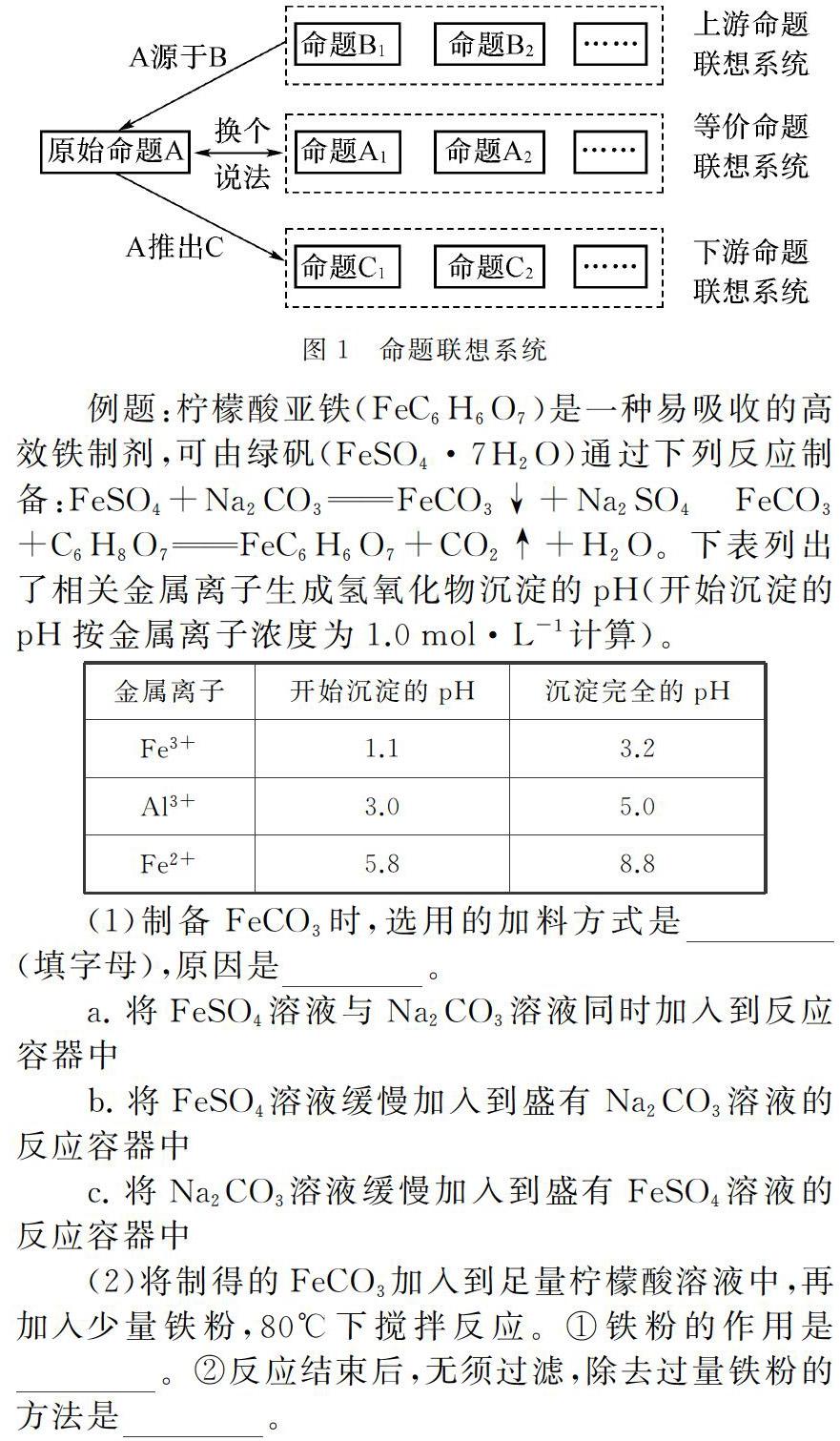
如圖1所示,根據原始命題與聯想命題之間的關系,命題聯想系統可分為等價命題聯想系統、下游命題聯想系統和上游命題聯想系統。以下面一道題目為例來進行說明。
例題:檸檬酸亞鐵(FeC6H6O7是一種易吸收的高效鐵制劑,可由綠礬(FeSO4·7H2O)通過下列反應制備:FeSO4+Na2CO3FeCO3↓+Na2SO4
FeCO3+C6H8O7FeC6H6O7+CO2↑+H2O。下表列出了相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0mol·L-1計算)。
(1)制備FeCO3時,選用的加料方式是 (填字母),原因是 。
a. 將FeSO4溶液與Na2CO3溶液同時加入到反應容器中
b. 將FeSO4溶液緩慢加入到盛有Na2CO3溶液的反應容器中
c. 將Na2CO3溶液緩慢加入到盛有FeSO4溶液的反應容器中
(2)將制得的FeCO3加入到足量檸檬酸溶液中,再加入少量鐵粉,80℃下攪拌反應。①鐵粉的作用是 。
②反應結束后,無須過濾,除去過量鐵粉的方法是 。
(一) 等價命題聯想系統——體現聯想的廣度
等價命題與原始命題含義相同,只是通過變換角度,使其所表達的含義更加清晰明朗,從而起到降低難度的作用,也能夠挖掘出更多的隱藏條件。
如表格中關于Fe2+可以直接提取的命題包括:pH 5.8時Fe2+開始沉淀,pH 8.8時Fe2+沉淀完全。將這兩個命題進行組織和排序后不難得出如下等價命題:①pH<5.8時Fe2+尚未開始沉淀;②pH介于5.8~8.8之間時,部分Fe2+形成沉淀,Fe2+與Fe(OH)2共存;③pH>8.8時,Fe2+全部轉化為Fe(OH)2沉淀;④Fe2+可大量存在于pH<5.8的酸性溶液中;⑤pH越大越易形成Fe(OH)2沉淀……命題④⑤在學生的命題聯想系統中出現的概率遠遠小于前3個,而其中的等價命題⑤對于第(1)小題的解答具體非常重要的意義:實驗目的為制備FeCO3,所以應盡量避免Fe(OH)2的生成,對比b、c兩個選項不難發現,前者Na2CO3溶液呈現較強的堿性,加入的Fe2+極易轉變成Fe(OH)2沉淀;而后者Na2CO3緩慢少量加入,且立刻轉變為
FeCO3,可有效避免生成Fe(OH)2。
(二) 下游命題聯想系統——體現聯想的深度
如果有了命題A,就可以得出命題C,那么命題C就是A的下游命題。研究從A可以推出些什么命題(C1、C2、C3……),這就得到命題A的下游命題系統。依據化學學科的特點,當我們知道體系中含有某一物質或微粒,那么與之相關的一系列物理、化學性質、用途等皆屬于該命題的下游命題系統范疇。
如第(2)小題,將制得的FeCO3加入到足量檸檬酸溶液中,可得到檸檬酸亞鐵溶液,那么由“溶液中含有Fe2+”,即可聯想得出一系列下游命題:①溶液呈淺綠色;②Fe2+為+2價,屬于中間價態,既有氧化性又有還原性;③Fe2+有較強的還原性,易被氧化;④Fe2+對應的堿Fe(OH)2為弱堿,故Fe2+易水解,溶液呈酸性;⑤Fe2+可與OH-結合生成沉淀……而向該溶液中加入Fe粉,可有效地防止Fe2+被空氣中的氧氣氧化。
(三) 上游命題聯想系統——體現聯想的高度
為了得到命題A,需要尋找命題B,那么命題B就是A的上游命題。能夠推得命題A的命題B1、B2、B3……構成命題A的上游命題系統。
如第(2)小題后一問,為了除去過量的鐵粉,可以找到這樣幾種方法:過濾法、反應轉化法……為了得到檸檬酸亞鐵,可以想到的方法有:鐵與檸檬酸反應、亞鐵鹽與檸檬酸反應、亞鐵鹽與檸檬酸鹽反應……將兩個命題系統進行比對并取交集,得到除去檸檬酸亞鐵溶液中的鐵的最佳方法:加入檸檬酸,使鐵轉化為檸檬酸亞鐵。
四、 高中生“命題聯想能力”的構建策略
對于同一個命題,各人頭腦中形成的命題聯想系統是各不相同的。學生的成績越優秀,其命題聯想系統也就越豐富,他們可以把不同時期學到的知識組合在一起,形成一個知識跨度較大的知識網絡,而其好處是顯而易見的。但對于化學學困生而言,他們的聯想往往停留在較早前形成的知識水平(初中階段),如方程式中的物質關系、系數關系,卻無法將新近學習到的知識(如氧化還原的相關概念)納入聯想系統當中。學生頭腦中缺少的不一定是知識點,而是思考的方向。作為化學教師,我們不但應該讓學生了解聯想能力的重要性,更應該在各個教學環節中有意識地幫助學生建構具有一定寬度的命題聯想系統,從而克服化學解題中“想不到”這一困難。
(一) 通過實踐讓學生感知“命題聯想”其實無處不在
聯想是一個隱性的思維過程,但教師可以想辦法讓這個過程顯性化,讓學生有直觀的感受。如在復習課上利用思維導圖和學生一起構建知識網絡;在習題講評的過程中,用流程圖將已知和未知之間那個“斷了的橋梁”架起來;在教學過程中多給學生一些機會,讓他們說說自己想到了什么,為什么會想到這些。
(二) 新授課環節幫助學生衍生新的聯想方向
依然以“溶液中含有Fe2+”這一命題為例,其下游命題聯想系統在化學學習過程中被不斷地擴充。初中時學生只能聯想到“這是一種鹽溶液”“溶液是淺綠色的”等命題,而在進入高中之后,學習了氧化還原概念,學生應該可以聯想到“+2價的Fe屬中間價,既有氧化性又有還原性”;學習了鐵元素及其化合物相關知識后,可以聯想到“Fe2+具有較強的還原性,易被O2、Cl2、HNO3、KMnO4等氧化成Fe3+,所以配制Fe2+溶液時需要加入Fe粉防氧化”;學習了鹽類水解之后,可以聯想到“Fe2+水解使溶液顯酸性,配制溶液時加酸有助于抑制水解”。
但是學生在不斷地接受新知識的同時,常常出現這樣的狀況:比如在學習“鹽類的水解及其應用”時,不管是否適用,所有的問題都一股腦地貼上“水解”的標簽,可是在學過一段時間之后,綜合應用中卻很難再想到水解問題。由此可見,學生的命題聯想是即時的、線性的。
(三) 復習課環節幫助學生通過聯想形成知識網絡
現在各種各樣的教學輔導書,都會在課時復習的前面列出知識點,在單元復習的前面列出知識網絡。但學生看了這些之后往往都會產生“這些我都知道的,可是一到題目當中就不知該怎么辦”的困惑。所以教師不僅要引導學生閱讀高考教輔材料中的知識網絡,還要大膽放手讓學生自己構建知識網絡。比如在進行元素化合物知識的復習時,讓學生動手通過聯想建構知識網絡圖,雖然他們不可能像資料上或者教師一樣考慮得那么周到全面,但最起碼他們可以了解到自己已有的知識體系與預期的完整知識網絡之間存在多大的差距,并且產生一種將其修補完整的愿望和沖動。然后再通過學生之間的相互補充形成完整的體系,雖然花費了一定的時間,但其效果遠比“教師說上半句,學生補充下半句”的復習方法要來得好。
(四) 習題及試卷講評環節幫助學生通過聯想架起已知與未知的橋梁
與復習課形成知識體系不同,解題時的命題聯想應盡量快速準確的定位,過多過復雜的聯想系統反而會耽擱寶貴的時間。相當一部分學生的解題困難不在于知識點或方法的缺陷,而是想不到要用這個知識點或方法,所以在評講題目時,不能急著告訴學生先這樣再那樣,而是要告訴學生為什么要這樣做。有教師在講解比較難的題目時,會把它設計成若干個小問題,學生一個個地回答,也一步步地接近正確答案。可是下次,沒有這些小問題鋪路時,題目依然解不出。所以你應該讓學生知道,你是怎么設計這些小問題的,這才是核心和關鍵。
參考文獻:
[1]陳永明名師工作室.數學習題教學研究[M].上海:上海教育出版社,2010:18-24.
作者簡介:畢曉昀,江蘇省蘇州市,吳縣中學。

