妊娠期糖尿病SD大鼠對子代糖脂代謝的影響
王遼菊,朱麗紅,邰迎春
妊娠期糖尿病(GDM)是指妊娠期首次出現糖耐量受損或糖尿病的疾病,是產科的常見病[1]。家族中母親患有糖尿病,子代糖尿病的發病率較高。女性在妊娠期或哺乳期出現高血糖,且血糖得不到有效控制時,其后代成年后代謝疾病的發病率明顯增加[2]。GDM會使得子宮呈現高糖環境,其可能是子代成年后糖脂代謝紊亂的高危險因素。以往多是對妊娠期中后期輕度糖尿病對子代影響的研究,本研究通過建立妊娠期重度高血糖(即血糖>15 mmol/L)大鼠GDM模型,探討對子代糖脂代謝的影響,并探討其發生機制,以為GDM的防治措施研究奠定基礎。
1 材料與方法
1.1 主要儀器及試劑 鏈脲佐菌素(美國Sigma公司),人胰島素注射液(諾和諾德制藥有限公司),血糖儀(強生醫療器械有限公司),酶聯免疫吸附測定試劑盒(美國R&D公司),miRNA RT-PCR試劑盒(上海生工生物)。
1.2 構建妊娠期高血糖動物模型 選擇30只8周齡SPF級SD雌性大鼠,購自陜西中醫藥大學動物實驗中心(SCXK 2017-007),體重 200~250 g。 飼養環境:普通飼料喂養,溫度(22±1)℃,濕度 60%±5%,照明12 h。隨機平均分為觀察組與對照組。均與健康雄性SD大鼠交配,次日清晨觀察雌鼠陰道,若能觀察到陰栓,則為妊娠第0 d。在妊娠第1 d:觀察組單次腹腔注射40 mg/kg鏈脲佐菌素,構建妊娠期高血糖動物模型;對照組則腹腔注射同體積檸檬酸-檸檬酸鈉緩沖液(pH4.5)。觀察組分別于妊娠期第5、12、19 d及分娩后第7 d,4次空腹采尾尖靜脈血,血糖儀檢測血糖值,如均>15 mmol/L,則為妊娠期高血糖造模成功。
1.3 觀察指標
1.3.1 兩組子代血糖值比較 兩組分娩后,幼鼠正常喂養,分別記為子代觀察組(21只)及子代對照組(25只)。分別在分娩后7 d和喂養20 w時,進行葡萄糖耐量實驗(GTT):子代大鼠禁食16 h,并保持飲水充足,環境干燥、清潔,給予每只大鼠腹腔注射2 g/kg 的葡萄糖溶液,在注射后的第 0、30、60、90 及120 min,通過尾尖取血測量血糖值。
1.3.2 兩組子代血脂水平比較 兩組喂養至子代21 w時處死,收集血液樣本,4℃、3000 r/min離心15 min,檢測血清血脂水平,包括總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)與低密度脂蛋白膽固醇(LDL-C)。依據《血脂異常防治建議》的判定標準確定異常臨界值[3]:即 TC>5.57 mmol/L,T≥1.7 mmol/L,HDL-C<0.91 mmol/L,LDL-C>3.64 mmol/L。
1.3.3 兩組子代肝臟相關基因相對表達量比較子代大鼠處死后,迅速取出肝臟,提取RNA,采用實時熒光定量PCR法檢測過氧化物酶體增殖物激活受體(PPARα)、肉毒堿棕櫚酰基轉移酶 1α(CPT-1α)、3-羥基酰基輔酶 A 脫氫酶(Ehhadh)、長鏈酯酰輔酶 A 合成酶 3(ASL3)、miRNA-214、miRNA-130a、miRNA-181a、miRNA-34a等基因相對表達量。
1.4 統計學方法 應用SPSS22.0統計軟件分析,計量資料以±s表示,組間比較行t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組子代GTT血糖值比較 GTT結果顯示,分娩后7 d,兩組子代血糖比較無顯著差異(P>0.05);但喂養20 w時,子代觀察組的血糖水平顯著高于子代對照組(P<0.05,表 1)。
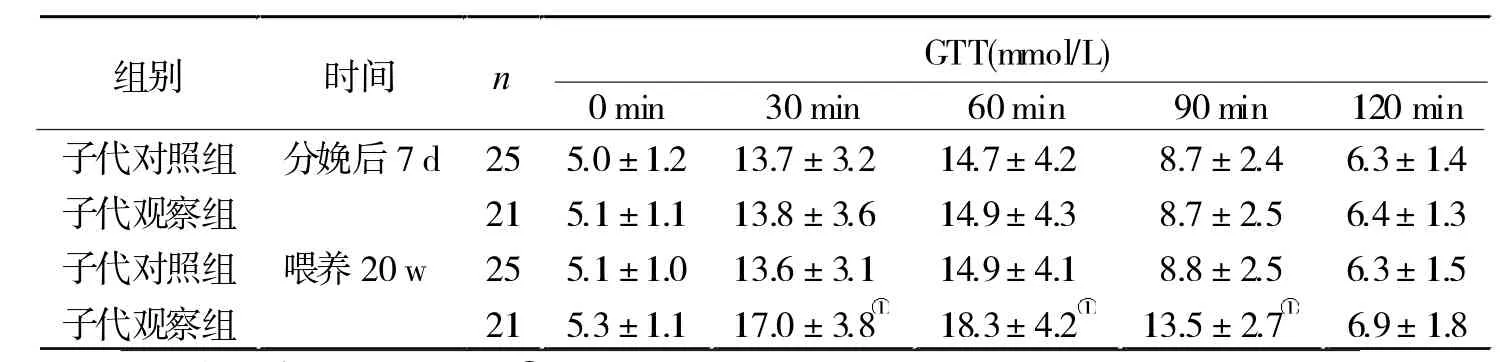
表1 兩組子代GTT全血血糖值比較
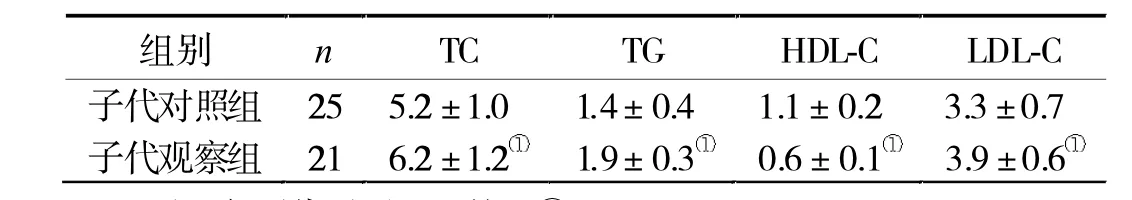
表2 兩組子代血脂水平比較(mmoI/L)

表3 兩組子代肝臟相關基因相對表達量比較
2.2 兩組子代血清血脂水平比較 喂養21 w時,子代觀察組的TC、TG和LDL-C水平顯著高于子代對照組(P<0.05),而HDL-C明顯低于子代對照組(P<0.05,表 2)。
2.3 兩組子代肝臟相關基因相對表達量比較 喂養21 w時,子代觀察組肝臟PPARα和Ehhadh相對表達量顯著高于子代對照組 (P<0.05),miRNA-130 a和ASL3明顯低于子代對照組(P<0.05),而兩組肝臟 CPT-1α、miRNA-214、miRNA-181a 及 miRNA-34a則無顯著差異(P> 0.05,表 3)。
3 討論
以往文獻多偏重于妊娠中后期輕微妊娠期糖尿病大鼠對子代的影響研究,本研究選擇妊娠期血糖>15 mmol/L的嚴重妊娠期糖尿病大鼠,探討其對子代成年大鼠糖脂代謝的影響,并從miRNA層面探討其發生機制。結果發現,兩組子代大鼠GTT血糖值在分娩后7 d無顯著差異,而在喂養20 w時,子代觀察組明顯高于子代對照組,表明妊娠期重度糖尿病可引起子代成年后血糖紊亂。而在21 w時的血清血脂水平比較,子代觀察組的TC、TG、HDL-C與LDL-C與子代對照組對比均有差異,說明妊娠期重度糖尿病引起子代成年后血脂水平異常的風險增大。
妊娠期高血糖大鼠是如何對子鼠出生及成年以后的糖脂代謝產生影響的,目前尚不清楚,本研究從肝臟相關基因表達差異上進行了探討。miRNA是單鏈非編碼小RNA,調節mRNA翻譯,抑制靶mRNA剪接或翻譯來調節靶基因的表達,對基因轉錄后調節有重要作用[4]。研究發現,miRNA-214、miRNA-130a、miRNA-181a、miRNA-34a 對 糖 代 謝 調控有重要作用,其中miRNA-130a在大鼠高糖時,其表達水平會下降。在胰島細胞中敲除miRNA-130a基因后,可對葡萄糖刺激的胰島素釋放產生抑制作用[5]。本研究結果表明,子代觀察組的miRNA-130a表達量明顯低于子代對照組,表明妊娠期糖尿病母鼠會對子代的miRNA-130a基因產生明顯影響,從而影響子代的糖代謝。
肝臟作為機體脂代謝的核心器官,對脂質的攝取、合成、分解及輸出有調控作用,其中PPARα、CPT-1α、Ehhadh、ASL3 對脂代謝調控有重要作用[6]。PPARα基因表達下調時,會降低線粒體β的氧化能力,增加脂代謝疾病的易感性[7];ASL3過表達會促進細胞攝取脂肪酸,是調控脂質合成的一個重要信號分子[8];胚胎發育早期惡劣的母體環境,子代肝臟內的Ehhadh基因出現代償性表達增加,脂肪酸β的氧化增加,降低肝內脂肪酸含量[9]。本研究發現,子代觀察組的PPARα、Ehhadh明顯高于子代對照組,ASL3明顯低于子代對照組,表明妊娠期糖尿病會影響子代的 PPARα、Ehhadh、ASL3基因水平,從而影響子代脂代謝。
綜上所述,妊娠期重度糖尿病可引起子代成年后糖脂代謝紊亂,而肝臟相關基因表達異常可能是糖脂代謝紊亂的原因,應進一步研究證實。

