氧化還原反應的配平方法
李西站
(武功縣普集高級中學 陜西咸陽 712200)
氧化還原反應的配平原則是遵循質量守恒和電子守恒,即在反應前后,各元素的原子個數相等,氧化劑得到的電子數和還原劑失去的電子數相等。氧化還原反應繁雜多樣,不同的反應用不同的方法更加高效,下面本人就不同氧化還原反應如何使用不同方法。
一、觀察法
觀察法的關鍵是觀察化學反應前后,元素原子的個數變化,根據原子守恒定律來進行配平,這個方法適用于簡單的前后反應物和生成物比較少的氧化還原反應。
舉例1配平下列反應方程式:
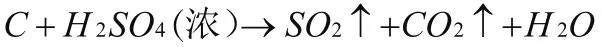

分析:首先觀察得出關鍵元素是氧,每一個 43OF e 分子反應生成鐵需要4個氧原子,因此4個氧原子會與C O反應生成4個 2C O分子,得出以下結果:
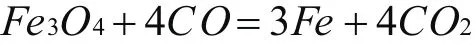
二、特殊法
1.先左后右法:先對方程式左邊的反應物進行配平,再根據質量守恒和電子守恒配平其他物質,這種方法適用于元素間的“歸一反應”。
(1)同元素間的“歸一反應”
舉例3配平下列反應方程式:
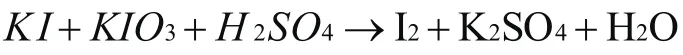
分析:通過觀察可以知道,這個反應中K IS作為還原劑,I元素由-1價到0價,升高了1價, K IO3作為氧化劑,I元素價態由5價到0價,下降了5價, I2在反應中即是氧化產物也是還原產物,根據升降相等的原則,先配平方程式的左邊,K I前添加系數5, K IO3前面添加系數1,然后根據原子守恒配平其他元素原子,得出以下結果:
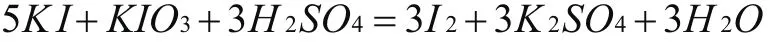
(2)不同元素間的“歸一反應”
舉例4配平下列反應方程式:
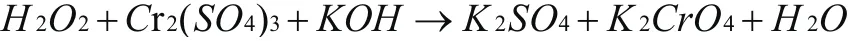
分析:通過觀察得知, 22OH 作為氧化劑,O元素價態下降了1價,作為還原劑,C r元素價態升高了3價,在反應中即是還原產物,又是氧化產物,根據升降相等的原則,先配平方程式的左邊,前面添加系數3,前面添加系數1,再根據原子守恒配平其他元素原子,得出以下結果:
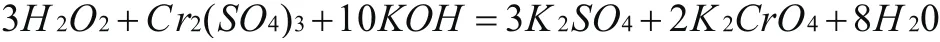
2.先右后左法:先對方程式右邊進行配平,然后根據質量守恒和電子守恒配平其他物質,這種方法適用于某些物質一部分參加氧化還原反應或歧化反應。
舉例5配平下列反應方程式:

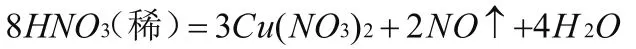
3.后配氧氣法:這個方法適用于有氧氣參與反應或生成氧氣的反應,先根據原子守恒配平除氧原子意外的其它元素,然后再將氧原子配平,將整個方程式前后系數約簡。
舉例6配平下列反應方程式:

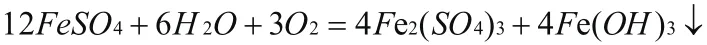
結語
高中化學對于氧化還原反應方程式的配平,可以采取很多種不同的配平方法,關鍵是哪種方法是最快速最準確的。教師在教學中,要根據于自己豐富的教學經驗,讓學生學會通過觀察氧化還原反應方程式的特點,根據不同方程式的特點采用適用的配平方法,快速準確地達到配平目的。學生通過一定程度的訓練,就可以熟練地掌握各種配平方法,達到運用自如的程度,氧化還原反應配平這一知識難點也就慢慢克服了。

