行Roux-en-Y吻合術的胃部疾病患者術后早期腸內營養不耐受的影響因素分析
賈貴清,王林,侯能易,沈小鋼,左曉飛,趙高平
(四川省人民醫院,成都610072)
外科手術是治療胃癌、胃間質瘤等胃部疾病的主要手段[1,2]。Roux-en-Y吻合術是上消化道重建的主要方式之一,尤其是胃底、體部的腫瘤需行食管-空腸吻合或胃-空腸吻合。術后早期腸內營養是目前推薦的圍手術期處理方式,是加速康復外科的重要組成部分[3]。但是,受“肛門排氣才能飲食”的傳統觀念以及術后早期腸內營養出現腹脹、腹瀉、嘔吐、反流等不適的影響,許多醫生尤其是基層醫院醫生對術后早期腸內營養持保守態度[4],即不實施術后早期腸內營養,或因沒有掌握腸內營養要點致患者營養不耐受而停止腸內營養。本研究收集161例行Roux-en-Y吻合術的胃部疾病患者的臨床資料,回顧性分析術后患者早期腸內營養不耐受的影響因素,旨在加深對術后早期腸內營養耐受與不耐受的認識,促進加速康復外科在國內的發展。
1 資料與方法
1.1 臨床資料 選擇我院2015年1月~2017年12月收治的161例行遠端胃切除或全胃切除后行Roux-en-Y吻合的胃部疾病患者,男110例、女51例,年齡43~88歲、平均62.64歲。術后均給予腸內營養。納入標準:①病種為胃底、胃體、賁門惡性腫瘤和胃間質瘤;②術后48 h內開始腸內營養,同時能耐受脂肪乳、氨基酸腸外營養。排除標準:①術后生命體征不平穩,無法行營養支持;②合并其他慢性消耗性疾病、免疫缺陷性疾病或近期服用免疫抑制劑;③合并糖尿病、甲狀腺功能亢進等代謝性疾病;④既往有復雜的腹部手術史;⑤嚴重感染、肝腎功能障礙;⑥術后營養支持期間輸入外源性血漿或人血白蛋白。本研究獲得本院醫學倫理委員會批準,患者均簽署知情同意書。
1.2 早期腸內營養方法 患者于術后24 h內按83.7 kJ/(kg·d)、24 h后按125.5 kJ/(kg·d)給予營養支持。采用佳維體或安素(雅培制藥有限公司)并逐漸增量,佳維體不稀釋直接口服或管飼,安素按28 g加100 mL溫開水稀釋后口服或管飼。根據患者術后時間和耐受程度調整腸內營養速度和總量,腸內營養能量給予不足者通過腸外營養補充,同時每天均補充適量的電解質和維生素。
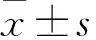
2 結果
2.1 早期腸內營養耐受情況 161例患者中,營養耐受64例,營養不耐受97例。
2.2 早期腸內營養不耐受的影響因素分析結果 營養耐受與不耐受患者的手術方式、手術保留賁門、術后第1天下床活動、營養制劑預熱、放置鼻腸營養管、術后營養開始時間比較差異均有統計學意義(P<0.05或<0.01)。見表1、2。將上述有統計學意義的指標納入多因素分析,結果顯示,手術保留賁門、放置鼻腸營養管、營養制劑加熱、術后48 h開始腸內營養是Roux-en-Y吻合術后早期腸內營養耐受的影響因素(P<0.05或<0.01)。見表3。
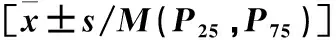
表1 Roux-en-Y吻合術后早期腸內營養耐受與不耐受患者的臨床資料(計量資料)比較
3 討論
對手術患者來說,營養是良好預后的基本保證,機體對營養支持的耐受性直接影響預后營養指標恢復和患者康復。術后早期腸內營養符合人體的生理功能,在腹腔或消化道手術后能為機體提供部分能量代謝,而在非腹腔和非消化道手術后,早期腸內營養甚至能滿足整個機體的能量需求[5]。Patkova等[6,7]認為,早期腸內營養能夠刺激胃腸道相關激素分泌,改善消化道黏膜保護屏障,降低細菌移位及菌群失調現象的發生率,促進胃腸道功能恢復,降低患者病死率。2016年美國腸外腸內營養會和危重病學會聯合發表了《成人營養支持療法與評定指南》,指出對需要營養支持治療的患者首選腸內營養,每日監測腸內營養耐受性,根據耐受性調整供給方式和供給量,避免不恰當的終止腸內營養,從而加快營養障礙者機體營養恢復[8]。Roux-en-Y吻合術后食物儲存主要依靠小殘胃或小腸儲袋以及兩個吻合口之間的小腸腸段,而食物消化和營養吸收則在空腸-空腸吻合口以下腸段內進行,與正常生理狀態相比,Roux-en-Y吻合術后食物儲存空間變小、營養吸收的腸管變短,加上術后營養需求增加,因此探討術后腸內營養耐受的有利因素并應用于臨床具有重要意義。

表2 Roux-en-Y吻合術后早期腸內營養耐受與不耐受患者的臨床資料(計數資料)比較[例(%)]
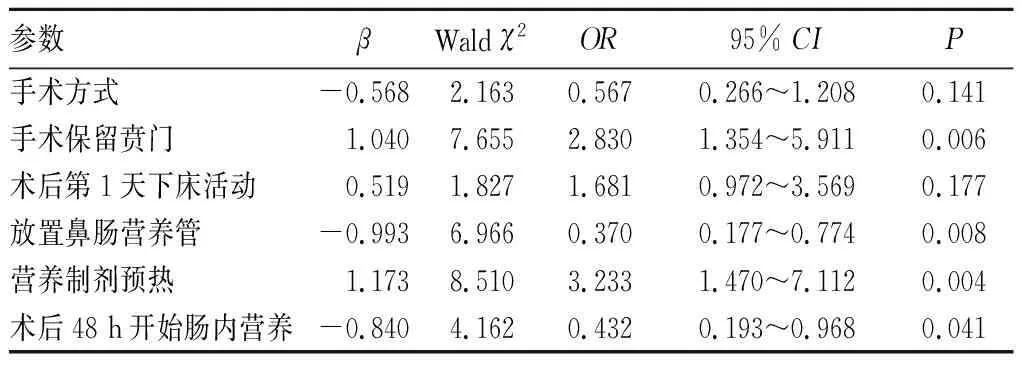
表3 Roux-en-Y吻合術后早期腸內營養不耐受的多因素分析結果
本研究結果顯示,營養耐受與不耐受患者在手術方式和術后第1天下床活動方面比較有統計學差異,采取傳統開腹手術者營養不耐受的發生率較腹腔鏡手術者升高,術后第1天下床活動營養不耐受者比例亦高。但經Logistic回歸分析發現,手術方式和術后第1天下床活動不是腸內營養耐受的影響因素,說明兩者不會獨立或直接影響營養吸收的耐受性。結合臨床分析其原因可能為傳統開腹手術切口長、創面大,術后疼痛明顯,患者不愿意活動和主動進食,增加反流和誤吸風險,延緩了胃腸功能恢復時間,增加了營養不耐受性。翁延宏等[9]記錄術后第1天下床活動量大于4 h的患者并行Logistic回歸分析,結果顯示術后第1天下床活動大于4 h是營養耐受的有利因素。本研究結果與其不一致,原因可能為營養耐受與下床活動持續時間及活動強度有關,本研究僅對下床與否作了統計分析,無法獲得術后第1天下床活動總量和活動強度,對結果產生一定的偏倚。本研究顯示,手術保留賁門、放置鼻腸營養管、營養制劑預熱以及術后48 h開始腸內營養的耐受性比例高,與營養不耐受者比較有統計學差異,經Logistic回歸分析顯示,以上因素均是影響早期營養耐受的獨立因素。保留賁門是早期營養耐受的獨立影響因素,其原因可能與賁門的解剖結構與生理功能有關。賁門由食管下括約肌向下延續,生理狀態下呈閉合狀態,一定程度上防止了食物反流、嘔吐和誤吸,細小的鼻腸管置入也不會影響賁門的生理功能。鼻腸管的置入通常在關腹前,將管尖端置入腸-腸吻合口以遠約40 cm處,若術后不慎脫落,也可以選擇半自動超聲定位引導放置[10],有效避免胃腸穿孔等并發癥。我們的另一研究也證實,鼻腸管腸內營養可促進蛋白合成和機體康復,不會增加70歲以下患者的肺部感染率,也不會增加誤吸、嘔吐等營養不耐受風險[11]。Grooten等[12]報道,管飼可增加腸內營養的耐受性,尤其是對嘔吐患者。早期腸內營養耐受與否跟營養制劑類型選擇無關,但跟營養制劑是否預熱有關。Freedman等[13]認為,適宜的溫度能夠快速激活消化酶,減少食物潴留,促進營養吸收,降低營養不耐受風險,尤其對外分泌功能不全者顯得更為重要。本研究結果顯示,術后48 h開始腸內營養是營養耐受的獨立影響因素。術后早期胃腸分泌、消化和吸收微弱,故適當延緩腸內營養時間可降低腹痛、腹脹等癥狀的發生率,提高營養耐受性,促進機體康復,術后48 h開始腸內營養應該是最適宜的時間點。
綜上所述,對于行Roux-en-Y吻合術胃部疾病的患者,放置營養管、術后48 h開始腸內營養并預熱制劑可提高營養耐受性,促進術后患者康復。對出現輕度營養不耐受患者,可適當減緩腸內營養供給速度,不應該減少供給量甚至停止,以免增加腸外營養導致的導管相關性感染、肝腎功能障礙,以及延長住院和康復時間,甚至增加病死率的風險[14]。

