急性胰腺炎患者尿液蛋白質組學分析
楊妮,白鄭海,邱曉娟,楊寧,張麗,武苗苗,裴紅紅,張正良
(西安交通大學第二附屬醫院,西安710000)
急性胰腺炎(AP)是因胰蛋白酶消化自身胰腺組織而引起的嚴重的急性腹部病癥。大多數AP患者病癥較輕,并無并發癥發生,然而約有20%的患者伴有炎癥反應、繼發感染等多種并發癥,且癥狀較重,病死率較高[1]。目前對于AP的診斷主要通過測定血清淀粉酶、尿胰蛋白酶原-2、降鈣素原、IL-6等,但不同的檢測標志物均存在患者適用、診斷試劑等不同的條件限制[2~4]。尋找更為有效的生物標志物對AP的早期診斷和預后具有重要意義。蛋白質組學技術是從蛋白質整體水平探討正常與病理條件下蛋白譜表達差異,為尋找各種疾病早期特異性生物標志物提供了基礎[5]。本研究采用非標記質譜定量蛋白質組學技術分析AP患者與正常人尿液中蛋白譜表達差異,為篩選AP生物標志物提供理論依據。
1 資料與方法
1.1 臨床資料 選取2017年1~3月我院收治的AP患者15例(AP組),男8例、女7例,年齡27~79(50.5±15.0)歲,體質量(63.9±7.8)kg,肌酐(66.3±18.3)μmol/L,尿素氮(4.5±2.1)mmol/L。均符合AP診治指南(2014版)診斷標準[6],無其他嚴重并發癥。排除住院期間死亡及合并其他嚴重疾病者。對照組為15例查體健康者,男8例、女7例,年齡25~77(48.6±17.0)歲,體質量(61.7±11.3)kg。本研究經由西安交通大學附屬醫院倫理委員會批準,患者均簽署知情同意書。
1.2 主要儀器與試劑 垂直電泳儀(英國GE-Healthcare公司);Q-Exactive質譜儀(美國Thermo Finnigan公司);EASY-nLC1000液相色譜(美國Thermo Finnigan公司)。
1.3 樣品收集與總蛋白質提取 收集受試者入院時的尿液樣本,AP組與對照組各隨機分為3個小組,每小組5例樣本混合成為一份標本,離心取上清,3 kD超濾管超濾濃縮。采用100 mmo/L碳酸氫銨溶液清洗3次,離心濃縮至200 μL,加入100 μL SDT裂解液,沸水浴15 min后,超聲處理。采用BCA法測定蛋白質濃度。
1.4 蛋白質質量檢測 每組樣品各取10 μL,按體積比5∶1加入5×上樣緩沖液,沸水浴5 min,14 000 g離心10 min,取上清,進行SDS-聚丙烯酰胺凝膠(SDS-PAGE)電泳分析。電泳分離后進行考馬斯亮藍染色、脫色,分析蛋白條帶,檢測所提取蛋白樣品的質量。
1.5 差異表達蛋白的篩選與鑒定 采用液相色譜串聯質譜(LC-MS/MS)和生物信息學分析法。通過超濾、FASP酶解、萃取、離心、脫鹽、HPLC分離等步驟,采用Q-Exactive系統進行質譜分析。將LC-MS/MS原始文件導入Maxquant軟件進行數據庫搜索,數據庫為uniprot_homo sapiens_181611_20170713.fasta。所得文件采用Perseus1.3.0.4軟件進行分析,采用IBAQ算法進行定量分析,蛋白定性篩選標準為錯誤發現率(FDR)<0.01。組間蛋白差異采用t檢驗,以>2或<0.5差異倍數為差異表達蛋白。數據分析采用SPSS16.0統計軟件。差異蛋白質通過GO數據庫(David 6.7和QuickGO)進行GO功能注釋分析,用KEGG軟件進行通路分析,用perseus軟件進行聚類分析。選取上步篩選出的差異表達蛋白,采用Western blotting法測量其在AP組和對照組中的表達情況,驗證蛋白質組學分析結果。
2 結果
2.1 兩組差異表達蛋白篩選結果 共發現334個蛋白質,其中57個蛋白存在差異表達,AP組有28個蛋白表達上調,29個蛋白表達下調(表1、2);另外有9個蛋白只在AP組表達,73個蛋白只在對照組表達(表3、4)。

表1 AP組中發生上調的蛋白表達譜(前10位)
2.2 差異表達蛋白的功能活性分析結果
2.2.1 GO功能分析 將差異蛋白進行GO功能分析,結果顯示差異蛋白所參與生物學過程主要為對刺激的應答、免疫、代謝以及其他細胞生物學過程的調控等,分子功能則以結合與催化活性為主,而差異蛋白質細胞組分分析主要定位于細胞膜、細胞器以及細胞外區域。
2.2.2 KEGG通路分析 將差異蛋白進行KEGG通路分析,共發現9個有統計學意義的代謝通路,分別是細胞黏著緊密連接通路、溶酶體激活通路、細胞凋亡通路、細胞外基質受體互作通路、補體及凝血級聯反應通路、白細胞跨內皮遷移通路、系統性紅斑狼瘡通路、神經膠質瘤通路、心律失常性心肌病等相關通路。

表2 AP組中發生下調的蛋白表達譜(前10位)

表3 只在AP組表達的蛋白

表4 只在對照組表達的蛋白(前10位)
2.3 顯著差異蛋白的篩選與鑒定結果 根據蛋白表達差異倍數及GO、KEGG分析結果,發現糖蛋白CD59、免疫球蛋白重鏈IGHA2被富集在差異最顯著的類別(細胞膜、細胞器、細胞外區域以及結合活性)。經Western blotting檢測,AP組尿液中CD59蛋白表達較對照組升高,IGHA2蛋白表達較對照組降低(P均<0.05)。見表5。
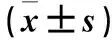
表5 AP組與對照組尿液中CD59、IGHA2蛋白表達水平比較
注:與對照組比較,*P均<0.05。
3 討論
AP的發病機制涉及胰腺自身消化、炎癥介質、腸道細菌易位、細胞凋亡等許多過程。病變過程中,機體免疫系統以及各類細胞因子均參與反應,各類因子及中間介質在血液、尿液等體液中的含量也會發生變化[7~9]。因此,這些蛋白因子的水平變化或可為尋找更為有效的AP生物標志物帶來新的方向[10~13]。本研究采用非標記質譜定量蛋白質組學技術分析AP患者與正常人尿液中蛋白譜表達差異,結果顯示,糖蛋白CD59、免疫球蛋白重鏈IGHA2被富集在差異最顯著的類別,這兩種蛋白有望成為AP的特異性生物標志物。
CD59是位于細胞表面的糖蛋白,可通過糖基磷脂酰肌醇(GPI)結合于細胞膜,在各類造血細胞、組織細胞、胎盤等多種類型細胞表面均有存在,并廣泛游離分布于唾液、尿液、淚液等體液中。已知CD59的功能多樣,其主要功能與補體活化的調節有關[14]。CD59作為一種膜結合補體調節蛋白,可在補體級聯反應的末段,與補體攻膜復合物中的C8和C9相互作用而結合,阻止補體攻膜復合物的形成,從而抑制補體的活化過程。此外,CD59蛋白也參與T細胞黏附、信號轉導等過程的調控[14]。本研究發現,CD59蛋白在AP患者尿液中的表達水平高于正常對照者。Lindstr?m等[15,16]報道,在重癥AP患者的血清中,補體調節蛋白CD59水平明顯上升,表明CD59水平增高可能與AP的發生存在正向關系。此外,CD59蛋白被發現在多種病理條件下均呈現出高水平表達趨勢。已有研究發現,在膀胱癌基質細胞、卵巢癌、前列腺癌、淋巴瘤等病變組織中均能檢測到CD59蛋白高表達,其可能參與腫瘤形成過程中逃避補體攻擊及炎癥反應的作用[14,16]。
補體是機體內重要的免疫調節及防御機制,可介導機體免疫防御反應,也可發揮溶解細胞作用,殺傷病損細胞,是體內重要的效應放大系統[17]。本研究結果顯示,AP患者尿液中差異表達的蛋白質也參與補體及凝血級聯反應通路,說明補體系統在AP發病過程中扮演著重要作用。因此,AP患者尿液中CD59蛋白水平的升高或與患者體內補體防御機制的受損有關。
機體免疫功能的改變也與AP的發生密切相關。本研究發現,免疫球蛋白重鏈在AP患者尿液中的表達水平較正常對照者下降。已有研究證實,AP的預后以及其他并發癥的發生、病情的轉歸等均與免疫功能變化有關[11]。單核細胞、T淋巴細胞以及多種白介素等均參與胰腺炎的病理學過程,其中炎癥介質IL-6被證明為AP診斷的有效因子之一,可在AP患者入院12~24 h內檢出,且在重癥AP患者中具有較高的敏感性及特異性[2]。而免疫球蛋白在細胞膜、細胞器、細胞外區域以及結合活性等方面均存在作用,其表達水平的變化對急性炎癥疾病的發生具有重要作用。因此推測,免疫球蛋白重鏈或可作為AP的潛在生物標志物,以反映胰腺炎患者免疫功能的改變。
此外,本研究發現在AP患者與正常人群的尿液中存在較大的蛋白表達差異,有數十種蛋白發生顯著的表達上調或下調,也有許多蛋白只在正常人群或AP患者尿液中出現,例如胰分泌性胰蛋白酶抑制子SPINK1、泌乳素誘導蛋白PIP、凝血因子Ⅹ、補體相關因子CFHR2/CFD、以及載脂蛋白D、磷酸肌醇3激酶、谷氨酰胺酰肽環轉移酶、谷氨酰氨基肽酶、羧肽酶、絲氨酸/蘇氨酸蛋白磷酸酶、脫氧核糖核酸酶、絨毛膜促性腺激素、胸腺素等與糖/脂/蛋白質代謝、激素分泌等相關的蛋白物質。這些差異表達的蛋白主要定位于細胞膜、細胞器以及細胞外區域,參與了細胞連接、細胞凋亡、細胞外基質調控、補體及凝血級聯反應、細胞粘連/遷移、溶酶體激活等細胞學過程的調控,在AP病變過程中發揮著基礎的級聯和促進作用,是病變發生的主要分子基礎。對這些差異表達蛋白功能的深入研究有助于探明AP的發病機制、尋找合理的診斷和治療手段。
綜上所述,AP患者與健康人的尿液蛋白質譜存在差異,糖蛋白CD59、免疫球蛋白重鏈IGHA2可能作為AP的特異性生物標志物。本研究也證實,采用非標記定量蛋白質組學技術尋找AP的潛在生物標志物是有效和可行的,通過蛋白質組學分析,為進一步探索AP診斷標記物提供了方向。

