維拉帕米對膿毒癥大鼠心肌細胞自噬水平的影響
姜琳,楊國輝
(貴州醫科大學,貴陽550004)
膿毒癥是感染所致全身炎癥反應,可導致嚴重器官功能障礙。心臟是膿毒癥最易受損器官之一,內毒素脂多糖、細胞因子、氧自由基等通過多種途徑損傷心肌,可致膿毒性心肌病[1]。自噬作為一種細胞死亡方式已成為目前研究的熱點。在膿毒癥動物模型中觀察到自噬體和自噬相關基因產物增加,自噬通過吞噬并降解病原微生物,與免疫反應共同保護機體[2]。2016年6月~2017年12月,我們通過觀察膿毒癥大鼠心肌微管相關蛋白1輕鏈3(LC3)、自噬相關蛋白Beclin-1、B淋巴細胞瘤-2(Bcl-2)表達的變化,并給予鈣通道阻滯劑維拉帕米干預,探討維拉帕米對膿毒癥的心肌保護作用,為膿毒性心肌病的治療提供新思路。
1 材料與方法
1.1 動物與試劑 SPF級健康雄性SD大鼠54只,體質量(200±20)g,由貴州醫科大學實驗動物中心提供。鹽酸維拉帕米注射液(上海禾豐公司),兔源Beclin-1單克隆抗體、兔源LC3多克隆抗體、兔源Bcl-2單克隆抗體(Abcam公司),兔源β-actin單克隆抗體(博奧森公司),辣根酶標記抗山羊IgG(北京中杉金橋生物技術有限公司),BCA蛋白濃度測定試劑盒(江蘇碧云天生物技術研究所),高靈敏化學發光檢測試劑盒(默克密理博公司)。
1.2 動物分組與模型制備 將大鼠隨機分為對照組、模型組、干預組各18只。模型組和干預組采用盲腸結扎穿孔術[3]制備膿毒癥模型。術前禁食12 h,自由飲水。采用2%戊巴比妥鈉10 mL/kg腹腔注射麻醉,腹正中切口;于盲腸盲端1/3處結扎,使用20 G套管針將盲腸貫通穿孔,輕輕擠出少許糞便;將盲腸還納腹腔,逐層縫合腹壁切口。對照組麻醉后行下腹正中切口,取出盲腸不結扎穿孔仍放回腹腔。三組術后均給予生理鹽水30 mL/kg腹腔注射,干預組另給予鹽酸維拉帕米注射液5 mg/kg腹腔注射。待大鼠完全蘇醒后送回飼養室正常飼養。
1.3 標本采集 三組分別于術后6、12、24 h各處死6只大鼠。取出心臟,生理鹽水洗凈,去除大血管及結締組織,取心肌組織用于組織形態學檢查和相關分子生物學檢測。
1.4 血清肌鈣蛋白T(cTnT)、肌酸激酶同工酶(CK-MB)檢測 大鼠腹腔注射戊巴比妥鈉10 mL/kg麻醉,暴露心臟,取心臟血5 mL,移至1.5 mL EP管中。離心,取上層血清,采用酶聯免疫吸附法檢測cTnT、CK-MB水平,按照試劑盒說明書進行操作。
1.5 心肌組織形態學檢查 取大鼠心臟,用生理鹽水洗凈,去除大血管及結締組織,取0.5 mm3心肌組織投入預先配好的固定液中(10%甲醛),固定成功后放入包埋盒中,流水沖洗(去除組織中的固定液)30 min,梯度乙醇脫水,再將組織塊置于透明劑二甲苯中,以二甲苯替換出組織塊中的乙醇。將已透明的組織塊置于石蠟中包埋,切片機將蠟塊切成薄片,厚約5 μm,于水中攤平,貼到載玻片上,放入45 ℃恒溫箱中烘干。二甲苯脫蠟,再經由高濃度到低濃度乙醇,最后入蒸餾水,蘇木精伊紅染色后置于光鏡下觀察。
1.6 心肌組織LC3、Beclin-1、Bcl-2蛋白表達檢測 采用Western blotting法。使用蛋白提取試劑盒提取心肌組織總蛋白,BCA法測定蛋白濃度。取蛋白上樣液進行SDS-PAGE凝膠電泳,濕轉法將蛋白轉移至PVDF膜上。5%脫脂奶室溫封閉2 h,TBST洗膜。分別加入LC3(1∶2 000)、Beclin-1(1∶2 000)、Bcl-2(1∶5 000)及β-actin(1∶2 000)一抗,4 ℃孵育過夜。次日TBST洗膜后加入辣根過氧化物酶標記的相應IgG二抗(1∶5 000),室溫孵育50 min。ECL化學發光顯色,凝膠成像分析系統檢測條帶,Image J軟件測出目的條帶的灰度值,并與內參條帶的灰度值比較,計算目的蛋白的相對表達量。
1.7 心肌組織LC3、Beclin-1、Bcl-2 mRNA表達檢測 采用qRT-PCR法。TRIzol法提取大鼠心肌組織總RNA,測定濃度及純度后按照試劑盒說明逆轉錄為cDNA,然后進行實時熒光定量PCR。引物序列:LC3上游引物5′-ATTGCTGTCCCGAATGTCTC-3′,下游引物5′-TTCTTCCTCCTGGTGAATGG-3′;Beclin-1上游引物5′-TATAGCAAAGAGCCCTGCCG-3′,下游引物5′-AACTGTGTGCCACAAGCATC-3′;Bcl-2上游引物5′-ACAGAGGGGCTACGAGTGGG-3′,下游引物5′-CGTTCGGTTGCTCTCAGGC-3′;β-actin上游引物5′-CACCCGCGAGTACAACCTTC-3′,下游引物5′-CCCATACCCACCATCACACC-3′。反應體系(25 μL):SYBR?Premix Ex TaqⅡ 12.5 μL,上、下游引物各1.0 μL,cDNA模2.0 μL,dH2O 8.5 μL。反應條件:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,共40個循環。反應結束后讀取各樣本的Ct值,應用2-ΔΔCt法計算目的基因的相對表達量。
1.8 統計學方法 采用SPSS17.0統計軟件。計量資料以x±s表示,組間均數比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 三組血清cTnT、CK-MB水平比較 見表1。
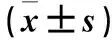
表1 三組血清cTnT、CK-MB水平比較
注:與對照組相同時間比較,aP<0.05;與模型組相同時間比較,bP<0.05;與同組6 h比較,cP<0.05;與同組12 h比較,dP<0.05。
2.2 三組心肌組織形態學比較 對照組心肌細胞排列整齊,間質無明顯增生,心肌細胞無明顯肥大等表現;模型組心肌細胞排列紊亂,明顯肥大,胞質豐富,可見血管擴張和血管壁增厚;干預組心肌細胞排列紊亂、肥大程度較模型組減輕。
2.3 各組心肌組織LC3、Beclin-1、Bcl-2蛋白表達比較 見表2。
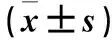
表2 各組心肌組織LC3、Beclin-1、Bcl-2蛋白表達比較
注:與對照組相同時間比較,aP<0.05;與模型組相同時間比較,bP<0.01;與同組6 h比較,cP<0.05;與同組12 h比較,dP<0.05。
2.4 各組心肌組織LC3、Beclin-1、Bcl-2 mRNA表達比較 見表3。
3 討論
膿毒癥病情進展迅速,臨床治療效果差,病死率高。研究表明,約50%的膿毒癥患者可出現心臟功能障礙,伴有心臟功能障礙患者的病死率達70%,而不伴心臟功能障礙患者的病死率為20%[4]。膿毒癥心肌損傷的機制包括內皮素1升高、線粒體受損、炎癥因子對心肌的損傷、前列環素升高、缺血再灌注和氧自由基損傷、細胞鈣超載等[5]。cTnT、CK-MB是檢測心肌細胞受損的可靠指標,二者升高提示病情進行性加重,可能存在心臟功能障礙和預后不良[6]。本研究結果顯示,模型組6、12、24 h時血清CK-MB、cTnT均較對照組升高,模型組血清CK-MB、cTnT隨時間延長逐漸增高,干預組血清CK-MB、cTnT均較模型組降低。上述結果提示膿毒癥大鼠心肌細胞損傷,予維拉帕米干預后可保護心肌細胞,減輕心肌損傷。
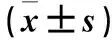
表3 各組心肌組織LC3、Beclin-1、Bcl-2 mRNA表達比較
注:與對照組相同時間比較,aP<0.05;與模型組相同時間比較,bP<0.01;與同組6 h比較,cP<0.05;與同組12 h比較,dP<0.05。
自噬是指在應激條件下,如饑餓、營養缺乏、微生物入侵等,在自噬基因ATG調控下,可發生適應性細胞自噬現象,以維持細胞結構、功能和代謝的需要,維持細胞正常的生理功能。自噬包括誘導、自噬體形成、自噬溶酶體形成、降解和降解物質的循環再利用四個環節[7]。自噬體標記蛋白LC3貫穿自噬體形成的過程。LC3是自噬體膜上的標記蛋白,參與吞噬泡的形成,貫穿自噬體形成的始終。細胞內存在LC3-Ⅰ和LC3-Ⅱ兩種形式,自噬過程中,一部分LC3-Ⅰ轉變成LC3-Ⅱ,而LC3蛋白在細胞內總的表達水平無明顯上調,即自噬表現為LC3-Ⅰ減少和LC3-Ⅱ增加,通過LC3-Ⅱ/LC3-Ⅰ或LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)即可反映自噬水平[8]。Beclin-1是與酵母Apg6/Vps30同源基因,可通過結構域結合于自噬體細胞膜上,在自噬中的作用主要調節自噬體膜的延伸過程,成為檢測自噬的指標之一,研究發現,抗凋亡蛋白Bcl-2能通過疏水凹槽與Beclin-1結合,從而抑制Beclin-1及其復合體誘導自噬的功能[9]。
隨著對自噬的深入研究,自噬在炎癥、感染等病理生理過程的積極作用逐漸被重視,自噬為膿毒癥相關的器官功能障礙的防治提供了新的方向。Hsieh等[10]報道,小鼠盲腸結扎穿孔術后8 h即可出現自噬相關蛋白LC3、Beclin-1升高,隨著病程進展,自噬泡數量增加而自噬溶酶體數量較少;提示自噬在膿毒癥早期即被激活,隨著膿毒癥小鼠體內大量促炎性因子釋放,中和微生物毒素、控制細胞因子釋放等作用下,從而抑制自噬水平,自噬溶酶體形成障礙,使得膿毒癥過程中自噬沒有發揮有效保護作用,從而導致臟器損傷。Tong等[11,12]報道,大鼠缺血缺氧心肌組織自噬激活后,自噬相關蛋白LC3、Beclin-1較對照組增高,Bcl-2較對照組降低,誘導自噬過程完整后可對心肌起到保護作用。
自噬是由內質網應激引發,并由內質網鈣離子含量和釋放調節,膿毒癥時細胞鈣通道失衡、鈣超載從而激活自噬。自噬的發生及調節機制相當復雜,通過對自噬水平調控的研究,可使自噬在疾病過程中發揮積極保護作用。細胞內鈣離子是調控自噬的重要因素,維拉帕米為鈣通道阻滯劑,抑制鈣離子內流,而鈣離子對激活自噬具有積極作用[13,14]。鈣離子濃度增加可促進自噬相關基因5增加和自噬過程中細胞信號調控相關的腺苷酸活化蛋白激酶表達,從而上調細胞自噬水平[15]。
本研究結果顯示,與對照組比較,模型組心肌細胞明顯肥大,排列紊亂,模型組6、12、24 h時血清CK-MB、cTnT均較對照組升高,LC3、Beclin-1蛋白及mRNA表達較對照組升高,Bcl-2蛋白及mRNA表達較對照組降低;模型組血清CK-MB、cTnT隨時間延長逐漸增高,LC3、Beclin-1蛋白及mRNA隨時間延長逐漸升高,Bcl-2蛋白及mRNA隨時間延長逐漸下降。提示膿毒癥時心肌細胞鈣通道失衡、鈣超載及微生物入侵等因素心肌細胞受損并激活自噬,在24 h內隨時間延長自噬逐漸增強。與模型組比較,干預組心肌組織排列紊亂、心肌細胞肥大嚴重程度較輕,干預組12、24 h時LC3較模型組降低,6、12、24 h時Beclin-1蛋白及mRNA表達較模型組降低,Bcl-2蛋白及mRNA表達較模型組升高,血清CK-MB、cTnT均較模型組降低。表明膿毒癥大鼠心肌細胞出現鈣通道失衡,激活自噬,給予維拉帕米拮抗鈣超載后,可抑制自噬,保護心肌細胞。
綜上所述,膿毒癥大鼠心肌組織自噬早期可被激活,并在24 h內逐漸增強;通過維拉帕米調控細胞內鈣離子從而調節自噬水平后,可有效抑制自噬,進一步保護心肌。

