急性潰瘍性結腸炎小鼠結腸組織中SHP2的表達及其作用探討
譚婉燕,楊旭輝
(華中科技大學同濟醫學院附屬梨園醫院,武漢430077)
潰瘍性結腸炎(UC)是一類病因不明、癌變風險較高的非可控性炎癥性疾病,具有病程長、病變程度輕重不一、反復發作、治愈難度大等特點[1]。尋找有效的治療靶點對改善UC的臨床療效具有重要意義。含Src同源區2蛋白質酪氨酸磷酸酶2(SHP2)是一種由PTPN11基因編碼的非受體型蛋白質酪氨酸磷酸酶,作為蛋白酪氨酸磷酸酶家族的一員,其通過多條信號傳導通路參與細胞的生長、分化、遷移、黏附及凋亡等重要生命活動[2]。SHP2廣泛表達于各種細胞和組織中,與腦膠質瘤、大腸癌、乳腺癌和宮頸癌等多種惡性腫瘤的發生發展關系密切[3],但SHP2在UC中的作用目前仍不清楚。炎癥性腸病的發生發展與炎性因子的過度表達有關,其中環氧合酶2(COX-2)、白細胞介素6(IL-6)和腫瘤壞死因子α(TNF-α)是UC中研究較多的炎性因子。P65和信號傳導與轉錄活化因子3(STAT3)信號通路與UC的發生發展密切相關,它們通過調控相關炎性因子的釋放,參與腸道的炎癥反應[4,5]。Ki67作為一種在細胞增殖中不可缺少的核抗原,其表達水平可反映細胞增殖速度[6,7]。2017年1~12月,我們通過建立小鼠UC模型,觀察結腸組織中SHP2的表達情況,并通過構建腺病毒SHP2突變載體下調SHP2表達,觀察血清炎性因子COX-2、IL-6、TNF-α及結腸組織中NF-κB/STAT3信號通路蛋白的變化,探討SHP2在UC發病中的作用。
1 材料與方法
1.1 動物、試劑與儀器 SPF級健康雄性BALB/c小鼠30只,4~6周齡,體質量19~21 g,由華中科技大學同濟醫學院實驗動物中心提供。主要試劑:葡聚糖硫酸鈉(DSS, MW40000,MPBio,美國),腺病毒稀釋液(Sigma-Aldrich,美國),小鼠COX-2、IL-6、TNF-α酶聯免疫吸附測定試劑盒(武漢伊萊瑞特生物科技有限公司,中國),兔源多克隆GAPDH抗體(杭州賢至生物有限公司,中國),兔源多克隆抗體SHP2(武漢三鷹生物技術有限公司,中國),兔源多克隆抗體p-P65(CST,美國),兔源單克隆抗體p-STAT3(CST,美國),Ki67抗體(Abcam,美國),辣根過氧化物酶標記的羊抗兔二抗(武漢博士德生物工程有限公司,中國)。腺病毒突變載體pAd-pG1.2-mus-shp2-2的構建委托賽業生物科技有限公司設計。主要儀器:低溫離心機(Thermo scientific,美國),全自動酶標儀(Thermo scientific,美國),電熱恒溫培養箱(ASONE,日本),電泳儀(Bio-Rad,美國),Chemi Doc MP全能型凝膠成像分析系統(Bio-Rad,美國)。
1.2 急性UC模型制作 將30只小鼠隨機分為正常組、模型組和SHP2組,每組各10只。模型組和SHP2組給予4% DSS溶液飲用7 d制作急性UC模型[8],正常組飲用高壓過的飲用水。當小鼠出現不同程度的進食及進飲減少、體質量下降、腹瀉、血便、肛周毛發凌亂、肛口稀血便黏附時,表明造模成功。繼續飼養20 d。
1.3 腺病毒轉染 于造模第1天分別向正常組、模型組和SHP2組腹腔注射100 μL腺病毒稀釋液、腺病毒空載體和腺病毒SHP2突變載體。造模第8天取5只小鼠處死,取結腸組織,采用Western blotting法檢測SHP2蛋白表達,以驗證腺病毒在小鼠腸道組織的轉染效率,以轉染效率≥70%為轉染合格。
1.4 腸道臨床炎癥嚴重程度評估 飼養期間每天測量小鼠體質量,檢查肛周,記錄排便情況。采用疾病活動指數(DAI)評分量表[8]對腹瀉、便血、體質量改變情況進行評分。
1.5 組織病理學檢查 飼養至20 d處死剩余15只小鼠,取結腸組織,制作病理切片,采用HE染色觀察組織形態學變化,按照組織學評分標準[1]進行評分。采用阿爾新藍染色檢測組織中杯狀細胞數量,根據杯狀細胞數量評價結腸黏膜屏障功能。
1.6 血清COX-2、IL-6、TNF-α檢測 采用ELISA法。小鼠處死后,收集心臟血,離心取上清,采用小鼠PTGS2/COX-2、IL-6、TNF-α ELISA試劑盒檢測血清COX-2、IL-6、TNF-α水平,具體操作按照試劑盒說明書進行。
1.7 結腸組織中p-P65、p-STAT3表達檢測 采用Western blotting法。取少量結腸組織置于勻漿器中剪碎,加入細胞裂解液,提取總蛋白,應用BCA試劑盒檢測蛋白濃度。配制10%分離膠和5%濃縮膠,電泳轉膜,5%脫脂牛奶封閉,結合兔抗鼠GAPDH(1∶1 000稀釋)、p-P65(1∶1 000稀釋)和p-STAT3(1∶2 000稀釋)抗體,孵育結束后洗膜。再滴加羊抗兔二抗,室溫搖床孵育1 h。洗滌后將PVDF膜置于ChemiDoc MP全能型凝膠成像分析系統儀器中掃膜,用Image Lab軟件處理圖像,Image J軟件計算各條帶的灰度值,以目標條帶與對應內參條帶灰度值的比值表示目標蛋白的相對表達量。
1.8 結腸組織中Ki67表達檢測 采用免疫組化染色法。取組織切片常規脫蠟至水,3% H2O2去離子水孵育10~30 min,以滅活內源性過氧化物酶活性。山羊血清封閉15~30 min,加入Ki67一抗(1∶100稀釋),37 ℃孵育2~3 h,次日滴加HRP標記的二抗室溫孵育30 min,DAB顯色,蘇木素復染,逐級脫水、透明、中性樹膠封片。根據每個高倍鏡視野中陽性細胞所占百分比評分:陽性細胞≤5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,≥76%為4分;根據染色強度評分:無染色為0分,弱染色為1分,中等染色為2分,強染色為3分;兩項評分相乘得出最終評分。
1.9 統計學方法 運用GraphPad Prism 6軟件進行繪圖和統計分析,組間兩兩比較采用LSD-t檢驗,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 三組DAI評分比較 見圖1。從第13天開始,SHP2組DAI評分低于模型組(P均<0.01)。

圖1 各組DAI評分比較
注:與SHP2組比較,*P<0.01。
2.2 三組組織病理學檢查結果 正常組結腸黏膜基本完整,腺體排列整齊、結構層次清晰,無明顯炎性細胞浸潤;模型組結腸黏膜破損嚴重,腺體減少、排列紊亂,以淋巴細胞為主的炎性細胞的大量浸潤,淋巴濾泡增生;SHP2組結腸炎癥相對較輕,黏膜基本完整,腺體結構清晰,炎細胞浸潤相對較少。模型組和SHP2組的組織病理學評分分別為(15.33±1.53)、(10.67±2.08)分,與模型組相比,SHP2組評分降低(P<0.05)。模型組、SHP2組、正常組結腸上皮杯狀細胞數量分別為(60.67±3.06)、(70.31±4.51)、(85.33±2.52)個,模型組杯狀細胞數量較正常組減少,SHP2組杯狀細胞數量較模型組增加(P均<0.05)。
2.3 三組血清COX-2、IL-6、TNF-α水平比較 模型組COX-2、IL-6、TNF-α水平高于正常組,SHP2組COX-2、IL-6、TNF-α水平低于模型組(P均<0.01)。見表1。

表1 三組血清COX-2、IL-6、TNF-α水平比較(x±s)
注:與正常組比較,*P<0.01;與模型組比較,△P<0.01。
2.4 三組結腸組織p-P65、p-STAT3、Ki67表達水平比較 模型組結腸組織中p-P65、p-STAT3、Ki67蛋白表達水平較正常組升高,SHP2組上述指標表達水平較模型組降低(P均<0.01)。見表2。
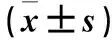
表2 三組結腸組織p-P65、p-STAT3、Ki67表達水平比較
注:與正常組比較,*P<0.01;與模型組比較,△P<0.01。
3 討論
UC是一種以腸道慢性非特異性炎癥為特征的腸道疾病,其臨床表現主要為血性腹瀉、腹痛、便血以及體質量減輕等。DAI評分作為一種以大便性狀改變程度、便血程度以及體質量下降程度為指標的評價方式,已被廣泛用于評估UC的活動程度[8]。為了探討SHP2在UC中的作用,我們利用4% DSS溶液制作急性UC模型,并通過構建腺病毒SHP2突變載體,使SHP2在小鼠腸道組織低表達,結果顯示,與對照組相比,SHP2組小鼠DAI評分降低,提示下調SHP2表達可改善急性UC模型小鼠的疾病活動程度。
腸道的組織病理學檢查及評分可從組織結構上進一步鑒別UC的嚴重程度。在UC中,常通過HE染色觀察腸道黏膜的破壞程度、腺體的排列及結構層次以及炎性細胞的浸潤等來進行病理學評分。本研究結果顯示,SHP2組腸道炎癥程度及組織病理學評分顯著高于對照組,但低于模型組,表明下調SHP2的表達可緩解UC小鼠的疾病情況,這與上述DAI評分相一致。此外,結腸黏膜上皮中杯狀細胞的數量也可在一定程度上反映小鼠UC的嚴重程度。本研究結果顯示,SHP2組小鼠結腸上皮中杯狀細胞的數目介于正常組和模型組之間。上述研究結果表明,SHP2可能是UC發生發展的一個促進因素,抑制其表達對UC具有一定的治療作用。
STAT3作為一個重要的細胞內信號轉導分子,可被細胞因子激活發生磷酸化成為p-STAT3,從而發揮生物學功能。研究表明,STAT3信號通路通過調控TNF-α、IL-6、COX-2等炎性因子的釋放而參與組織炎癥反應[4]。STAT3在UC發病機制中的重要作用已得到證實,STAT3蛋白及mRNA表達水平與疾病的活動度呈正比[9]。P65是NF-κB中促炎作用最為顯著的亞單位,其作為炎癥性腸病中炎癥級聯放大效應及瀑布樣效應的開關,在UC發病過程中起著核心作用[10]。本研究結果顯示,p-P65和p-STAT3在模型組結腸組織中的表達較正常組升高,而在SHP2組的表達較模型組降低;提示SHP2可能通過激活NF-κB/STAT3相關信號傳導通路,參與UC的發生發展。
既往研究表明,P65的活化結構即p-P65可通過介導促炎因子如TNF-α、IL-2、IL-6等的產生而參與UC的病理生理過程[11]。同時,SHP2已被證實參與RAS-RAF-MAPK、JAK-STAT、NF-κB、ERK、P13K等多條信號轉導通路的調節[12]。本研究結果顯示,模型組血清COX-2、IL-6、TNF-α水平較正常組升高,而SHP2組上述指標較模型組降低。提示SHP2可能通過激活NF-κB/STAT3相關信號傳導通路,進而促進炎性因子COX-2、IL-6、TNF-α的產生和釋放,從而介導UC的發生發展。
Ki67作為一類與細胞周期相關的增殖細胞核抗原,是目前應用最廣泛的細胞增殖標志物之一,其表達水平高低可用于評估細胞的增殖程度[6,7]。本研究結果顯示,模型組結腸組織中Ki67表達水平高于正常組,而SHP2組Ki67表達水平較模型組降低。提示SHP2可能通過促進Ki67的表達來誘導炎性細胞的增殖,從而參與UC的發病過程。
綜上所述,SHP2在小鼠UC的起病中發揮促進作用,其機制可能是通過調節NF-κB/STAT3信號通路的激活,促進炎性因子COX-2、IL-6、TNF-α產生和釋放,從而誘導炎性細胞的增殖,介導炎癥的發生;抑制SHP2表達可改善小鼠腸道UC的炎癥情況。因此,SHP2具有作為UC臨床治療靶點的巨大潛力,值得進一步深入研究。

