CYP2C19基因檢測對ACS患者PCI術后抗血小板治療指導價值探究
倪偉欣 吳 強 王楚林 林宇鵬 張華弟
廣東省揭陽市人民醫院心血管內一科,廣東揭陽 522000
急性冠脈綜合征(ACS)具有高發病率、高致死率,臨床主要采用經皮冠狀動脈介入術(PCI)治療。為減少不良心血管事件發生,國內外臨床研究推薦PCI患者常規用阿司匹林聯合氯吡格雷治療,但術后患者仍會出現心肌梗死、穩定型心絞痛、支架內再血栓等不良心血管事件發生[1]。研究認為,僅有15%氯吡格雷可經線粒體細胞色素P450酶系統轉化為活性中間代謝產物,但CY2C19基因多態性存在,影響人體內氯吡格雷的代謝,代謝差異的存在影響了PCI治療近遠期療效[2]。因此臨床認為,可經CY2C19基因多態性檢測,及時發現氯吡格雷低代謝,若發現氯吡格雷抵抗,可考慮采用其他藥物替代治療,提高抗血小板治療效果,減少不良心血管事件發生。本研究中,評價接受PCI治療ACS患者經CY2C19基因多態性檢測用于抗血小板治療的價值,現報道如下。
1 資料與方法
1.1 一般資料
本研究對象為我院從2015年5月~2016年7月實施PCI術治療的ACS患者54例,其中急性ST段抬高型心肌梗死患者32例,急性非ST段抬高型心肌梗死患者9例,不穩定型心絞痛患者13例。根據CYP2C19基因檢測結果分為兩組,觀察組29例(替格瑞洛治療90mg,1天2次),男25例,女4例,平均年齡(63.0±10.5)歲,合并疾病:血脂異常13例,糖尿病11例,高血壓14例;常規組25例(常規氯吡格雷用藥劑量75mg治療,1天1次),男22例,女3例,平均年齡(62.4±10.3)歲,合并疾病:血脂異常10例,糖尿病13例,高血壓10例。所有患者均了解本次研究的意義,排除對本次研究藥物過敏不能耐受者、2周內服用其他抗血小板藥物、患有嚴重肝臟疾病、自身免疫疾病、凝血功能障礙者。
1.2 方法
研究對象入院后均接受常規冠心病二級預防治療,應用阿司匹林、氯吡格雷雙聯抗血小板治療。觀察組應用CY2C19基因芯片檢測系統,檢測位點突變和目的基因情況,分析CY2C19等位基因突變的基因型,檢測的基因型范圍氯吡格雷低代謝和氯吡格雷高代謝。高代謝者繼續應用阿司匹林、氯吡格雷雙聯抗血小板治療,低代謝停止應用氯吡格雷,改用替格瑞洛聯合阿司匹林雙聯抗血小板治療。
1.3 隨訪觀察
1.3.1 CYP2C19基因檢測 提取樣本全血DNA,準備聚合酶鏈反應(PCR)擴增液,進行擴增獲取擴增產物,芯片雜交顯色。雜交反應結束后,芯片取出并在自然狀態下晾干,經芯片圖像分析軟件掃描及數據分析。
1.3.2 檢測血小板抑制率 根據血栓彈力圖評估凝血功能狀態指標,指導冠心病患者抗血小板治療,應用全血對血小板及凝血功能進行判斷。
1.3.3 術后隨訪不良反應 經電話、專科門診或病房隨訪的方式,分別于術后1個月、3個月、6個月進行隨訪,所有患者均獲得隨訪觀察,觀察重點為術后1個月、術后6個月的主要不良心血管事件發生率,包括心肌梗死、靶血管再次血運重建。
1.4 統計學處理
2 結果
2.1 兩組患者冠狀動脈造影結果比較
對比兩組患者冠狀動脈病變部分分布情況,差異無統計學意義(P>0.05),觀察組多支病變12例(41.4%),對照組多支病變10例(40.0%),差異無統計學意義(P>0.05),見表1。
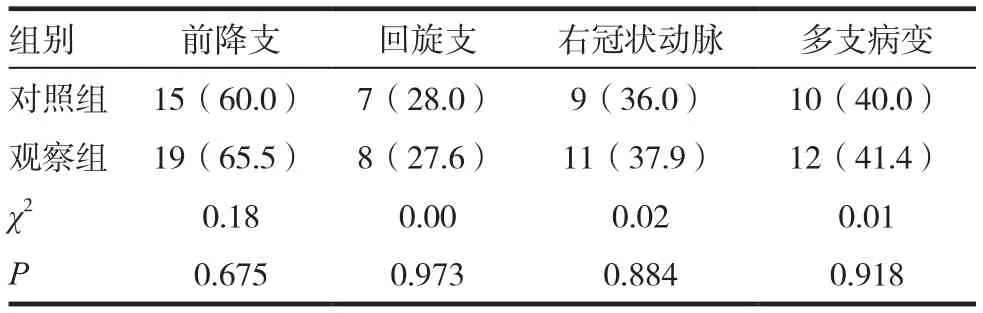
表1 兩組患者冠狀動脈造影病變部位檢查結果比較[n(%)]
2.2 CYP2C19基因分型及血小板聚集率
CYP2C19基因型分布特點:慢代謝基因型8例,快代謝基因型23例,中間代謝型23例。術前兩組的血小板抑制率對比差異無統計學意義(P>0.05),術后1個月、6個觀察組血小板聚集率率低于對照組,差異有統計學意義(P<0.05)。見表2。
表2 兩組患者血小板聚集率比較(±s)
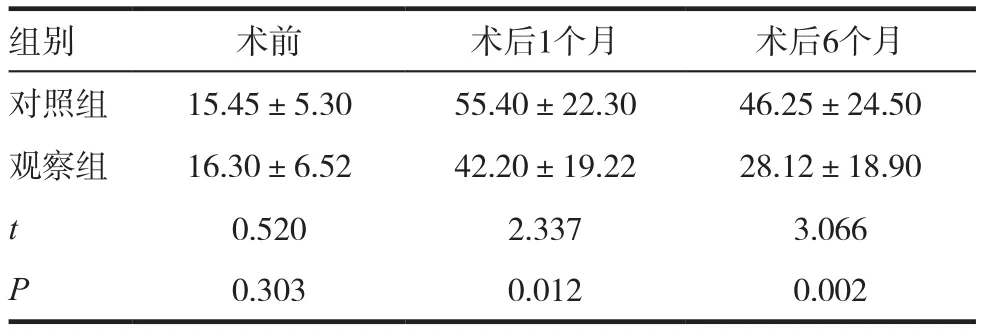
表2 兩組患者血小板聚集率比較(±s)
組別 術前 術后1個月 術后6個月對照組 15.45±5.30 55.40±22.30 46.25±24.50觀察組 16.30±6.52 42.20±19.22 28.12±18.90 t 0.520 2.337 3.066 P 0.303 0.012 0.002
2.3 兩組患者隨訪結果比較
術后1個月隨訪觀察組的不良心血管事件(MACE)發生率低于對照組,差異有統計學意義(P<0.05),觀察組心肌梗死1例,死亡0例;對照組心肌梗死2例,死亡1例;術后6個月,兩組患者的總體MACE發生率對比差異無統計學意義(P>0.05),但觀察組的整體MACE發生率低于對照組。見表3。
3 討論
急性冠脈綜合征(ACS)包括ST段抬高型心肌梗死、非ST段抬高型心肌梗死以及不穩定型心絞痛[3-4]。臨床針對ACS患者治療主要有藥物治療與介入治療兩種方法。其中血栓形成是急性冠脈綜合征發生主要病理機制,因此ACS治療中抗栓起著關鍵作用。血小板活化在血栓形成過程中起著決定性作用,因此實施抗血小板藥物治療可降低ACS患者的血栓發生。PCI術后為降低支架再狹窄、再發心肌梗死,臨床結合應用藥物洗脫支架,但存在血管內皮炎癥反應、內皮增殖不良以及應激性血栓等,導致不良心血管事件發生率增加,而且PCI術后1個月不良心血管事件發生率較高,表現為急性缺血事件,隨著再建血管內皮功能的完善,MACE事件發生率降低,因此為降低MACE事件發生率,臨床可早期應用雙聯抗血小板治療[5-6]。針對ACS患者治療,臨床不斷完善,其中氯吡格雷用于雙聯抗血小板治療藥物,療效顯著。
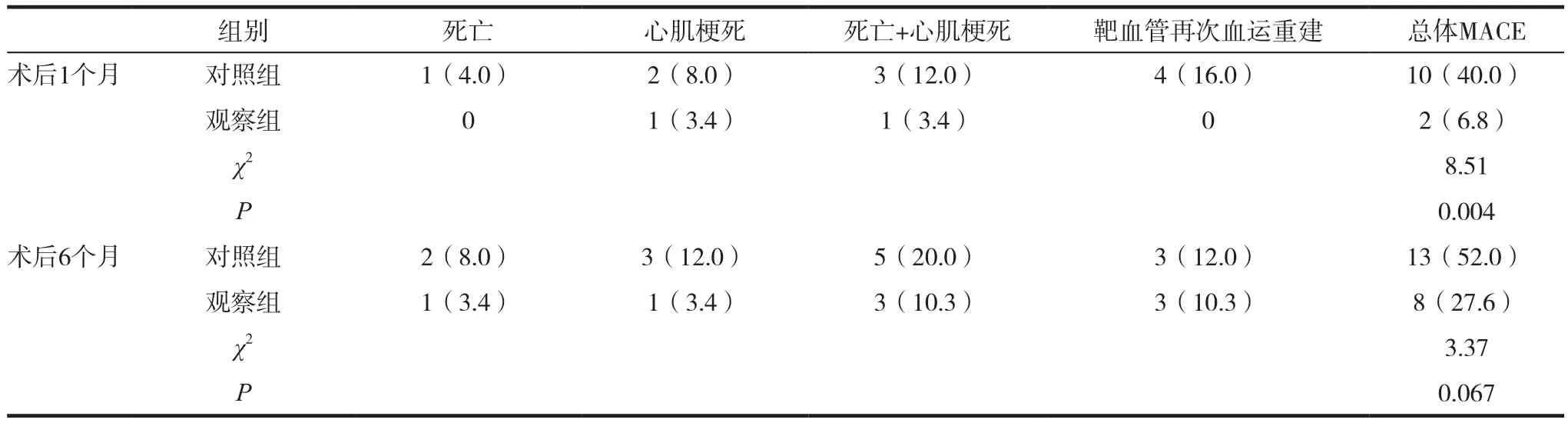
表3 兩組患者隨訪資料比較[n(%)]
氯吡格雷經細胞色素P450代謝酶肝轉化為活性物質,可對血小板膜表面ADP受體選擇性阻斷,發揮有效抑制血小板作用[7]。雖然氯吡格雷用于抗血小板治療效果顯著,但仍有部分患者因血小板抑制不足,而發生不良心血管事件發生。研究提出,不同患者應用氯吡格雷抗血小板作用及療效存在顯著的個體化差異,部分患者反應欠佳,分析為藥物低反應性,稱之為氯吡格雷抵抗[8-9]。其發病機制復雜,分析可能與藥物相互作用、藥代動力學與劑量應用不足相關。
基因檢測可為ACS患者PCI術后制定具有針對性抗血小板治療提供指導依據,指導臨床藥師展開個性化藥物藥物治療方案。臨床藥師開展基因檢測時,首先評估血栓風險,選擇合適進行基因檢測人群。但基因檢測僅為臨床治療方案的一個參考依據,藥師仍應在基因檢測基礎上,綜合評估患者的支架內血栓風險、藥物療效、不良反應、用藥依從性以及心血管危險因素等,優化抗血小板方案,提高臨床療效,保證用藥安全。有研究提出,遺傳基因多態性與氯吡格雷抵抗密切相關,其中最受關注的是CYP2C19基因,而關于基因檢測結果與臨床預后關系,是當前臨床關注重點,研究提出CYP2C19基因多態性可能與PCI治療后抗血小板藥物療效相關[10-11]。
本次研究表明,實施PCI治療的ACS患者經CYP2C19基因多態性檢測,可及時發現氯吡格雷低代謝,指導臨床改用替格瑞洛聯合阿司匹林雙聯抗血小板治療,避免抗血小板藥物療效不佳,觀察組術后1個月的MACE發生率明顯少于對照組。受基因多態性影響不同個體的蛋白水平差異表現不同,進而影響氯吡格雷活性代謝產物活性以及水平,最終表現為ACS患者治療中應用氯吡格雷療效差異較大[12-13]。在CYP2C19*2/*3和CYP2C19*2/*2、CYP2C19*3/*3不同基因攜帶中,氯吡格雷用藥效果不同,其活性產物血藥濃度下降,表現為氯吡格雷抵抗[14]。本次研究中,觀察組治療1個月、6個月的血小板聚集率低于對照組,表明隨著用藥治療時間延長,藥效逐漸穩定,替格瑞洛對血小板聚集抑制效果優于氯吡格雷。
本次研究中,兩組術后1個月總體MACE發生率主要為死亡+心肌梗死,其中出現心肌梗死并接受二次PCI治療患者4例經基因多態性檢測,檢查結果為,氯吡格雷低代謝患者1例,二次PCI術后用替格瑞洛替代氯吡格雷藥物,隨訪無不良心血管事件發生,表明氯吡格雷抵抗是導致血栓發生的主要原因,進一步表明藥物抵抗與不良心血管事件發生相關。術后6個月接受隨訪,基因多態性檢測指導治療觀察組的MACE發生率仍較低,但與常規組比較,無統計學意義,表明氯吡格雷抵抗所導致的不良心血管事件集中發生于PCI術后1個月,隨著血管內皮化的不斷完善,支架內血栓形成概率下降。鄭振國等[15]研究中,觀察組的總體MAC發生率(1.3%)低于常規氯吡格雷組(5.2%),術后6個月,觀察組總體MACE發生率(2.4%)與常規組總體MACE發生率對比無統計學意義,但觀察組總體MACE發生率仍較低,這與本次研究基本相符,表明替格瑞洛當做氯吡格雷低代謝的替代藥物,被證實效果顯著。
既往研究表明,若患者攜帶無功能CYP2C19基因,氯吡格雷抑制血小板代謝活性下降,會增加支架內血栓、再發心肌梗死、不穩定型心絞痛等發生率,增加心血管死亡事件發生率,分析可能是因CYP2C19功能缺失等基因導致氯吡格雷抵抗相關。詹曉燕等[16]關于抗血小板藥物替格瑞洛與氯吡格雷療效研究表明,出院后3個月內替格瑞洛組的不良心血管事件發生率低于氯吡格雷,這也進一步證實心腦血管事件死亡的主要原因為氯吡格雷抵抗。分析替格瑞洛為一種非前提性藥物,不需經肝臟代謝酶代謝激活,可有效抑制CYP2C19功能確實行患者血小板聚集達標率,分析是因替格瑞洛可與ADP P2Y12受體發生可逆結合,持續抑制血小板,且不會受藥物與細胞色素P450系統藥物代謝酶之間的相互作用影響。因此從某種意義上來說,替格瑞洛取代氯吡格雷,已經成為一種國際趨勢。當前臨床關于氯吡格雷、替格瑞洛抗血小板藥物基因研究表明,已經獲得較大發展,當前并無規范國際指南,且實驗結果受研究對象多種因素影響,但關于極易多態性在氯吡格雷影響存在較大分歧,需更為規范數據支持。
綜上所述,基因檢測為一種有效的氯吡格雷抵抗檢測方法,臨床可根據檢測結果減少預防不良心血管事件發生,而且將替格瑞洛用于氯吡格雷代謝替代藥物,應用效果顯著。因此臨床可將CYP2C19基因檢測用于PCI術后ACS患者抗血小板治療近期治療指導效果顯著,但關于遠期預后效果,仍需臨床深入研究。

