鮑曼不動桿菌RND主動外排泵的表達與耐藥性的關系
陳 嬌,劉 康,李劍平,吳秀珍,胡雪飛,陳開森,陳 賀
(1 江西衛生職業學院,江西 南昌 330052; 2 南昌大學第一附屬醫院,江西 南昌 330006; 3 南昌大學第二附屬醫院,江西 南昌 330006)
鮑曼不動桿菌(Acinetobacterbaumannii,AB)是醫院感染的常見病原菌之一,廣泛分布在醫院環境中,可引起嚴重的肺炎、尿路感染、血流感染等多種醫院感染,特別易引起免疫力低下重癥患者的感染[1-3]。AB對多種抗菌藥物表現出耐藥,使其成為最具有挑戰性的病原菌之一,Xie等[4]報道,在過去的16年(2006—2016年)經合組織國家AB的耐藥性在快速增長;AB由于多重耐藥,限制了抗感染治療的選擇,使疾病更為嚴重[5]。因此,AB感染已成為日益顯著的公共健康問題[6]和全球醫院感染的主要的威脅[7]。AB的耐藥機制非常復雜,可由多種耐藥機制介導,如外膜蛋白表達改變,造成抗菌藥物通透障礙;拓撲異構酶和DNA旋轉酶的改變;多種藥物的外排泵過度表達;PBPs改變;β-內酰胺酶的產生等[8]。主動外排泵機制是AB出現耐藥的主要機制之一,其可以將進入細菌內的藥物排出,導致細菌內藥物濃度降低,使抗菌藥物不足以發揮抗菌作用而出現耐藥。與AB耐藥有關的外排系統主要有ATP結合盒式蛋白家族(ATP-binding cassette superfamily,ABC)、耐藥結節分化家族(resistance-nodulation family,RND)、小多耐藥家族(small multidrug resistance family,SMR)、多藥與毒性化合物外排家族(multidrug and toxic compound extrusion family,MATE)和主要易化因子超家族(major facilitator superfamily,MFS),其中RND主動外排系統在革蘭陰性菌中普遍存在,并且有大量的研究報道[9],AB的多重耐藥與RND基因過度表達密切相關。本文將探討AB中RND主動外排系統的分布情況,比較不同耐藥表型的AB間外排泵基因的表達情況,從而闡述其與細菌耐藥性的關系。
1 材料與方法
1.1 菌株來源 59株AB來自于南昌大學第一附屬醫院檢驗科臨床送檢的各種標本。ATCC 25922、ATCC 27853菌株由江西省臨床檢驗中心吳茂紅主任技師贈予,ATCC 19606菌株購自Microbiologics公司。

1.3 鮑曼不動桿菌DNA的制備 按照Omega公司細菌DNA提取試劑盒的操作步驟提取菌株DNA。
1.4 PCR擴增 PCR引物由上海Sangon合成。具體引物序列及引物長度見表1。

表1 普通PCR的基因引物序列及產物大小
1.5 DNA序列驗證 所獲基因的DNA序列均由上海Sangon測序后經NCBI GenBank Blast驗證。
1.6 外排泵基因相對表達量的測定
1.6.1 試驗菌株 從59株AB中挑取8株同時攜帶三種RND外排泵基因且耐藥性具有一定差別的菌株作為試驗菌株,對其進行外排泵基因的相對表達量的測定,8株AB試驗菌株對抗菌藥物的耐藥結果見表2。
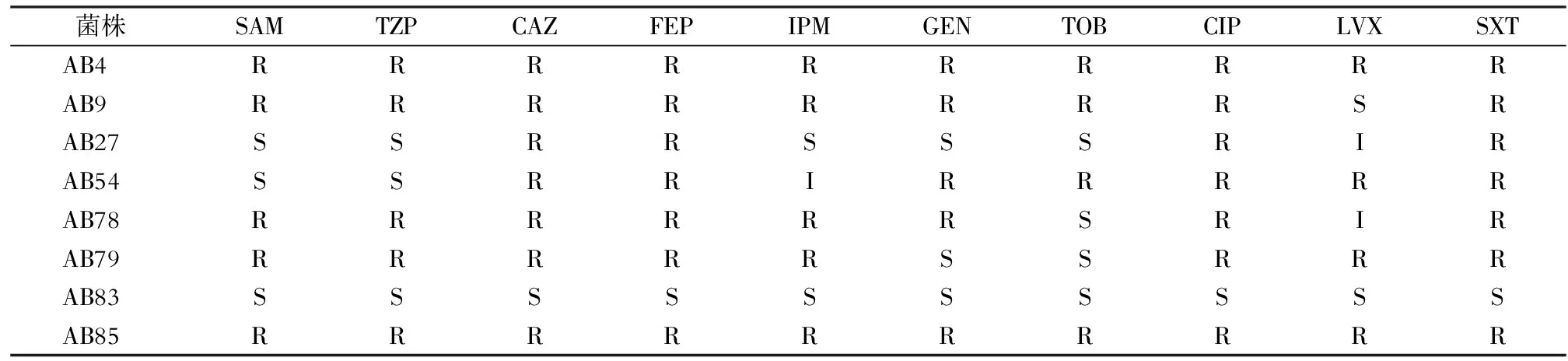
表2 8株AB試驗菌株對臨床常見抗菌藥物的敏感結果
R:耐藥;I:中介;S:敏感
1.6.2 總RNA提取 按照Omega公司細菌RNA提取試劑盒的操作步驟提取菌株RNA,使用核酸蛋白分析儀檢測RNA的濃度,并取RNA進行電泳。
1.6.3 逆轉錄 (1)逆轉錄前需要去除殘留DNA;(2)冰上配制反轉錄反應液:采用Transgen公司的cDNA合成試劑盒合成cDNA。
1.6.4 熒光定量PCR(RT-PCR)擴增外排泵系統相關基因 熒光定量PCR反應體系為20 μL,包括上、下游引物(引物序列見表3)各0.4 μL, cDNA模板2 μL, Mix 10 μL,Passive Reference 0.4 μL,用RNase-free H2O補足體積。擴增條件為三步法,第一步95℃ 30 s,1個循環;第二步95℃ 5 s,60℃ 30 s,40個循環。根據2-△△Ct的方法對數據進行處理,△Ct=Ct目的基因- Ct內參基因,△△Ct=△Ct耐藥菌株-△Ct標準菌株。
表3熒光定量PCR的基因引物序列及產物大小
Table3 Gene primer sequences and product size of real-time PCR

基因引物序列(5’-3’)產物長度(bp)16SrRNA-FCAGCTCGTGTCGTGAGATGT15016SrRNA-RCGTAAGGGCCATGATGACTT qadeB-F ACAAGACCGCGCTAACTTAGGT67qadeB-R TGCCATTGCCATAAGTTCATCT qadeR-F CGCTCTAGTGCATCGCTATC313qadeR-R GCATTACGCATAGGTGCAGA qadeS-FTCGCAAAGCGTTTTATTGTG175qadeS-RGCATTTTTGACGGAAACCTC qadeJ-FGGTCATTAATATCTTTGGC222qadeJ-RGGTACGAATACCGCTGTCA qadeG-FTTCATCTAGCCAAGCAGAAG469qadeG-RGTGTAGTGCCACTGGTTACT
1.7 統計學處理 本實驗中采用兩獨立樣本t檢驗的方法進行統計分析(GraphPad Prism 5軟件),當P≤0.5認為具有統計學意義。
2 結果
2.1 AB臨床分布及耐藥性 臨床分離的59株AB主要來自于新生兒重癥監護病房(NICU,15株,25.4%),其次來自于綜合重癥監護病房(ICU,11株,18.6%)、神經外科(10株,16.9%),有27.1%的AB來自于其他ICU(燒傷外科ICU及急診ICU各5株,呼吸內科ICU 3株,心胸外科ICU 2株,神經內科ICU 1株)。74.6%(44株)的AB來自于痰,其次來自于血(5株,8.5%)。54.2%(32株)的AB對SAM、IPM、GEN、CIP、LVX均耐藥,AB對常用抗菌藥物的耐藥情況見表4。
表459株AB對常用抗菌藥物的耐藥情況
Table4 Antimicrobial resistance of 59 strains of AB to commonly used antimicrobial agents
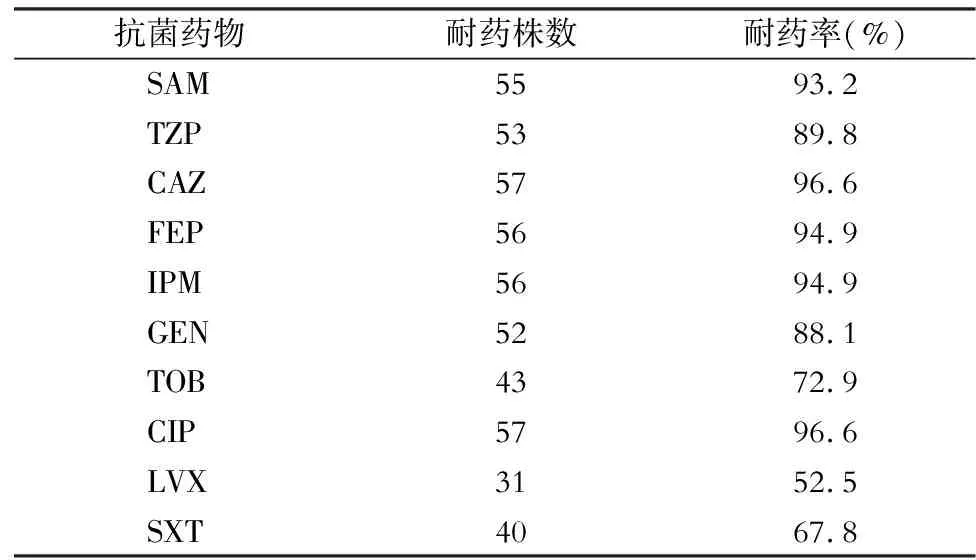
抗菌藥物耐藥株數耐藥率(%)SAM55 93.2TZP53 89.8CAZ57 96.6FEP56 94.9IPM56 94.9GEN52 88.1TOB43 72.9CIP57 96.6LVX31 52.5SXT40 67.8
2.2 AB主動外排泵基因及整合子的檢測結果 59株AB經外排泵及整合子基因PCR擴增檢測,48株(81.4%)攜帶adeR,54株(91.5%)攜帶adeS,55株(93.2%)攜帶adeB,59株(100%)攜帶adeJ,36株(61.0%)攜帶adeG。AB菌株外排泵基因PCR擴增電泳結果見圖1。
2.3adeR及adeS基因測序結果 對adeABC外排泵的調控基因adeR和adeS的堿基序列進行比對分析,AB試驗菌株與標準菌株19606的基因序列一致性達100%,未出現基因突變或插入序列。AB試驗菌株adeR、adeS基因PCR產物部分測序結果見圖2-3。

注:1泳道為Marker;2—6泳道分別為AB菌株adeR、adeS、adeB、adeJ、adeG基因陽性標本
圖1AB菌株外排泵基因PCR擴增產物電泳圖
Figure1 Electrophoresis map of PCR amplified product of efflux pump genes of AB strains
圖2 AB試驗菌株adeR基因PCR產物部分測序結果

圖3 AB試驗菌株adeS基因PCR產物部分測序結果
2.4 主動外排系統相關基因的表達水平 采用熒光定量PCR對AB試驗菌株及標準菌株19606進行主動外排系統相關基因表達水平的檢測,結果見表5。
2.5 主動外排泵基因的表達與細菌耐藥性的關系 按細菌對抗菌藥物的耐藥性將AB分為耐藥組及非耐藥組,采用兩獨立樣本t檢驗的方法進行統計分析,GEN、IPM、SAM耐藥組與非耐藥組adeB、adeJ基因的表達量相比,差異具有統計學意義(P<0.05)。見圖4。
表5AB試驗菌株主動外排泵基因的相對表達量
Table5 Relative expression of efflux pump genes in tested AB strains

菌株adeSadeRadeBadeJadeG196061.00 1.00 1.00 1.00 1.00 AB42.344.2210.737.241.25AB92.672.1914.91 8.71 1.34 AB272.171.912.242.281.56AB542.142.253.783.351.67AB783.232.677.67 5.34 1.57 AB792.211.893.233.452.01AB831.071.671.571.541.12AB853.544.579.565.682.35

注:R為耐藥組,S為敏感組
3 討論
在不動桿菌屬中,AB是引起醫院感染最重要的病原菌之一[10],也是引起與機械通氣相關肺炎的最常見細菌之一[11],一旦擴散,極易造成暴發流行。本研究中71.2%的AB菌株來源于ICU,74.6%的AB菌株來源于痰標本。由于抗菌藥物的不合理使用及醫院感染管理控制措施的缺失或執行不到位,使得細菌的耐藥性呈不斷上升趨勢,多重耐藥AB(multidrug-resistantAcinetobacterbaumannii,MDR-AB)已成為醫院感染的主要病原菌[7],并在全球播散。本文探討的主動外排系統機制是AB主要耐藥機制之一,科學家們通過利用外排泵抑制劑,如羰基氰氯苯腙等作用于MDR-AB,從而改變AB的耐藥表型來證明主動外排系統在MDR-AB中的作用,本文則通過AB不同的耐藥表型與外排泵基因的不同表達,探索AB耐藥性與主動外排系統之間的復雜關系。
RND家族是不動桿菌屬細菌最主要也是最早發現的外排泵系統,由于其外排底物的廣泛性,外排泵的過度表達可使更多的抗菌藥物被排出菌體外,從而引起多重耐藥。RDN外排泵一般由膜融合蛋白(MFP)、RND轉運蛋白、外膜蛋白(OMF)三部分組成,其中MFP使細菌內外膜結合緊密,使結構穩定;RND轉運蛋白具有識別藥物并將其主動轉出細胞膜的功能;OMF位于細胞外膜,具有孔道蛋白的作用,使藥物排出菌體[9]。此三種蛋白通常由操縱子編碼,其中RND轉運蛋白的特征決定了底物的廣泛性,常作為流行病學的檢測指標。在AB中已發現與多重耐藥相關的RND外排系統主要有adeABC、 adeIJK、adeFGH、adeDE、adeXYZ,其中對AdeDE、AdeXYZ研究較少,其表達及調控機制還未見報道。目前少有AB外排泵基因流行情況的報道,本文通過檢測RND轉運蛋白adeB、adeJ、adeG外排泵基因,分析adeABC、 adeIJK、adeFGH外排泵在AB中的存在情況,研究發現55株(93.2%)AB攜帶adeB基因,59株(100%)AB攜帶adeJ,36株(61.0%)AB攜帶adeG,可見RND外排系統在AB中普遍存在。López等[12]報道,RND主動外排系統在病原菌毒力因子的調節、排除細胞內代謝產物、調節細胞動態平衡和細胞間信號轉導等方面均有一定的作用,此或許是RND在細菌中普遍存在的原因。
為更好地揭示AB耐藥性與RND外排泵基因表達之間的關系,本研究從試驗菌株中挑選了耐藥表型不同的AB,檢測其不同外排泵基因的表達。從熒光定量PCR的結果分析來看,AB耐藥機制非常復雜,主動外排系統僅起到了部分作用,對一種抗菌藥物耐藥可與多種外排泵基因有關,但一種主動外排系統同時可以導致AB對多種抗菌藥物出現MIC值升高或耐藥。在本研究中經過統計學分析發現,GEN、IPM、SAM耐藥組與非耐藥組ABadeB、adeJ基因的表達量相比,差異具有統計學意義(P<0.05),且耐藥組均表現為多重耐藥,其他抗菌藥物耐藥組及非耐藥組RND外排泵基因的表達未發現有統計學意義。Chang等[13]報道,adeABC外排泵的過度表達與氨基糖苷類、四環素類、氟喹諾酮類、替加環素等抗菌藥物的耐藥性有關,而AB對氨基糖苷類耐藥與adeABC或abeM(MATE)有關,對氟喹諾酮類耐藥與adeABC、adeIJK、adeFGH、abeS(SMR)、abeM(MATE)有關,對β-內酰胺類抗生素耐藥與adeABC、adeIJK有關[14]。
RND外排泵中adeABC是由位于adeB基因上游的adeR與adeS基因分別編碼的反應調節蛋白adeR和感應激酶adeS這兩種蛋白組成調控系統控制的[15]。研究[16]表明,adeRS的變異與adeABC的過度表達和耐藥性有關。本研究中adeABC外排泵的調控基因adeR和adeS的堿基序列與標準菌株19606的基因序列一致性達100%,未出現基因突變或插入序列。可見本研究中的AB菌株adeABC外排泵的表達升高并不是由其調控基因adeR、adeS的基因突變或插入序列引起,可能存在其他機制。
總之,AB的耐藥機制非常復雜,其中RND外排系統在MDR-AB中普遍存在,RND外排系統中adeB和adeJ基因的表達水平升高與細菌對GEN、IPM、SAM的耐藥性有關,adeABC外排泵的調控系統adeR、adeS基因未見突變或插入序列,其表達升高可能存在其他機制。

