鉻酸鋇與硫酸氫鈉固液反應制備重鉻酸鈉的過程強化*
吳海峰,全學軍,李 綱,程 雯,秦險峰
(重慶理工大學化學化工學院,重慶400054)
傳統鉻鹽生產方式采用有鈣焙燒技術,該工藝資源利用率低、產生的高毒鉻渣量大、含Cr(Ⅵ)多,嚴重污染生態環境[1];國內外較先進的生產工藝為無鈣焙燒工藝,區別于傳統有鈣焙燒技術,該工藝產生的鉻渣量大幅減少,但仍未能徹底解決鉻渣的污染問題[2]。中國科學院過程工程研究所成功地研發了鉀系亞熔鹽鉻鹽清潔生產工藝[3],與目前國內外最先進的工藝相比,該工藝實現了堿金屬離子再生循環和氧化鉻綠的短流程清潔生產,其主要產品是K2CrO4。
由于Na2Cr2O7是當前鉻鹽市場的主流產品,目前,已有將鉀系亞熔鹽法所得的K2CrO4中間體向Na2CrO4轉化的研究[4]。 田穎等[5]研發了鉀系亞熔鹽法所得K2CrO4中間體向Na2Cr2O7轉化的工藝,避免了傳統工藝的鉻渣污染,實現了鉻鹽產品清潔生產。該過程分為 K2CrO4與BaO反應制備 BaCrO4和BaCrO4與NaHSO4反應制備最終產品Na2Cr2O7兩部分。前半部分條件溫和、轉化完全、反應速度快,但該過程后半部分BaCrO4轉化成Na2Cr2O7屬于固液多相反應類型,采用傳統的加熱攪拌反應,時間長(400 min)、效率低。其主要原因是該固液反應生成的硫酸鋇也是固體顆粒,會包裹在反應物顆粒表面,阻止反應的繼續進行。因此,研究該反應過程的強化對于實現鉻鹽清潔生產工藝具有重要的意義。
據報道[6-11],固液球磨反應利用磨球撞擊固體反應顆粒表面,可在表面產生高溫高壓區域,提高固相表面的活性,加速反應的進行。采用球磨反應模式,在磨球不斷撞擊固體反應物顆粒產生高溫區域的同時,還能剝離包裹在反應物顆粒上的硫酸鋇顆粒,并不斷更新固液反應界面[12]。為此,采用球磨反應方式對BaCrO4轉化為Na2Cr2O7的過程進行強化,系統考察了過程參數對BaCrO4轉化率的影響規律,并對工藝參數進行了優化。
1 實驗試劑與方法
1.1 主要試劑與儀器
試劑:鉻酸鋇、硫酸氫鈉、硫酸、磷酸、二苯碳酰二肼,均是AR級。
設備與儀器:均相水熱反應器KLJX-12;TU-1901雙光束紫外可見分光光度計。
1.2 實驗方法
1.2.1 球磨反應器及反應過程調控
球磨反應器:本實驗用到的球磨反應器為均相水熱反應器,如圖1所示。
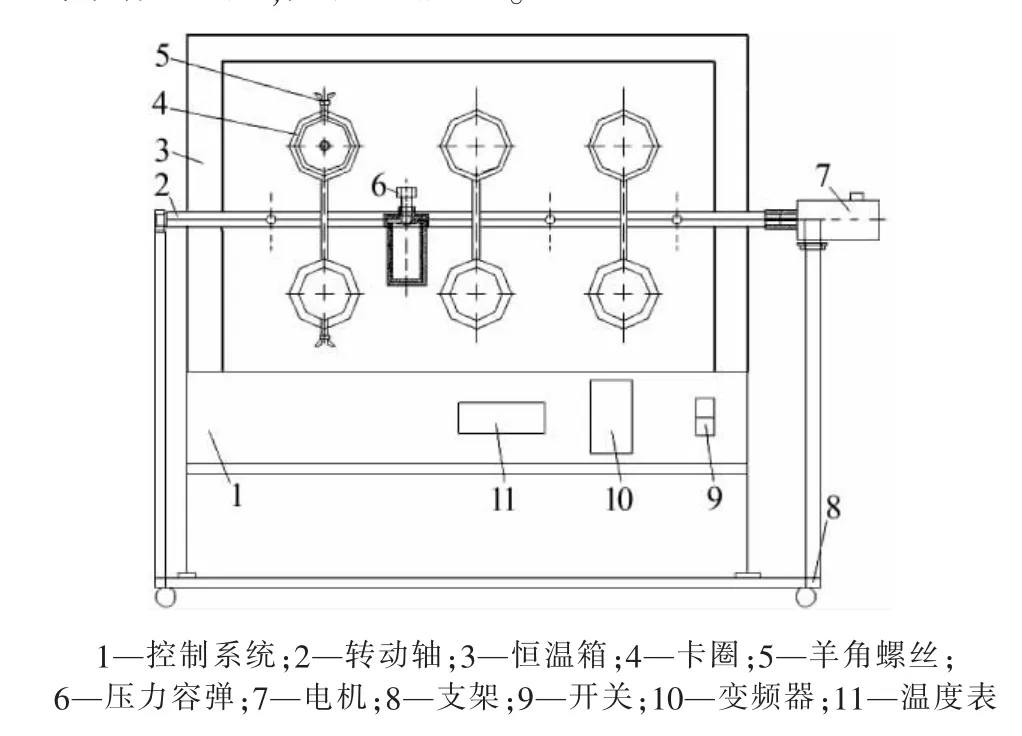
圖1 均相水熱反應器
反應過程調控:調節溫度表,當恒溫箱內達到指定溫度時,打開箱門,將已裝填好反應物和磨球的壓力容彈(如圖2)通過卡圈固定在轉動軸上,開啟控制系統并調節變頻器(轉速0~70 r/min可調),電機工作帶動轉動軸轉動,實現恒溫箱內單個壓力容彈內的球磨功能,從而實現水熱反應釜內物料的球磨混合,有效地改進反應效果。
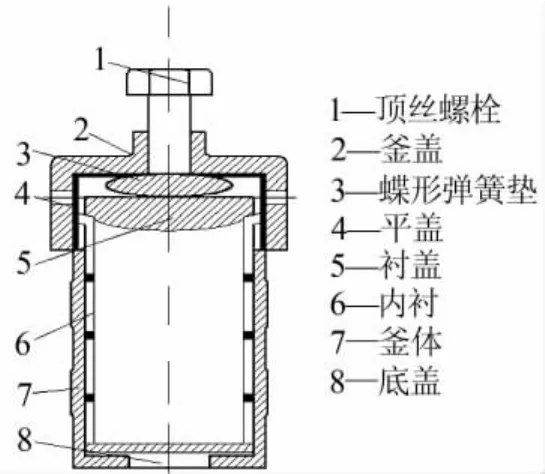
圖2 壓力容彈(水熱合成反應釜)
1.2.2 鉻酸鋇的球磨轉化反應
鉻酸鋇與硫酸氫鈉固液反應制備重鉻酸鈉按照下列化學反應方程式進行:
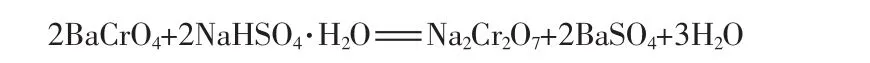
該固液反應生成的新固相硫酸鋇會包裹在反應物固相鉻酸鋇表面,形成一層致密的殼層,阻礙反應的持續進行。若采用傳統的固液攪拌反應方式,難以剝離反應物固相表面的生成物固相殼層,致使反應效率低,耗能耗時[12]。固液球磨反應通過磨球的撞擊等機械力作用使固體反應物顆粒表面產生高溫高活性區域,同時迅速剝離反應物固體顆粒表面的生成物固體顆粒,裸露出反應物固體顆粒新生表面,使反應能夠持續進行,具體反應過程如圖3所示。

圖3 固液球磨反應過程
開啟均相水熱反應器升溫系統對恒溫箱進行預熱,待體系溫度上升至指定溫度后,打開恒溫箱門,將裝有一定質量硫酸氫鈉、去離子水、鉻酸鋇和磨球(氧化鋯球,粒徑為0.6~2.5 mm)的壓力容彈固定在轉動軸上,開始球磨反應并計時。反應完成后,取出壓力容彈并將物料冷卻至室溫,取一定量重鉻酸鈉溶液過濾,將得到的濾液靜置,待分析。
實驗考察了反應溫度(℃)、反應時間(min)、液固比(溶液體積與鉻酸鋇質量比,mL/g)、料球比(物料與氧化鋯球的質量比)、固液混合速率(r/min)、物料配比(硫酸氫鈉與鉻酸鋇的物質的量比)對鉻酸鋇轉化率的影響。
1.3 分析方法
采用二苯碳酰二肼分光光度法(GB/T 15555.4—1995《固體廢物六價鉻的測定二苯碳酰二肼分光光度法》)分析待測溶液中Cr(Ⅵ)含量。所有的測試均在相同條件下測試3次,且最終測定結果是3次測定的平均值,相對誤差不超過5%。具體分析方法如下。
濾液中Cr(Ⅵ)濃度測定:量取一定量濾液(重鉻酸鈉溶液)于容量瓶中,用去離子水定容待測。取適量容量瓶中的待測液于50 mL比色管中定容,加入硫酸0.5 mL、磷酸 0.5 mL、顯色劑 2 mL,搖勻、放置10 min,測定其吸光度值。濾液中Cr(Ⅵ)質量濃度(g/L),按下式計算:

式中:ρ為比色管中 Cr(Ⅵ)的質量濃度,mg/L;n為濾液稀釋倍數;V為待測溶液體積,mL。
根據鉻酸鋇和硫酸氫鈉反應式,計算理論生成的重鉻酸鈉中Cr(Ⅵ)的濃度,鉻酸鋇的轉化率即為實測Cr(Ⅵ)的濃度與理論Cr(Ⅵ)的濃度之比。
2 實驗結果與討論
2.1 反應溫度、反應時間對鉻酸鋇轉化率的影響
在液固比為10mL/g、反應時間為120min、料球比為 2∶1、物料配比為 1∶1、固液混合速率為 40r/min 條件下,考察了反應溫度對鉻酸鋇轉化率的影響,見圖4a。由圖4a可見,隨著溫度的升高,鉻酸鋇的轉化率增大,當反應溫度為180℃時,鉻酸鋇的轉化率達到92%;溫度繼續升高時,鉻酸鋇的轉化率變化不明顯。綜合考慮能源消耗等方面問題,確定工藝溫度為180℃。
在反應溫度為180℃、液固比為10 mL/g、料球比為 2∶1、物料配比為 1∶1、固液混合速率為 40 r/min的條件下,考察了反應時間對鉻酸鋇轉化率的影響,如圖4b所示。由圖4b可以看出,在反應時間為60~120 min時,隨著反應時間的增加,鉻酸鋇轉化率急速增大;當反應時間超過120 min時,鉻酸鋇的轉化率基本保持穩定。綜合考慮能耗、工藝優化等問題,確定最優反應時間為120 min。

圖4 反應溫度(a)和反應時間(b)對轉化率的影響
2.2 液固比、物料配比對鉻酸鋇轉化率的影響
在反應溫度為180℃、反應時間為120 min、料球比為2∶1、物料配比為1∶1、固液混合速率為40 r/min條件下,考察了液固比對鉻酸鋇轉化率的影響,結果見圖5a。由圖5a可見,隨著液固比的增大,鉻酸鋇的轉化率顯著增大。當液固比為10mL/g時,鉻酸鋇的轉化率達到93%;液固比繼續增大,鉻酸鋇轉化率變化不明顯,因此選擇最優反應液固比為10 mL/g。
在液固比為10 mL/g、反應溫度為180℃、反應時間為120min、料球比為2∶1、固液混合速率為40 r/min條件下,考察了物料配比對鉻酸鋇轉化率的影響,結果見圖5b。由圖5b可見,當硫酸氫鈉足量時(物料配比為1∶1),鉻酸鋇的轉化率最大,為93%,因此選擇最優物料配比為1∶1。

圖5 液固比(a)和物料配比(b)對轉化率的影響
2.3 料球比、固液混合速率對鉻酸鋇轉化率的影響
在液固比為10 mL/g、反應溫度為180℃、反應時間為120 min、固液混合速率為40 r/min、物料配比為1∶1的條件下,考察了不同料球比對鉻酸鋇轉化率的影響,結果見圖6a。由圖6a可見,當反應體系內沒有磨球時,該反應情形屬于傳統的水熱轉化反應過程。此時,鉻酸鋇的轉化率最低,這說明磨球的存在明顯強化了反應過程。隨著磨球數量的增加,鉻酸鋇的轉化率逐漸增大;但當磨球超過一定數量后,轉化率卻呈下降趨勢。這是因為隨磨球數量增加,磨球之間的碰撞、磨球與鉻酸鋇之間的碰撞和磨球與壓力容彈器內壁之間的碰撞增加,反應因此更劇烈,故鉻酸鋇的轉化率增加;但當磨球數量繼續增加,而壓力容彈空間有限,導致磨球的撞擊受阻,球磨反而不夠充分,致使鉻酸鋇的轉化率反而呈下降趨勢。綜合考慮球磨的充分性,選擇最佳料球比為2∶1。
在液固比為10 mL/g、反應溫度為180℃、反應時間為 120 min、料球比為 2∶1、物料配比為 1∶1 的條件下,考察了不同轉速對鉻酸鋇轉化率的影響,結果見圖6b。由圖6b可見,隨著均相水熱反應器中心轉軸轉速的增加,鉻酸鋇的轉化率增大,說明球磨介質對反應體系的碰撞頻率也有較大的影響。當轉速超過50 r/min時,對鉻酸鋇轉化率的影響逐漸減小,為了讓磨球充分撞擊反應物顆粒表面,提高其活性,綜合考慮反應的完全性,選擇轉速為50 r/min。
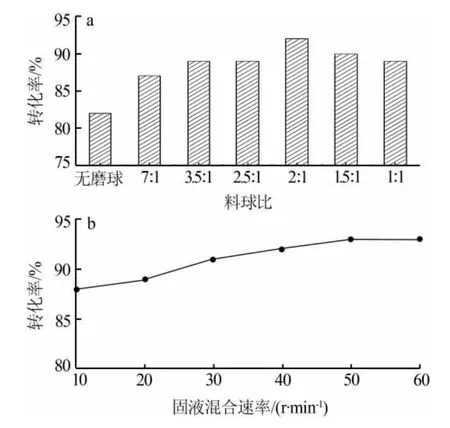
圖6 料球比(a)和固液混合速率(b)對轉化率的影響
2.4 優化工藝條件下的轉化率
經過工藝優化,在反應溫度為180℃、液固比為10 mL/g、料球比為 2∶1、物料配比為 1∶1、固液混合速率為50 r/min的條件下,鉻酸鋇的轉化率隨時間變化見圖7。由圖7可見,當反應進行到最優反應時間120 min時,鉻酸鋇的轉化率達到93%。
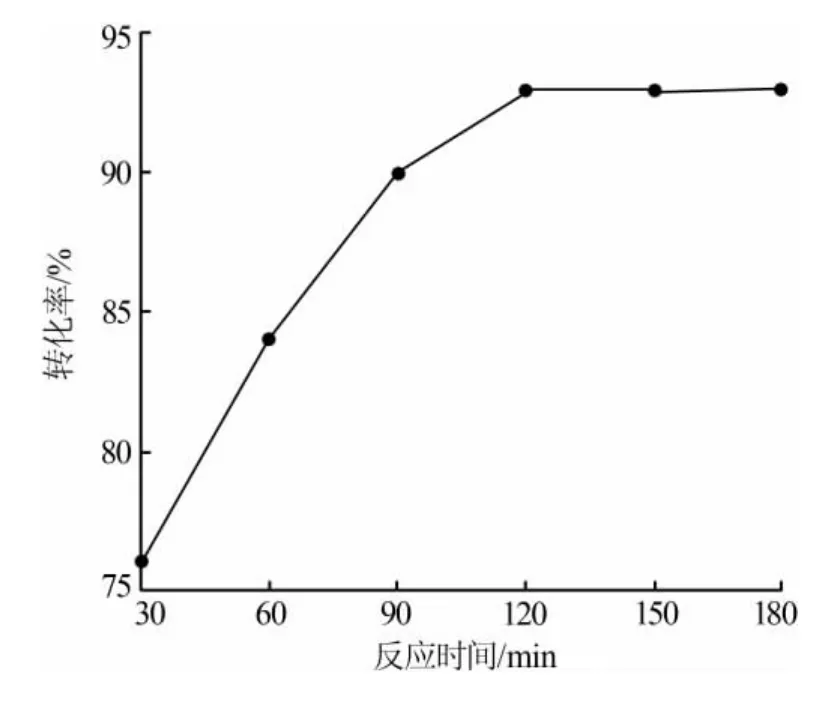
圖7 優化條件下鉻酸鋇的轉化率
3 結論
在固液球磨模式下,鉻酸鋇轉化為重鉻酸鈉所需的反應時間從傳統反應模式下的400 min減少至120 min,反應轉化過程得到了顯著的強化,對于實現鉻鹽液相氧化法制備鉻酸鈉清潔生產工藝具有較大的應用價值。優化后的工藝條件為:反應溫度為180℃、反應時間為120 min、液固比為10 mL/g、料球比為 2∶1、物料配比為 1∶1、固液混合速率為 50 r/min,此時鉻酸鋇的轉化率為93%。

