單側肺動脈缺如影像學7例分析
陳國良 靳永強 張福強 吳清玉
單側肺動脈缺如(unilateral absence of pulmonary artery,UAPA)是極為罕見的先天性心臟病,單純性UAPA在成年人發生率為200 000至300 000之一[1-2]。截止至2011年,文獻報道的UAPA患者共有352例,約60%的UAPA可合并其他先天性畸形,法洛四聯癥為最常見的先天畸形[3-5]。臨床表現為患側心包內肺動脈完全缺失,對側肺動脈連接主肺動脈,患側肺的血供多來源于支氣管動脈的代償性擴張,但來源于肋間動脈、膈下動脈、鎖骨下動脈甚至冠狀動脈來源的側枝血管均有報道[6-7]。
本研究總結UAPA患者的影像學特點,結合胚胎學發育理論,探討UAPA形成原因。
資料與方法
1.臨床資料 2011年6月 至2016年12月,我院共收治的UAPA患者共7例,男性6例,女性1例,年齡在3個月~16歲。經超聲心動圖、CT或心導管造影檢查確診,所有病例均有X線平片、心電圖、超聲心動圖及詳細臨床資料。
2.心導管造影術 心導管造影采用Philip公司雙C臂X線診斷儀,常規穿刺股動、靜脈行右心室坐觀位及升主動脈正側位造影。心室及主動脈造影采用高壓注射器注入造影劑,嬰幼兒和兒童1.0~1.5mL/kg,1.2~1.5s內注入;14 歲以上患者心室造影25~35 mL/次,主動脈造影20~25mL/次,流速14~15mL/s。選擇性側支血管造影以手推方式注入造影劑。
3.心臟CT CT檢查采用Philip 64排螺旋CT機,使用造影劑增強橫斷面掃描(1~2mL/kg),具體掃描參數:管電壓 80~120kV,管電流 120~200mA,層厚0.625 mm。心血管掃描圖像在GE AW 4.2工作站上作最大密度投影(MIP)、多平面重建(MPR)及容積重建(VR)。
結 果
1.合并畸形 在7個研究對象中,合并動脈導管未閉(patent ductus arteriosus,PDA)患者 2例,合并室間隔缺損1例,合并房間隔缺損、PDA 1例,合并法洛氏四聯癥1例,合并右心室雙出口、肺動脈狹窄1例,合并肺動脈閉鎖、室間隔缺損、PDA 1例。其中合并PDA患者動脈導管均連接正常側肺動脈(表1)。
2.主動脈弓 左位主動脈弓4例,其中2例為左側肺動脈缺如,2例為右側肺動脈缺如;右位主動脈弓3例,均為左肺動脈缺如。
3.患側肺組織血供 病例5縱膈無明顯偏移,患側肺血輕度增加,其余病例縱膈均向患側偏移,患側胸廓較對側略小,透亮度稍減低,肺紋理模糊。
病例5患側肺血供由2條粗大體肺側枝供應,由降主動脈發出,分別供應左上肺及下肺,左上肺及下肺動脈在肺門部無交通。2條側枝均無明顯狹窄,直徑分別為4mm及7mm,肺動脈壓力與主動脈壓力一致。肺內動脈分支正常無明顯器質性肺動脈高壓表現。其余病例均由支氣管動脈、肋間動脈及胸廓內動脈發出細小體肺側枝供應部分肺組織。

表1 7例UAPA患者的臨床資料
討 論
肺動脈系統的不同部位其胚胎學來源不同。主肺動脈來源于主肺間隔的形成將動脈干的分隔為主動脈及肺動脈,肺內動脈分支起源于肺芽(肺血管團),左、右肺動脈則由第六對動脈弓近端發育而來,其中第6對動脈弓的近端發育為左右肺動脈連接主肺動脈及肺門部肺動脈,第6對動脈弓的遠端形成動脈導管連接主動脈及同側肺動脈[8-9]。UAPA被認為是一側第六對動脈近端未發育或異常退化使同側肺動脈未發育,導致第六對動脈弓遠端與肺門部肺動脈直接相連,即動脈導管與肺門部肺動脈相連供應同側肺組織血供。對側第六對動脈弓近端及遠端發育正常,即主肺動脈延續為對側肺動脈并與動脈導管相連[6](圖 1)。
出生后,若動脈導管功能或解剖閉合,同側肺動脈失去血液供應,肺動脈逐漸萎縮,甚至肺血管床數量減少,臨床表現為患側肺發育不良,肺容積減少,縱膈偏移。文獻中報道的UAPA病例,在滿意的血管造影、手術探查或尸檢的情況下均能發現動脈導管或動脈韌帶與患側肺門部肺動脈相連[8,10]。患側肺組織血供由細小體肺側枝供應,這些細小側枝作為滋養血管供應遠端肺動脈(圖2)。與胚胎期形成的粗大體肺側枝不同,細小體肺側枝為后天獲得性的,主要因局部肺組織血供減少或嚴重發紺導致的[11]。
胚胎早期第六對動脈弓遠端分別發育為雙側的動脈導管,其中與主動脈弓同側的導管起源于主動脈弓降部,與主動脈弓對側的導管起源于無名動脈或鎖骨下動脈根部。多數情況下均為主動脈弓對側導管退化,表現為動脈導管自主動脈弓降部發出,但某些情況也可出現主動脈弓同側導管退化,對側導管發育表現為動脈導管起自無名動脈或鎖骨下動脈根部[12]。本組7例患者中有5例均表現為主動脈弓對側肺動脈缺如,同側肺動脈發育正常,但缺如側肺動脈是否與主動脈位置相關還需進一步擴大樣本量來驗證。
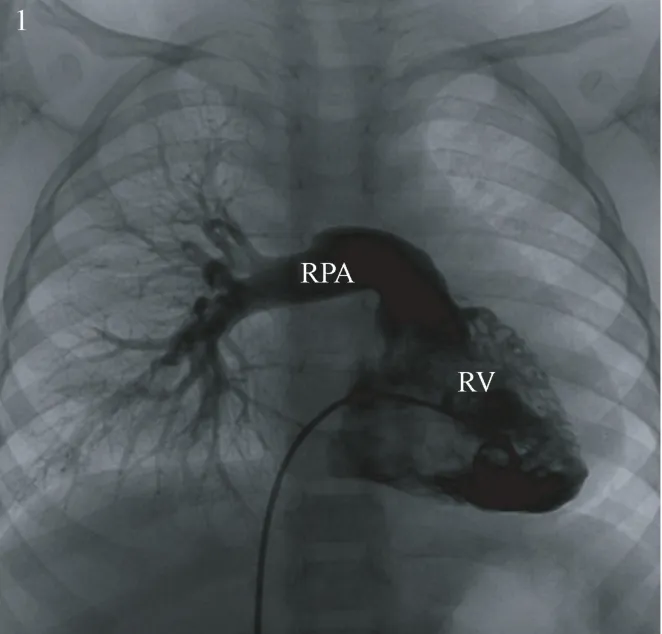
圖1 右心室造影示左肺動脈缺如;
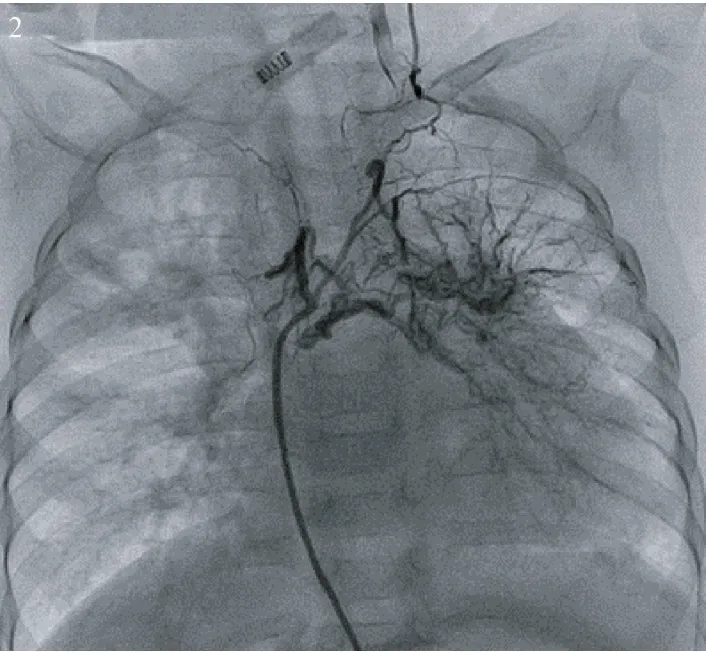
圖2 降主動脈發出細小體肺側枝,發出多支分支供應部分左肺
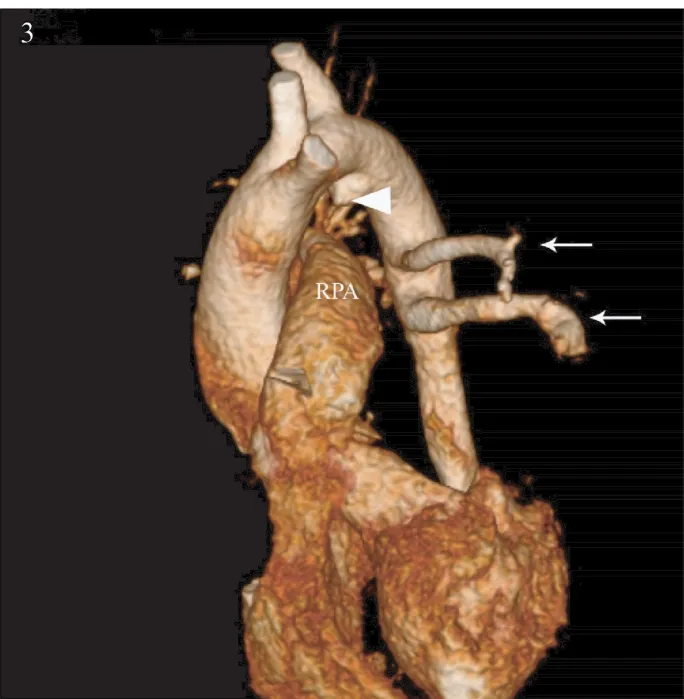
圖3 心臟CT示左肺動脈缺如,動脈導管連接右肺動脈,兩條粗大體肺側枝起源于降主動脈,供應整個左肺血供;

圖4 降主動脈造影示2條粗大體肺側枝起源于降主動脈,分別供應左上及左下肺,遠端肺動脈分支正常,無明顯器質性肺動脈高壓表現。“△”示動脈導管未閉,“←”示粗大體肺側枝
病例5(圖3~4)與文獻報道的UAPA主要有以下不同:①患側肺組織無明顯減小,縱膈并無明顯移位,肺血輕度增多。②患兒肺血由兩條粗大體肺側枝供應,肺門部肺動脈分支異常,③鎖骨下動脈根部未見動脈導管殘端。④無細小體肺側枝形成。從胚胎學角度來講,此例UAPA患者與文獻報道的病例的胚胎學機制不同。在胚胎發育早期,在第六對血管弓發育之前,原始的肺血管團通過節間動脈與降主動脈相連,保證原始肺組織的血供,當第六對動脈弓遠端即動脈導管發育后,節間動脈退化、消失。當第六對動脈弓遠端未能發育時,節間動脈保留連接體循環和肺循環,即體肺側枝形成[13-14]。我們認為此患者的胚胎學機制為:右側第六對動脈弓近端及遠端發育均正常,形成動脈導管連接右肺動脈,而左側第六對動脈弓近端及遠端均未發育或早期退化,左肺保留與節間動脈的連接。因此,粗大體肺側枝形成供應左肺血供,無左肺動脈及動脈導管形成。
總之,第六對動脈弓病變的范圍決定了UAPA的臨床表現形式。當一側第六對動脈弓的近端及遠端均未發育,臨床表現為粗大體肺側枝形成供應患側肺血供。此類UAPA極為罕見,本病例是國內外文獻的首次報道。當一側第六對動脈弓的近端未發育或早期退化,動脈導管與肺門部肺動脈直接相連,出生后動脈導管一旦閉合,患側肺失去血供臨床上即表現為UAPA,細小體肺側枝逐漸形成,供應部分患側肺血供。

