腺病毒生產工藝改進
薛亮 王愛霞 歸翔剛
摘 要 在293細胞培養體系中感染腺病毒后,繼續保持培養液中一定濃度的葡萄糖提供碳源,以維持宿主細胞更好的生命狀態,促進腺病毒的復制、裝配、釋放,達到提高單批次病毒生產的產量。在病毒活性比穩定的前提下,改進后病毒顆粒數(產量)有41.1%的提升。
關鍵詞 293細胞 腺病毒 殘糖控制
中圖分類號:Q813.11 文獻標志碼:A 文章編號:1006-1533(2018)15-0072-03
Improvement of the process for adenovirus production
XUE liang*, WANG Aixiang, GUI Xianggang
(Shanghai Sunway Biotech Co., Ltd., Shanghai 201206, China)
ABSTRACT After infection of adenovirus in the 293 cell culture, a certain concentration of glucose was continuously supplied in the culture medium to maintain the host cell in a better growth condition so as to promote the replication, assembly and release of the adenovirus and to improve the yield of single-batch virus production. The number of virus particles (production) could be improved by 41.1% on the premise of a stable virus activity ratio.
KEY WORDS 293 cell; adenovirus; residual sugar control
隨著生物制藥的普及和發展,病毒活載體疫苗的研制成為基因工程疫苗研制的熱點,其中,腺病毒由于具有獨特的優勢,成為疫苗載體應用中不可缺少部分[1]。腺病毒是無包膜的線性雙鏈DNA病毒,在自然界廣泛分布,對人致病性小,不誘導癌變,較為安全,不整合入細胞基因組,遺傳毒性低,宿主范圍廣,轉染效率高,易于制備、純化[2]。并且,腺病毒因其宿主細胞廣,繁殖滴度高,裝載容量大,成為近年來病毒載體研究熱點[3]。直接將腺病毒載體導入人體內表達目的基因,治療惡性腫瘤、心血管疾病或一些遺傳疾病已取得可喜進展[1];利用腺病毒載體在包裝細胞293中表達分泌性蛋白質,如蛋白酪氨酸激酶1C等亦成為生產重組蛋白的一條途徑。因此,完善293細胞的大規模培養技術及腺病毒擴增技術具有越來越重要的市場意義[4]。腺病毒的生產以細胞感染病毒為分水嶺可分為細胞培養和病毒培養2個階段, 細胞感染病毒后,病毒的釋放時機及收獲等的生產工藝參數一直是業內關注的重點,而通過生產工藝的不斷改進降本增效也已成為業內的共識。本研究主要探討在細胞感染病毒后,在培養液中繼續保持一定濃度的葡萄糖,從而達到提高單批次病毒生產產量。
1 材料與方法
1.1 材料
14 L CelliGen Plus生物反應器、Disk載體(NBS公司);胎牛血清(美國Hyclone公司);DMEM高、低糖培養基、胰蛋白酶(美國Gibco公司);葡萄糖試劑盒(上海名典生物工程有限公司);分光光度計(上海尤尼克儀器有限公司)。
1.2 方法
1.2.1 原生產工藝
采用CelliGen Plus的生物反應器系統及Disk載體(兜籃式載體貼壁培養方式)培養293細胞,上罐細胞總量大1×109個細胞,于37 ℃、攪拌轉速120 r/min、通氣量(混合氣體總量)0.4 L/min、工作體積10 L、含10%胎牛血清的DMEM高糖培養液(葡萄糖含量4.5 g/L)培養, 24 h后開始用含10% 胎牛血清的DMEM高糖培養液灌注培養6~9 d(根據每批次的細胞狀態而定),當體系內細胞量處于飽和狀態(根據糖耗值判斷),接入病毒感染活性濃度3.16×1011 TCID50/ml的腺病毒懸液50 ml。病毒感染8 h后恢復對培養體系的灌注,灌注用的培養液是含5%胎牛血清的DMEM高糖培養液,逐步降低灌注量,約48 h后采用含2% 胎牛血清的DMEM低糖培養液(葡萄糖含量含量1 g/L)灌注培養,72 h后檢測體系內病毒顆粒數,當反應體系內腺病毒濃度達到1×1010 vp/ml時,開始連續收獲系統內的灌注打出液(病毒液),灌注體積(收獲量)是4 L/d,收獲約4 d左右,當反應體系內的用氧量回復到初始狀態(罐內無細胞生長跡象)時,終止培養。
感染病毒后每24 h檢測系統內葡萄糖含量,發現在0~48 h內,由于用高糖培養液灌注,系統內殘糖量在0.7 g/L左右,而48 h開始,用低糖培養液液灌注后,系統內的殘糖量在0.05 g/L,甚至更低,處于無糖狀態。
1.2.2 改進后生產工藝
細胞培養階段按1.2.1中的工藝操作,病毒感染后,每24 h取樣檢測系統內葡萄糖含量,48~120 h期間,仍然使用DMEM高糖培養液灌注,該段培養過程中,控制系統內殘糖在0.3~1.0 g/L左右。在培養的后期(120 h開始)可采用含2%胎牛血清的DMEM低糖培養液(葡萄糖含量1 g/L)灌注培養,直至培養終止。
1.3 檢測方法
1)以培養過程中用氧量的比例(系統自帶自動測定)來對比改進前后培養體系內相同時段內細胞的生長趨勢。
2)用顆粒數檢測和病毒活性檢測(TCID50)來觀察改進后單批次病毒的產量及活性變化[5]。
2 結果
生物反應器在滅菌后將通氣量設定在0.4 L/min。當將系統溶氧值設定在50%時,系統會利用外接的空氣、氧氣、氮氣自動調節系統內的溶氧狀態,使之達到設定的溶氧值(50%)。由于內部沒有細胞生長,達到平衡后,此時三種氣體的用量占比(總流量是0.4 L/min)是固定值,正常情況下此時氧氣用量是0,由空氣和氮氣相互混合控制體系內的溶氧值。當接種細胞后,隨著細胞生長耗氧,氮氣的用量逐步下降,遂開始用氧。由于系統內除293細胞外,沒有其他生物體代謝耗氧,所以可通過氧氣用量占比判斷系統內細胞生長情況。用氧占比高表明系統內活細胞數量大;反之,系統內活細胞數量少。
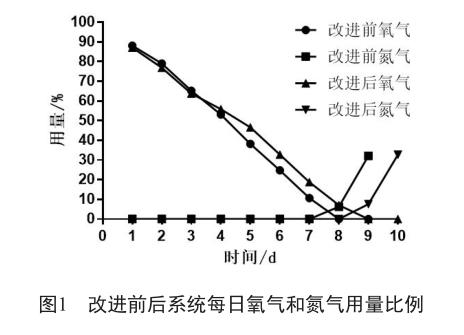
用改進后的方法連續生產7批次,收集每批次感染病毒后系統每天的用氧情況,取均值,與之前生產的11個批次對應的數據比較(圖1)。
結果表明,改進后的工藝從第4天開始,用氧量的下降趨勢明顯小于改進前,并且用氧量回歸到系統生產前調試階段時初始值的時間平均比改進前延后了24 h,表明在之后相同的培養時段,改進后系統內的活細胞數量多于改進前,并有延遲凋亡的跡象。
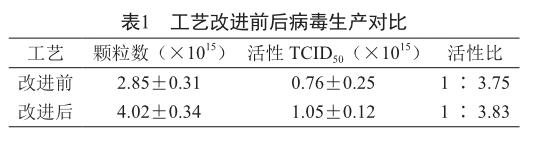
用改進后的方法連續生產7批次,與改進前生產的11個批次對比見表1。
改進后工藝生產的病毒顆粒數(產量)與改進前工藝相比有41.1%的提升,病毒活性比沒有太大變化,表明新工藝可提高單批次的病毒產量,對病毒的活性沒有影響。
3 分析與討論
3.1 原工藝設計思路
原工藝制定受產品研發階段的培養模式影響較大。
產品研發階段,使用培養皿小試生產腺病毒。293細胞生長時期,用DMEM高糖(葡萄糖含量4.5 g/L)培養,細胞利用葡萄糖作為碳源,代謝產物為乳酸。而在293細胞感染病毒后,如繼續使用DMEM高糖培養液,會造成細胞代謝旺盛,產生的酸性環境,從而導致病毒的衣殼發生裂解,對病毒的擴增及最終的活性起到負面作用[6]。
用以下兩個小實驗來了解293細胞糖代謝后的產酸情況及對病毒生產的影響。
1)在培養皿體系用DMEM高糖測試細胞生長后產酸結果:293細胞以1∶2傳代,72 h培養(未感染病毒),代謝后的培養液檢測,pH在6.85左右。
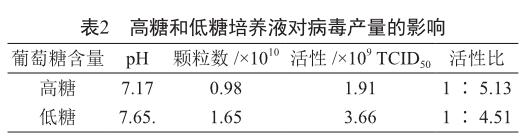
2) 對培養皿體系中的293細胞接入腺病毒時分別使用DMEM高糖(葡萄糖含量4.5 g/L)和DMEM低糖培養液(葡萄糖含量1 g/L),培養48 h以上,同時收獲,分別檢測pH、病毒顆粒數和活性(表2)。
表2所示,病毒培養階段使用高糖培養液的培養環境產酸較多,而用高糖培養液培養對應的病毒顆粒數和活性都較低,所以在當初工藝設計時,感染病毒后改用DMEM低糖培養,通過減少碳源量降低乳酸代謝產物,避免過酸環境影響到病毒的產量,該設計不僅用于培養皿制備腺病毒,后來也應用于生物反應器的大規模病毒生產。
3.2 原工藝設計的合理性和局限性
1) 合理性 在培養皿培養過程中,除了少量的氣體交換外,既沒有其他營養物質的補充和交換,也沒有酸堿調節體系,減少碳源似乎是降低體系內酸度的唯一方法。所以在一次性收獲的培養皿制備中具有一定的合理性(可避免細胞過度產酸影響病毒產量)。
2) 局限性 但利用生物反應器大規模培養,細胞培養階段和病毒擴增階段都采用灌注培養方式(新鮮培養液pH在8.0~8.5間),并配有補堿(8%碳酸氫鈉溶液)系統,兩者都可以中和體系中(系統pH控制在7.0~7.4)的乳酸,所以這種設計意義不大,相反低糖環境易造成細胞低代謝水平會引起細胞過早凋亡,在連續收獲的反應器體系中會影響病毒的產量。
3.3 討論
從上述數據對來看,在大規模灌注培養腺病毒的工藝中,感染病毒后0~120 h之間系統內的含葡萄糖量(碳源)決定了這批次可有效用于腺病毒擴增的活細胞數量和生命狀態,而這些與最終腺病毒的產量有著直接關系。細胞感染病毒后直徑從15 mm增至17 mm。在感染8~48 h期間,細胞對葡萄糖的消耗以及乳酸的生成量均增加了30%~100%,氧氣的消耗和三磷酸腺苷的生成也有類似的趨勢。因此,在培養病毒階段更要注意營養物質的適度補給,一方面及時補充葡萄糖,因為在病毒擴增過程中,一旦葡萄糖耗竭會導致病毒擴增的停止[7]。病毒從接入細胞培養系統后,要經過入侵細胞、細胞內復制(病毒蛋白外殼和病毒核酸)、細胞內裝配和破裂宿主細胞等幾個階段,這個過程約48~72 h。如果在48~120 h內灌注1 g/L的低糖培養液,低碳源的環境加速了細胞的凋亡,降低了細胞內病毒復制、裝配的成功率;而在48~120 h內依然灌注4.5 g/L的高糖培養液,改善系統內細胞代謝條件,維持細胞的生長狀態,可為腺病毒的復制、裝配提供更多的時間和穩定的宿主生長條件,從而提高病毒產量。
另外,CelliGen Plus生物反應器系統的特點是啟動后,難以從系統中取樣計算細胞量(打開罐體將會破壞無菌生長環境),因而培養過程中采用檢測系統內葡萄糖含量值來判斷細胞生長情況。盡管病毒感染時,病毒細胞數比值即感染復數(MOI)按1∶20估算,實際情況下仍有大量正常細胞未被感染[8-9],所以感染病毒后繼續保持系統內的含糖量有利于維持過量的細胞的狀態,利用病毒的二次感染也是提高批次病毒產量的途徑之一。
為了在病毒感染后對系統內的殘糖控制在0.3~1 g/L的范圍內,除了改用高糖培養液外,還在某些時段增加了灌注量,這也就相應增加了一些收獲液的體積,從而增加了后期純化的工作量,可考慮使用更高糖濃度的培養液或單獨補糖來解決。
參考文獻
[1] 袁子國, 張秀香, 高勝言, 等. 腺病毒載體的研究進展與展望[J]. 吉林畜牧獸醫, 2008, 29(1): 13-14.
[2] 秦娜. ndrg2兩亞型重組腺病毒的構建及其抑制人腦膠質瘤細胞系生長的研究[D]. 西安: 第四軍醫大學, 2009.
[3] 張立堂. 用于結腸癌個性化治療的溶瘤腺病毒載體的構建: 個性化治療之一[D]. 杭州: 浙江理工大學, 2008.
[4] 李慧文. 論在生物制藥中細胞大規模培養技術的應用[J].黑龍江科技信息, 2014(36): 121.
[5] 薛惠斌, 施軍霞, 朱文川, 等. 腺病毒CNHK200-hEndostatin質量控制方法的研究[J]. 第二軍醫大學學報, 2007, 28(9): 1011-1014.
[6] 王海偉, 宋姍姍, 曾健雄, 等. Asia1型口蹄疫病毒耐酸株的篩選及其耐酸表型的分子決定因素[C]// 北京: 第十屆全國病毒學學術研討會論文集, 2016: 224.
[7] 祁麗, 顧銘, 叢威. 重組腺病毒生產技術研究進展[J]. 過程工程學報, 2004, 4(5): 475-480.
[8] 張瓊宇, 馬珊珊, 唐小標, 等. 病毒感染復數影響腺病毒感染T淋巴細胞效率的初步研究[J]. 生命科學研究, 2017, 21(4): 312-317.
[9] 陳科達, 吳潔, 王一虎, 等. 用生物反應器擴增重組腺病毒的優化工藝方法: CN103160478A[P]. 2013-06-19.

