烏司他丁預處理對肝缺血再灌注大鼠急性腎損傷的預防作用
崔龍海,李浩,韓龍哲,李哲浩
(延邊大學附屬醫院,吉林延吉133000)
肝臟缺血-再灌注(I/R )損傷是全身性的炎癥反應,其機制尚未完全闡明。肝移植及肝癌切除術中常需阻斷肝臟血流降低術中大出血的風險,但常影響肝臟及肺臟、心臟、腎臟、小腸、胰腺等遠端器官的功能[1,2]。I/R時肝臟及門靜脈可產生酸性代謝產物、內毒素、過氧化產物、腫瘤壞死因子(TNF-α)和其它炎癥介子[3,4]等有害介質,肝血流恢復后有害介質可導致遠端器官發生急性功能損害。I/R 導致的腎臟損傷嚴重影響患者手術效果及生存率[5]。谷胱甘肽(GSH )、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)活性和肌酐(Cr)、尿素氮(BUN)含量以及尿量是評估肝腎功能的指標,谷胱甘肽過氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)是常用的氧化應激指標。烏司他丁(UTI)是從健康成年男性尿液中提取純化得到的一種廣譜蛋白酶抑制劑,能同時抑制胰蛋白酶、磷脂酶A2、彈性蛋白酶等多種酶的活性、抑制炎性介質過度釋放、清除氧自由基,對重要臟器缺血性損傷具有保護作用[6,7]。白細胞介素18(IL-18)是一種致炎因子,缺血性組織中常表達升高,過度表達可導致局部組織繼發性損傷[8]。研究[9]發現,血清IL-18和急性腎損傷(AKI)危重患者的住院死亡率有關,IL-18是AKI早期特異性的生物標志物之一。本課題組前期研究發現,肝臟I/R損傷模型大鼠血清IL-18水平與ALT、AST活性均升高,尿量降低,但其具體作用機制尚不明確。本研究觀察了UTI預處理對肝I/R大鼠急性腎損傷的保護作用,并探討其可能作用機制。現將結果報告如下。
1 材料與方法
1.1 動物、試劑及儀器 清潔級Wistar大鼠30只(延邊大學實驗動物中心提供),雌雄各半,體質量(300±20)g。IL-18、TNF-α試劑盒為武漢博士德生物工程有限公司產品,UTI注射針劑為廣州天普生化醫藥股份有限公司產品。
1.2 大鼠分組及UTI給藥方法 大鼠在IVC飼養系統適應性飼養1周后,隨機分為假手術 (SO)組、I/R組、UTI組。UTI組造模前30min預處理 3萬 U/kg UTI(2 mL無菌生理水溶解,右側隱靜脈給藥),SO組和I/R組給予等體積生理鹽水。I/R組、UTI組采用Pringle法制備大鼠肝臟I/R損傷模型:所有實驗動物術前禁食12 h、10%水合氯醛麻醉、常規消毒、隱靜脈置管。取腹部正中于尖突下0.5 cm處縱向切約3 cm長的切口,暴露肝門。I/R組和UTI組參照Pringle法阻斷肝臟血流30 min,再灌注2 h。SO組僅解剖分離肝十二指腸韌帶。
1.3 觀察指標 造模后復流2 h,處死各組大鼠,下腔靜脈采集血液、低溫離心分離血清、-80 ℃保存。取肝臟、腎臟組織,采用比色法檢測血清和肝腎組織Cr、BUN、ALT、AST、GSH、GSH-Px、SOD、MDA。采用ELISA法測定血清和腎組織IL-18、TNF-α。行膀胱穿刺并收集測算三組尿液體積,HE染色法觀察肝、腎臟組織病理學改變。
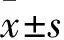
2 結果
2.1 三組血清ALT、AST活性和BUN、Cr含量變化 見表1。
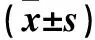
表1 三組血清ALT、AST活性和BUN、Cr含量變化
注:與SO組比較,*P<0.05;與I/R組比較,#P<0.05。
2.2 三組血清和腎組織IL-18、TNF-α含量及尿量比較 見表2。
2.3 三組清SOD和腎組織、GSH-Px、GSH、MDA含量變化 見表3。
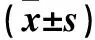
表2 三組血清和腎組織IL-18、TNF-α含量及尿量比較
注:與SO組比較,*P<0.05;與I/R組比較,#P<0.05。
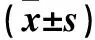
表3 各組大鼠血清SOD和腎組織、GSH-Px、GSH、MDA含量變化
注:與SO組比較,*P<0.05;與I/R組比較,#P<0.05。
2.4 三組肝臟、腎臟組織形態學變化 SO組肝臟組織細胞索排列有序,組織結構和細胞形態基本正常。I/R組肝臟組織細胞索排列無序,有明顯的細胞壞死灶,炎性細胞聚集成團。UTI組肝臟病變明顯輕于I/R組。見圖1。SO組腎臟組織細胞形態基本正常。I/R組腎臟組織腎小球及腎間質水腫,腎小管上皮水腫、擴張、變形。UTI組腎臟病變程度輕于I/R組。見圖2。

注:箭頭處為壞死灶
圖1三組肝臟組織病理學變化(×100)

注:箭頭處為壞死灶
圖2三組腎臟組織病理學變化(×100)
3 討論
肝I/R損傷是肝臟外科手術、休克、創傷以及器官移植中常見的病理過程,缺血期鈣超載、氧自由基的大量產生、生物膜的破裂、各種酶的漏出和炎性介質大量釋放等均與其有關[10],其中氧化應激與炎癥反應在I/R損傷過程中起重要的作用。灌流不足可導致腎臟缺血,腎小球濾過率降低,從而發生急性腎功能障礙。肝I/R損傷可引起再灌注后綜合征,急性腎損傷是其中的一個重要并發癥[11,12]。Kupffer 細胞是肝內數量最多的定居巨噬細胞,在Toll 樣受體的參與下Kupffer 細胞激活炎癥反應細胞因子,其中TNF-α對觸發炎癥級聯反應起重要作用,TNF-α附著于肝細胞表面受體,誘導產生大量的嗜中性粒細胞趨化因子、活性氧族及NF-κB等,直接造成肝損傷。而且聚集細胞間黏附因子(ICAM-1)、血管細胞黏附因子(VCAM-1),并激活中性粒細胞進入缺血后的肝臟,損傷肝細胞[13]。IL-18具有多種組織免疫活性,肝I/R時由肝臟Kuffer 細胞以及肝外巨噬細胞產生,缺血性組織中表達升高[14]。IL-18的過度表達可延遲移植腎的功能恢復[15],IL-18是少尿型急性腎損傷早期特異性的生物標志物。本研究中,I/R組大鼠血清和腎組織IL-18、TNF-α表達明顯高于SO組,且隨IL-18含量升高而尿量減少。鏡下可見I/R組大鼠肝組織存在明顯肝細胞壞死灶,并伴有大量的炎性細胞浸潤,腎小球水腫以及腎小管上皮水腫、變形、擴張。表明IL-18、TNF-α等炎癥因子的過度產生及IL-18、TNF-α等誘導產生的各種細胞毒性可能是造成肝I/R后繼發急性腎損傷的直接原因。
肝臟I/R時由于組織細胞缺血缺氧和ATP分解增加,以及其分解產物在缺血組織內大量堆積,使氧自由基在短時間內爆發性增多,引起生物膜脂質過氧化。由于脂質過氧化使細胞膜和細胞質膜的完整性受到破壞,改變膜的流動性和通透性,造成微循環障礙,導致細胞壞死。體內抗氧化系統包括細胞內抗氧化酶和非酶性抗氧化劑,SOD和GSH-Px 是內源性抗氧化酶,其活性高低反映組織清除氧自由基的能力。GSH是人類細胞質中自然合成的一種肽,在過氧化物酶的作用下,通過巰基氧化分解體內的超氧基團,中和氧自由基對組織的損害,并能轉化成容易代謝的酸性物質,加速自由基的排泄[16]。MDA是氧自由基攻擊生物膜引發脂質過氧化反應的產物,組織中的含量可反映脂質過氧化程度。本實驗結果I/R組大鼠血清和腎組織SOD、GSH-Px 活性和GSH含量均低于SO組,MDA含量高于SO組。表明抗氧化物質的減少和氧自由基的大量產生是肝I/R后急性腎損傷的重要原因,后者過度產生會加重組織繼發性損傷。
UTI是肝臟分泌的一種機體內源性蛋白酶抑制劑,具有廣泛的抑酶譜,能夠抑制蛋白酶活性,抑制IL-1、IL-6、IL-10、TNF-α、血小板活化因子等細胞因子的釋放,穩定溶酶體膜,減輕微循環障礙和全身炎癥反應綜合征,維持氧化-抗氧化系統的平衡從而減輕缺血性組織損傷,改善腎小球濾過功能和腎小管重吸收[17~19]。有臨床觀察報道,UTI對急性腎損傷有較好的療效,縮短ICU住院時間,降低死亡率[20]。有細胞實驗研究報道,UTI通過促進細胞增殖加快受損細胞的修復,減少毛細血管通透性,減少血管內液向組織轉移,減輕組織水腫[21]。本研究中,與I/R組比較,UTI組大鼠血清和腎組織中IL-18、TNF-α 表達下調,ALT、AST酶活性和BUN、Cr、MDA含量降低,尿量和SOD、GSH-Px、GSH含量增多,肝腎組織病理學改變明顯減輕。表明UTI對肝I/R后繼發腎損傷具有保護作用。猜測其可能作用機制為,UTI通過減弱肝I/R對Kuffer細胞的刺激,下調IL-18、TNF-α水平及增加尿量等途徑減輕肝I/R后急性腎損傷。 同時UTI可抑制IL-18誘導T細胞、NK細胞、中性粒細胞等各類炎癥因子的過度產生和釋放;阻斷IL-18、IL-6、NF-κB、FN-γ、TNF-α 等炎癥因子的級聯效應;提高機體抗氧化能力、改善微循環及增加尿量等途徑減輕肝I/R后急性腎損傷。
綜上所述,UTI預處理可有效減輕大鼠肝I/R后急性腎損傷,其機制可能與UTI抑制IL-18、TNF-α等表達,促進GSH 、GSH-Px、SOD表達有關。

