肝細胞肝癌組織中Per2、CD133蛋白的表達觀察
劉利平,張悅,劉林森,郭躍華,張育森,鮑世韻
(暨南大學第二臨床醫學院深圳市人民醫院,廣東深圳 518000)
環境因素是腫瘤的發病原因之一。生物鐘是人體內的生物節律,與自然界的日出、日落相同步,受多個生物鐘基因調控[1]。研究[2,3]發現,生物鐘紊亂的人群(如倒夜班)更易患乳腺癌、前列腺癌、膽管癌等惡性腫瘤。Per2基因是生物鐘基因家族中重要的成員之一[4]。研究[5]發現Per基因除了參與生物鐘調控外,還可抑制腫瘤細胞的生長和增殖,誘導細胞凋亡,在胰腺癌、胃癌、結直腸等多種腫瘤組織中呈低表達狀態,被認為是潛在的抑癌基因。目前Per2在肝癌中的表達及意義國內尚未見文獻報道。CD133是肝癌干細胞的標記物之一,在肝癌組織中高表達,與肝癌患者的預后呈負相關,CD133高表達的患者較易復發和轉移,預后較差[6]。Per2同CD133在肝癌組織中的相關性目前未見報道。本研究觀察了肝細胞肝癌組織Per2 的表達變化,并分析其與CD133的相關性。
1 資料與方法
1.1 臨床資料 選取2011~2015年在深圳市人民醫院肝膽外科行肝癌根治性手術且經病理證實的120例肝細胞肝癌患者,其中男97例、女23例,年齡32.6~70.2,平均53.4歲;乙肝表面抗原呈為陽性,HCV抗體陰性。所有患者術前均未接受過化療、放療、靶向治療及免疫治療。納入標準:病理診斷為原發性肝細胞癌;未見遠處轉移;接受了肝癌根治術;手術切緣陰性,未見腫瘤細胞。排除標準:接受過放療、化療、免疫治療、靶向治療或中藥治療;乙肝表面抗原陰性;HCV抗體陽性;同時合并其他類型的惡性腫瘤;隨訪信息不全。術中保留120例患者癌組織、癌旁組織(距腫瘤距離均>2 cm)標本。
1.2 肝細胞肝癌癌組織及癌旁正常組織Per2、CD133檢測 采用免疫組化染色法檢測癌組織及癌旁正常組織Per2、CD133,所有操作均嚴格按照使用說明書進行。采用PBS代替一抗作為陰性對照。Per2、CD133蛋白在肝癌組織中均以細胞質表達為主,Per2根據細胞質的染色程度及染色細胞的百分率來進行評分[6]。Per2陽性細胞百分比<5%計0分,5%~25%計1分,26%~50%計2分,51%~75%計3分,>75%計4分;細胞染色無色計0分,黃色計1分,棕黃色計2分,棕褐色計3分。兩者相乘即為最終分數(代表蛋白相對表達量),0~4分視為低表達,5~12分視為高表達。CD133根據陽性細胞比例和染色深淺評為 0~3分,0分:陽性細胞不超過1%;1分:陽性細胞超過1%,細胞呈黃色;2分:陽性細胞超過1%,細胞呈棕黃色;3分:陽性細胞超過1%,細胞呈棕褐色。其中0和1分定義為低表達,2和3分定義為高表達[7]。
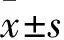
2 結果
肝細胞肝癌癌組織及癌旁正常組織Per2蛋白相對表達量分別為5.05±0.30、7.18±0.31,二者比較,P<0.05。癌組織中Per2蛋白低表達58例(48.3%)、高表達62例(51.7%)。肝細胞肝癌癌組織及癌旁正常組織CD133蛋白相對表達量分別為1.68±0.11、0.82±0.09,二者比較,P<0.05。癌組織中CD133蛋白低表達67例(55.8%)、高表達53例(44.2%)。
Per2蛋白表達與肝細胞肝癌患者臨床病理參數的關系見表1。Per2蛋白表達與肝細胞肝癌患者腫瘤直徑、腫瘤數目、門靜脈侵犯有關(P均<0.05)。

表1 Per2蛋白表達與肝細胞肝癌患者
Kaplan-Meier時間生存曲線分析結果顯示,癌組織中高表達Per2者、癌組織低表達Per2者總體生存率(OS)分別為(34.4±2.5)、(26.9±2.3)個月,二者比較,P<0.05;癌組織中高表達Per2者、癌組織低表達Per2者無瘤生存率(DFS)分別為(16.3±1.7)、(9.72±1.41)個月,二者比較,P<0.05。
相關性分析結果顯示,Per2與CD133在原發性肝癌中的表達呈負相關(r=-0.569,P<0.05)。
3 討論
生物鐘是人類在進化過程中與自然界同步而形成的內在生物節律,在體溫、呼吸、血壓、進食、睡眠、血糖、內分泌等諸多穩態中發揮著重要作用[8]。生物鐘對人體精準調控的分子機制在于生物鐘基因及其編碼蛋白構成了自主調節轉錄-翻譯反饋通路[9]。目前已經發現的生物鐘基因有CLOCK、BMAL1、Per1、Per2、Per3、Cryptochrome 1 (Cry1)、Cryptochrome 2 (Cry2)、NPAS2、Casein Kinase 1 ε(CKIε)、timeless(Tim)、Rev-Erb和DEC等[10],以上基因通過轉錄和轉錄后調控形成的自反饋環來調節細胞內的生物節律。生物鐘基因表達紊亂可導致生物節律異常,可能與腫瘤的發生、發展有關[11]。
period(PER)基因首先在果蠅的X染色體中發現,果蠅PER基因存在三種突變型,分別為perO、perL和perS,三種突變型的表型分別為晝夜節律消失、晝夜節律延長及晝夜節律縮短。隨后,小鼠和人的Per基因被發現,且存在Per1、Per2、Per3 這3種基因型[4]。后續研究[12]發現Per基因除參與生物鐘調控外,還能抑制腫瘤細胞的生長和增殖,誘導細胞凋亡。Per2基因在結直腸癌、胃癌、非小細胞肺癌、等多種腫瘤中呈低表達[4,8,9]。Su等[13]研究發現,沉默口腔鱗癌 SCC15細胞 中PER2的表達后,增殖相關基因Ki-67、 轉移相關基因MDM2、MMP2、癌基因c-Myc、抗凋亡蛋白Bcl-2、血管生成相關基因VEGF的表達均上調,抑癌相關基因 p53、凋亡相關基因 Bax、轉移抑制基因TIMP-2 的表達均下調;且Per2沉默后的SCC15細胞成瘤能力明顯增強。Per2沉默的肺腺癌細胞A549中(PI3K)/AKT/mTOR信號通路被激活,細胞對順鉑表現出一定的耐藥性。在A549/DDP耐藥細胞中上調Per2的表達可抑制(PI3K)/AKT/mTOR通路的活性和逆轉順鉑的耐藥性[14]。
本研究結果發現,肝癌組織中的Per2 mRNA及蛋白的相對表達量均低于低于癌旁組織,表明Per2低表達可能與肝癌的發生有關。進一步分析發現Per2在多發、腫瘤直徑>5 cm及伴血管侵犯的肝癌中陽性表達率更低,提示Per2低表達可能是肝癌預后不良的因素之一。生存分析顯示Per2低表達的肝癌患者無瘤生存率和總體生存率均明顯降低。提示Per2可以作為判斷肝癌患者術后預后的預測因子。肝癌是一個較易復發和轉移,惡性程度非常高的腫瘤。肝癌術后檢測腫瘤組織中Per2的表達,對低表達的患者加強隨訪和監測,有可能較早的發現復發和轉移的病灶,較早地給予處理可以改善患者的預后。
腫瘤干細胞是腫瘤發生、發展的根源。腫瘤干細胞與普通腫瘤細胞的鑒別依賴于其表面的干細胞標記物[15]。CD133是肝癌的干細胞標記物之一,是一種5次跨膜糖蛋白,在1997年分別從人造血干細胞和CD34+的小鼠神經干細胞中分離得到,并分別命名為AC133和prominin-1[16]。進一步研究發現,人類的AC133和小鼠的prominin-1在細胞和亞細胞結構上的分布相似,基因具有高度相似性。人的prominin-1基因又稱為CD133[17]。CD133在正常肝組織中陰性表達,在部分慢性肝炎、肝硬化組織中陽性表達,可能與肝臟再生有關,這部分表達CD133的肝細胞可能是一種具有自我更新和定向分化能力的原始肝細胞[15]。CD133在肝癌組織中的表達明顯高于其在癌旁、肝炎和肝硬化組織,顯示CD133陽性的肝癌細胞具有更高的細胞增殖能力和更強的侵襲轉移能力。Chan等[19]研究發現,小肝癌和合并肝硬化的肝癌組織中CD133蛋白表達升高,CD133陽性的肝癌患者預后較差,CD133可作為判斷肝癌術后復發和轉移的有效標記物。
綜上所述,肝細胞肝癌組織中Per2低表達、CD133高表達。Per2可作為判斷肝癌患者預后的標記物之一。Per2和CD133在肝細胞肝癌中呈負相關,Per2可能對肝癌干細胞的增殖起抑制作用。

