細胞因子在肝泡球蚴病肝組織邊緣帶的表達及意義*
張 萍,樊海寧,王海久,王 展,乜國雁,張朝霞,王 花
(1.青海衛生職業技術學院,西寧 810000;2.青海大學附屬醫院肝膽胰外科,西寧 810001; 3.青海省包蟲病研究重點實驗室,西寧 810001;4.青海省人民醫院泌尿外科,西寧 810007)
肝泡球蚴病(HAE)是一種危害極大的致死性寄生蟲病,在我國西北地區尤其是青藏高原地區廣泛流行。該病幾乎均原發于肝臟,具有與惡性腫瘤尤其是肝癌類似的浸潤和轉移的生物學行為[1]。HAE手術切除率低,病死率高,故有“蟲癌”之稱[2]。有學者認為在HAE病灶邊緣可能存在著“浸潤帶”或“生物學邊界”[3],是有活性的棘球蚴囊蚴賴以生存和增殖的基礎,故邊緣帶成為HAE研究的一個重點。多項研究表明,基質金屬蛋白酶-2(MMP-2)在腫瘤血管生成、侵襲轉移過程中起著重要作用;CD34高表達可促進多種腫瘤新生血管形成。筆者研究MMP-2和CD34在HAE邊緣帶組織的表達,并結合臨床病理特性,探討新生血管在HAE浸潤性生長中的作用。
1 資料與方法
1.1一般資料 收集青海大學附屬醫院、青海省人民醫院2014年7月至2017年7月手術后經病理診斷為HAE的組織及距病灶邊緣5 cm以外的正常肝組織標本各40例。所有患者均知情并簽署知情同意書。其中男16例,女24例;年齡15~57歲,平均(34.6±5.8)歲;藏族32例,漢族8例;19例發生轉移(包括肝內外轉移)。所有患者術前均未接受任何包蟲病藥物治療。
1.2方法
1.2.1試驗方法 采用免疫組織化學SP法。即用型鼠抗人MMP-2 單克隆抗體(ZM-0330)、鼠抗人CD34單克隆抗體(ZM-0046)等購自北京中杉金橋生物技術有限公司。自動組織包埋機(Leica EG1160)及石蠟切片機(Leica 2245)均為德國Leica公司生產;顯微鏡(CX31RBSF)和數碼相機(C-7070 Wide Zoom)均為日本Olympus公司生產。標本經10%甲醛固定,石蠟包埋后4 μm連續切片,行蘇木素-伊紅染色(HE)和免疫組織化學SP染色,同時以磷酸鹽緩沖液(PBS)替代一抗做陰性空白對照。
1.2.2結果判定 每張切片觀察5個高倍鏡視野,參照MATTEM等[4]的方法判定免疫組織化學染色陽性細胞所占的百分數來計算結果。(1)顯色深淺:不顯色或顯色不清為0分,黃色為1分,棕黃色為2分,深褐色為3分;(2)著色細胞占計數細胞百分率:未見著色細胞為0分,≤25%為1分,>25%~50%為2分,>50%為3分。二者之和為0~2分判為陰性,3~6分判為陽性。每張切片均要求有兩位病理醫師采用雙盲法閱片。
1.3統計學處理 采用SPSS17.0統計軟件,計數資料以頻數或百分率表示,比較采用χ2檢驗,相互關聯采用Spearman相關性分析,以P<0.05為差異有統計學意義。
2 結 果
2.1HAE大體標本觀察 HAE病灶由無數小結節或小囊泡(直徑多為1~3 mm)集合,為海綿狀團塊,顏色呈灰白與淡黃色相間,與周圍肝組織分界不清,觸之質地硬似軟骨,刀切常有砂粒樣感覺,切面為淡黃色的壞死區與灰白色發亮的纖維層交錯出現,外觀似蜂巢狀或蟲蝕狀改變,病變中央有時呈膠凍狀。巨塊型的可見灰黃色豆渣樣大片壞死,伴液化,見圖1。
2.2HE染色觀察 病變界限不清,呈浸潤性生長,可見多灶性凝固性壞死和邊緣帶典型泡球蚴肉芽腫。肉芽腫由呈柵欄狀排列的上皮樣組織細胞組成,纖維組織增生明顯,有較多淋巴細胞、漿細胞、巨噬細胞等炎性細胞浸潤,病灶邊緣殘余少量肝組織結構,泡壁周圍肝組織血管擴張充血,見圖2。

圖1 HAE病灶大體標本

圖2 HAE組織HE染色(×200)
2.3MMP-2和CD34在HAE組織中表達 HAE病灶內可見大片凝固性壞死,MMP-2和CD34的陽性表達程度以HAE病灶與正常肝組織交界的邊緣帶最明顯。邊緣帶主要為囊泡壁周圍肉芽腫炎癥細胞和周邊部分殘存肝細胞,MMP-2以細胞質和部分細胞膜呈棕黃色為陽性細胞(圖3);CD34定位于血管內皮細胞的胞質,呈棕黃色,CD34染色內皮細胞呈點狀、線狀、半環狀、環狀散在分布(圖4)。HAE邊緣帶組織中MMP-2陽性表達率為60.0%(24/40),高于病灶旁正常肝組織中陽性表達率為27.5%(11/40),差異有統計學意義(P<0.01)。HAE邊緣帶組織中CD34陽性表達率62.5%(25/40)明顯高于病灶旁正常肝組織中陽性表達率25.0%(10/40),差異有統計學意義(P<0.01)。

圖3 MMP-2在HAE邊緣帶表達(SP,×200)
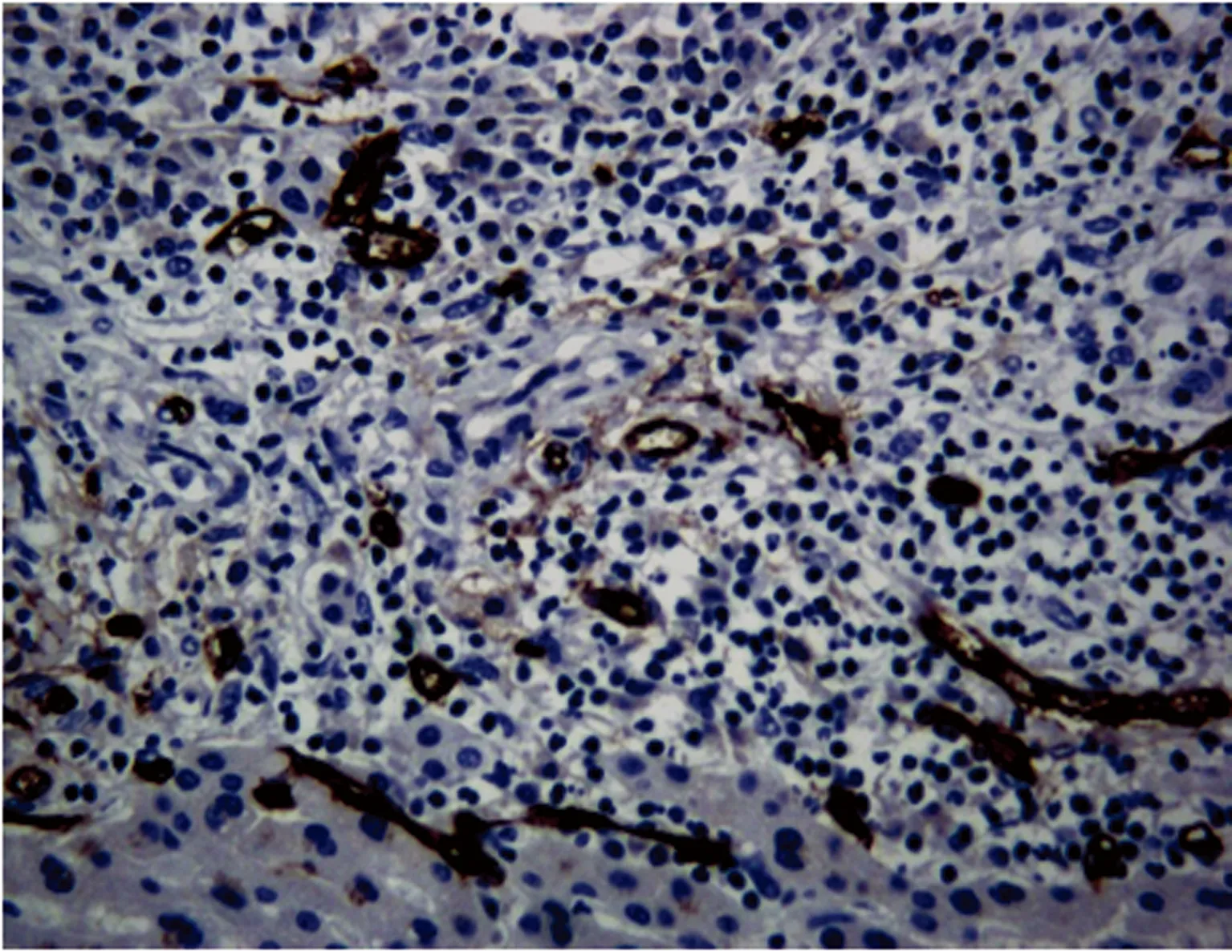
圖4 CD34在HAE邊緣帶表達(SP,×200)
2.4MMP-2和CD34在HAE邊緣帶表達與臨床病理特性關系 在發生轉移的HAE邊緣帶組織中MMP-2、CD34的陽性表達率分別為78.9%(15/19)和78.9%(15/19),明顯高于未發生轉移的MMP-2、CD34的陽性表達率[42.9%(9/21)和47.6%(10/21)],差異有統計學意義(P<0.05);MMP-2和CD34在HAE邊緣帶陽性表達與HAE患者的性別、年齡、民族、甲胎蛋白(AFP)、乙型肝炎病毒表面抗原(HBsAg)、病灶大小等因素無關,見表1。

表1 MMP-2和CD34的表達與HAE臨床病理的關系[n(%)]

續表1 MMP-2和CD34的表達與HAE臨床病理的關系[n(%)]
2.5MMP-2和CD34在HAE組織中表達的相關性 在40例患者中,MMP-2和CD34均為陽性表達的有19例,均為陰性表達的有10例;MMP-2陽性表達和CD34陰性表達的有5例,MMP-2陰性表達而CD34陽性表達的有6例。Spearman相關分析顯示,MMP-2和CD34兩者之間的表達存在正相關(r=0.442,P<0.01)。
3 討 論
惡性腫瘤的發生、發展、浸潤、轉移等生物學行為都與新生血管密切相關,而HAE病灶與腫瘤相比具有相似的生長方式[5]。
MMP-2為鋅離子依賴性內肽酶,能降解血管基底膜和細胞外基質中的Ⅳ型膠原成分,使腫瘤細胞易于突破結構屏障,與腫瘤內血管生成、侵襲、轉移相關[6]。有研究表明,MMP-2基因敲除的小鼠表現出腫瘤組織血管新生能力的減弱從而導致的腫瘤生長減慢[7]。本研究中MMP-2陽性表達率在HAE邊緣帶組織高于正常肝組織(P<0.01);有轉移灶邊緣帶表達高于無轉移灶邊緣帶(P<0.05)。本課題組前期研究表明, MMP-2高表達可能具有促進生物學行為,類似癌細胞的HAE的浸潤和轉移[8]。馬少波等[9]報道,小鼠血清MMP-2水平升高可能與泡狀棘球蚴的浸潤性生長存在相關性。本研究結果提示,HAE邊緣帶MMP-2 的高表達可能使細胞外基質降解加速,破壞基底膜并可能促進HAE新生血管的形成,進而促使HAE的浸潤轉移。
CD34是高度糖基化的Ⅰ型跨膜蛋白,研究表明,CD34不僅具有造血作用,還可以通過促進內皮細胞轉移進而促進血管新生[10]。本研究中CD34陽性表達率在HAE邊緣帶組織高于正常肝組織(P<0.01),有轉移灶邊緣帶表達高于無轉移灶邊緣帶(P<0.05)。張示杰等[11]報道,在早期沙鼠肝泡球蚴組織中存在CD34高表達的現象。姚冰等[12]研究報道,對HAE邊緣區域CT灌注成像并與組織病理對照發現,HAE病灶與周圍肝組織間存在邊緣浸潤帶,該區域血流灌注高于病灶內部及周圍肝臟組織。宋濤等[13]報道,HAE病灶周邊存在著一邊框樣的增強帶,結合超聲造影劑的增強原理,此邊框樣的增強帶代表了HAE病灶的邊緣區存在著較為豐富的微血供狀態。以上結論支持了本研究的結果。上述結果提示,CD34的高表達可能促使HAE新生血管形成,這說明血管生成可能是HAE浸潤性生長的機制之一。
本研究經雙變量相關分析顯示,MMP-2和CD34表達呈正相關性(r=0.442,P<0.01),表明MMP-2與CD34表達可能有一致性和協同作用,共同促進HAE病灶新生血管形成和浸潤轉移。有研究表明癌細胞可以通過自身分泌或旁分泌等方式合成大量的MMP-2,破壞基底膜的完整性,發生侵襲和轉移[14]。VUITTON等[15]提到“多房泡球絳蟲幼蟲自身所分泌的類細胞因子物質可能促進其周圍肉芽腫內血管生成”。血管新生是一個復雜過程,任何組織血管生成都不會是單一因素作用的結果,另外是否還有其他促轉移因子等的作用,還需進一步研究[8-9,16]。
綜上所述,在HAE邊緣帶組織中存在MMP-2和CD34高表達,表明HAE病灶組織中存在血管新生跡象,初步說明血管新生可能參與了HAE在宿主體內的侵襲轉移過程,而且MMP-2可能促使HAE組織血管新生。由于HAE的生長方式與腫瘤類似,人們借助腫瘤的浸潤轉移機制來研究HAE的發病機制,希望通過對HAE血管生成、浸潤轉移機制的研究能找到阻止其對宿主損傷的途徑,幫助臨床上開發新藥、尋找新的治療方法以達到治療包蟲病的目的。

