秋龍筋中藥制劑對鏈脲佐菌素誘導糖尿病大鼠的降糖作用及機制研究
林文東,楊維群 △,施水液,張美佳,程 晶,洪建兵
(1.泉州醫學高等專科學校基礎醫學部,福建泉州 362000;2.福建省晉江市中西醫結合醫院內科 362200; 3.福建省泉星生物有限公司,福建南安 362300)
糖尿病是因胰島素分泌量絕對或相對不足而導致的脂肪、糖、蛋白質代謝紊亂等為特點的內分泌性疾病[1]。隨著我國人民生活水平的改善,經濟條件的發展,糖尿病的臨床發病率越來越高,已成為嚴重威脅人民生活健康的主要威脅之一[2]。現階段臨床試驗仍在積極探索治療糖尿病的有效方法,這也是目前醫療學術研究一個熱點[3]。秋龍筋中藥制劑是民間中醫自擬方,有改善糖尿病癥狀的作用。本研究選擇鏈脲佐菌素(STZ)誘導糖尿病大鼠為實驗對象,對秋龍筋中藥制劑的降糖作用及機制進行研究,為該民間方藥的進一步深入開發提供依據。
1 材料與方法
1.1材料
1.1.1實驗動物 本研究選取24只6~7周齡SPF級雄性SD大鼠(合格證編號:2015000509957、2015000510718),體質量200~241 g,購自上海斯萊克實驗動物有限責任公司[許可證號:SCXK(滬)2012-0002],所有大鼠均置于相對濕度為45%~60%,光照12 h,溫度為23~25 ℃的環境中飼養,實驗場所是泉州醫學高等專科學校屏障系統動物實驗室[許可證號:SYXK(閩)2016-0001]。
1.1.2主要儀器 本研究中所用ST-360型酶標儀,購自上海科華實驗系統有限公司,T6紫外可見分光光度計購自北京普利生有限公司。
1.1.3試劑與藥物 秋龍筋中藥制劑為民間中醫自制方劑,組方:中草藥秋龍筋35 g,野山參3 g,太子參5 g,天花5 g,葛根5 g。用約1.50 L水先浸泡30 min,中火燒開后改用溫火,煎約20 min,藥水剩下約0.50 L,沉淀后倒出;另加水1.00 L繼續燒開約剩0.25 L時,倒出與第1遍藥水混合使用。
鹽酸二甲雙胍購自中美上海施貴寶制藥有限公司(國藥準字H20023371);STZ購自美國Sigma公司;氫氧化鈉、檸檬酸均購自上海國藥集團;高脂高糖飼料購自北京華阜康生物科技股份有限公司[許可證號:SCXK(京)2017-0008];胰島素ELISA試劑盒購自默克公司;高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血清總膽固醇(TC)、三酰甘油(TG)、葡萄糖測定試劑盒均購自艾康生物技術(杭州)有限公司;一氧化氮(NO)試劑盒、糖化血紅蛋白(GHb)試劑盒、肝糖原、游離脂肪酸(FFA)、超氧化物歧化酶(SOD)及丙二醛(MDA)試劑盒均購自南京建成生物工程研究所;C肽(C-P)試劑盒、胰島素(Fins)試劑盒、腫瘤壞死因子-α(TNF-α)試劑盒均購自武漢默沙克生物科技有限公司。
1.2方法
1.2.1分組、造模及給藥 本研究選用24只雄性SD大鼠,飼養3 d后,采用隨機數字表法隨機分為4組,即正常組、模型組、陽性藥組、實驗組,每組6只。模型組、陽性藥組、實驗組大鼠均使用1%STZ腹腔注射55 mg/kg,使用檸檬酸-檸檬酸鈉緩沖液0.01 mol/L造模,用高脂高糖飼料進行喂養,正常組注射等體積緩沖液。造模完成48 h后,采集尾靜脈血檢測血中空腹血糖,若血糖水平大于16.7 mmol/L則判定造模成功。陽性藥組每天早上9點灌胃給藥鹽酸二甲雙胍,給藥濃度為150 mg/kg;實驗組同時間點灌胃給藥秋龍筋中藥制劑,給藥濃度為200 mg/kg;模型組及正常組同期灌胃等體積的生理鹽水,每天1次,連續給藥28 d。實驗全程所有大鼠均自由飲水,飼養標準顆粒飼料。
1.2.2檢測指標 每組動物在實驗結束后乙醚麻醉,腹主動脈取血,檢測血清中空腹血糖(FBG)、TG、TC、LDL-C、HDL-C、INS、GHb、SOD、C-P、谷胱甘肽(GSH)、MDA、SOD、FFA、NO及TNF-α水平,所有操作均嚴格遵照試劑盒說明書進行操作。采集肝臟組織,檢測肝糖原水平,嚴格遵照試劑盒說明書進行操作。
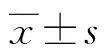
2 結 果
2.1各組大鼠給藥前后體質量變化情況 給藥后模型組、陽性藥組及實驗組3組大鼠體質量明顯低于正常組(P<0.05),陽性藥組及實驗組大鼠體質量明顯高于模型組(P<0.05),且實驗組大鼠體質量明顯低于陽性藥組(P<0.05),見表1。

表1 各組大鼠給藥前后體質量比較
a:P<0.05,與正常組比較;b:P<0.05,與模型組比較;c:P<0.05,與陽性藥組比較
2.2給藥后各組大鼠血脂及血中FBG、Fins、C-P水平變化情況 與正常組及陽性藥組相比,模型組及實驗組大鼠血中TG、TC、LDL-C水平明顯較高,HDL-C水平明顯較低(P<0.05);實驗組大鼠血中TG、TC、LDL-C水平明顯低于模型組,HDL-C水平明顯高于模型組(P<0.05)。模型組及實驗組大鼠血中FBG水平高于正常組及陽性藥組(P<0.05),Fins及C-P水平明顯低于正常組及陽性藥組(P<0.05),實驗組大鼠血中FBG水平低于模型組(P<0.05),Fins及C-P水平明顯高于模型組(P<0.05),見表2。
2.3給藥后各組大鼠血中SOD、MDA、GSH、FFA、GHb、NO、肝糖原及TNF-α水平檢測結果 與正常組及陽性藥組比較,模型組及實驗組血中MDA水平明顯較高,SOD及GSH水平明顯較低(P<0.05);實驗組血中MDA水平明顯低于模型組,SOD及GSH水平明顯高于模型組(P<0.05)。實驗組大鼠血中FFA、GHb、TNF-α及NO水平明顯低于模型組,肝糖原水平明顯高于模型組(P<0.05);實驗組大鼠TNF-α水平明顯高于陽性藥組(P<0.05),見表3。
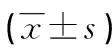
表2 給藥后各組大鼠血脂及血中FBG、Fins、C-P水平檢測結果
a:P<0.05,與正常組比較;b:P<0.05,與模型組比較;c:P<0.05,與陽性藥組比較
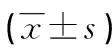
表3 給藥后各組大鼠血中SOD、MDA、GSH、FFA、GHb、NO、肝糖原及TNF-α水平檢測結果
a:P<0.05,與正常組比較;b:P<0.05,與模型組比較;c:P<0.05,與陽性藥組比較
3 討 論
維持機體內血糖水平穩定多是通過利用、貯存及轉化血中葡萄糖的動態平衡實現的[4]。C-P也是人體內由胰腺β細胞合成并分泌的產物,因其不被肝臟代謝和攝取,也不受外源性胰島素影響,所以血中C-P水平可作為評估胰腺β細胞功能的重要指標之一[5]。有研究指出,在糖尿病早期,機體腎小球內皮細胞功能異常,導致大量生成NO,而過量NO則會進一步轉化為過硝酸根離子等自由基,通過其細胞毒作用對胰腺β細胞的功能及結構造成損害[6]。
STZ致糖尿病大鼠采用秋龍筋中藥制劑給藥后,機體C-P及胰島素水平明顯提高,NO水平明顯降低。本研究結果提示,秋龍筋中藥制劑可能具有調節糖尿病大鼠受損的胰腺β細胞功能。有學者指出血糖水平與體內糖化血紅蛋白水平呈明顯正相關,機體內糖化血紅蛋白水平可有效反映機體內蛋白質糖基化水平[7]。秋龍筋中藥制劑可有效降低糖尿病大鼠體內GHb及FBG水平,筆者分析認為這可能是通過上調大鼠體內肝糖原的合成并改善胰腺β細胞分泌功能而實現。
有研究指出,在2型糖尿病患者體內,可見明顯的脂代謝紊亂癥狀,并伴有明顯的TC、TG、LDL-C水平異常升高,HDL-C水平異常降低[8]。糖尿病大鼠體內氧化自由基水平增高,使細胞膜增強脂質過氧化作用,降低血中GSH及SOD水平,并提高MDA水平[9]。采用秋龍筋中藥制劑給藥后,可有效提高糖尿病大鼠血中SOD、HDL-C及GDH水平,并降低大鼠血中MDA、TG、TC及LDL-C水平。結果表明,秋龍筋中藥制劑可減少脂質過氧化,清除自由基,有效防止糖尿病脂肪代謝并發癥的發生及發展。
TNF-α是機體內重要的具有多種生物活性的細胞活性因子,在機體免疫應答及炎性反應過程中起到重要的調節作用[10-11]。有研究指出,脂肪組織是內源性TNF-α的主要來源,其參與機體內的諸多代謝過程,包括脂質代謝、胰島素代謝、葡萄糖代謝等,在機體的胰島素抵抗過程中起到十分重要的作用[12]。TNF-α可有效調節脂肪細胞基因,降低體內脂蛋白酯酶水平,抑制脂肪細胞分化,加速脂肪分解,并升高血清中FFA水平[13-14]。研究指出,FFA升高可加速糖異生,降低胰島素清除率,使胰高血糖素水平升高,抑制糖原合成及骨骼肌利用葡萄糖作用,導致機體出現胰島素抵抗[15]。本研究結果顯示,在STZ誘導的糖尿病大鼠血中,FFA及TNF-α水平均明顯升高,提示該模型大鼠可能出現胰島素抵抗。而STZ誘導的糖尿病大鼠采用秋龍筋中藥制劑干預后可有效降低其血中FFA及TNF-α水平,提示秋龍筋中藥制劑可有效抑制胰島素抵抗,調節胰島素水平。
綜上所述,采用秋龍筋中藥制劑對STZ誘導糖尿病大鼠干預后,可有效降低體內血糖水平,提高胰腺β細胞功能,改善糖脂代謝紊亂及胰島素抵抗,抗脂質過氧化并促進肝糖原合成。

