中心靜脈置管與經肺靜脈置管左房測壓的比較
王志勇
(安陽市第三人民醫院麻醉科,河南 安陽 455000)
心臟手術后密切監測患者的呼吸及循環,不僅關系到手術的成功,也關系到患者的預后[1]。左房壓(left atrial pressure,LAP)能靈敏反映左心功能,對左心功能不全的治療有指導意義[2]。傳統的左房壓監測是在關胸前經左心耳或右上肺靜脈把導管插入左心房內并荷包縫合固定,經胸壁引出皮膚,連接測壓裝置。而經中心靜脈置入足夠長的右房導管,體外循環結束縫合右房前,通過房間隔把導管放入左心房測壓的方法,主要用于小兒先天性心臟病手術使用。國外最初均將左房壓應用于小兒復雜先心病術后監護治療,因其有效,并發癥少,被認為是可等同于中心靜脈壓監護的安全有效的檢測手段[3-6]。本研究對經中心靜脈左房測壓與經肺靜脈左房測壓進行比較,觀察兩種方法的優劣。
1 資料與方法
1.1 一般資料 選擇我院2014年1月至2017年3月,年齡在1周歲以上,進行心內直視手術的患者,單純隨機抽取100例,其中:男 59例,女41例;年齡1~66歲,中位年齡48歲;體質量10.2~85.3 kg,中位體質量70.2 kg。其中22例接受先天性心臟畸形矯治術,包括室間隔缺損5例,完全性肺靜脈異位引流2例,法洛四聯癥3例,部分性肺靜脈異位引流2例,房間隔缺損3例,肺動脈狹窄2例,法洛三聯癥1例,主動脈竇瘤破裂1例,三房心1例,動脈導管未閉1例,永存動脈干1例;78例進行后天性心臟病手術,包括二尖瓣置換術38例,主動脈瓣置換術10例,二尖瓣加主動脈瓣置換術10例,冠狀動脈搭橋12例,Bentall手術3例,左房黏液瘤摘除3例,三尖瓣成形2例。
1.2 方法 所有患者均行體外循環下心內直視手術,手術開始前經中心靜脈置入18G單腔導管,體外循環結束關閉右心房前,將該18G導管通過房間隔放入左房1~2 cm,導管通過房間隔處荷包縫合。體外循環下拔出左心引流后,把另一根18G單腔無測孔聚乙烯導管經胸壁穿刺,通過右上肺靜脈置入左心房內,長度1.5 cm左右,右上肺靜脈的導管入口處荷包縫合。兩個導管排凈空氣后連接相同傳感器,分別記錄兩個導管在回到監護室時,術后6 h、12 h 、24 h的測壓值。并評估兩種導管測壓值的平均相關系數。記錄兩導管平均使用時間和評估導管相關并發癥發生率。導管相關并發癥包括血栓、漏氣、感染、心包填塞、拔管困難、導管脫落。
1.3 統計學處理 采用SPSS 11.5軟件進行處理,計數資料的比較采用Fisher確切概率法,計量數據的比較采用t檢驗并行相關性分析,P<0.05為差異有統計學意義。
2 結 果
2.1 兩種測左房壓方法的數值及相關性 經中心靜脈左房測壓值和經肺靜脈左房測壓值有相關性。經中心靜脈左房測壓值與經肺靜脈左房測壓值平均相關系數r=0.989,兩個導管壓力相差在0~0.65 mmHg。見表1。
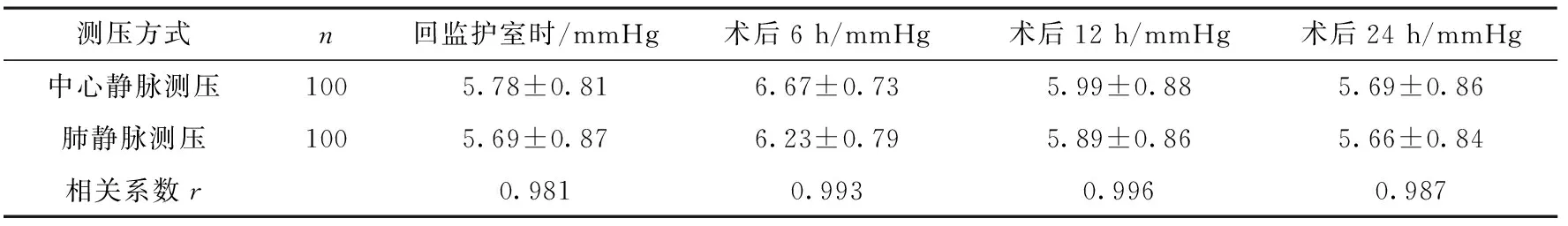
表1 中心靜脈左房測壓值和經肺靜脈左房測壓值及相關性
2.2 兩種導管使用時間和并發癥 經中心靜脈左房測壓導管使用時間最長(P<0.01),兩種測壓方法導管相關并發癥發生率無統計學意義(P>0.05),所有患者無死亡。見表2。
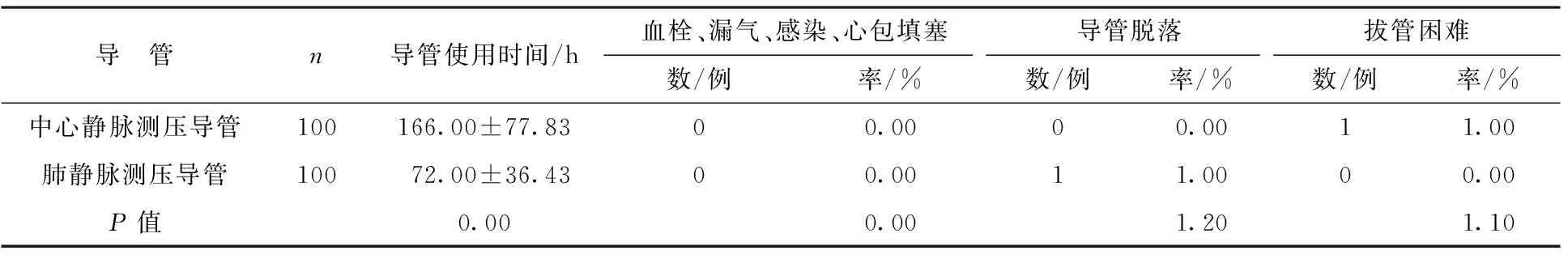
表2 兩種導管使用時間和并發癥
3 討 論
心內直視手術后,患者因心臟結構的改變致其血流動力學常存在不穩定現象,同時手術引起的炎癥反應、出血、心臟缺血再灌注損傷等也可改變患者的血流動力學,并引起新的病理改變,造成術后低心排綜合征[7]。左房壓能對左心功能不全的治療提供重要指導,而臨床上進行血流動力學監測時,肺動脈楔壓(pulmonary arterial wedge pressure,PAWP)是反映左心室前負荷的“金標準”。 在一些情況下,如心臟手術后心包開放,左心室容易擴張,正壓通氣和呼氣末正壓(PEEP)導致右心擴張等解剖生理改變, PAWP并不能準確反映左心舒張末期容量[8]。同時導管價格較貴,硬件條件要求較高等因素,使肺動脈漂浮導管臨床應用受限。所以直接左房壓監測成為臨床工作中不可缺少的重要方法。
經右上肺靜脈通過胸壁左房測壓是傳統的左房測壓方法,為減少心包填塞的風險[8],經右上肺靜脈左房測壓導管均在胸腔引流管拔出前拔出,故經肺靜脈測左房壓導管使用時間較經中心靜脈測左房壓導管使用時間短。經中心靜脈置管左房測壓操作并不復雜,只需要外科醫生在手術后期協助即可實現。兩種方法測量值有相關性,即兩種方法測壓值相近,表明經中心靜脈左房測壓值也是準確的。本研究1例經右上肺靜脈測左房壓導管脫出肺靜脈,可能與關閉胸壁后胸腔引流管人為因素擺動過大有關;1例中心靜脈左房測壓拔出困難可能與操作時荷包縫合過緊有關,后經多次嘗試拔出導管。
綜上所述,中心靜脈左房測壓與經肺靜脈置管測左房壓比較,具有測量值相近、數據準確、導管相關并發癥相同但能夠使用更長時間的優點,可以替代經肺靜脈置管左房測壓的方法,在臨床可廣泛運用。

