子宮動脈栓塞術治療子宮肌瘤效果及對患者血清MMPs、TIMPs、性激素水平的影響
曹霞,何國照
(丹陽市人民醫院,江蘇丹陽212300)
子宮肌瘤是婦科常見病,既往子宮切除術是根治本病的常用方法。但由于子宮肌瘤患者多為育齡期女性,保留子宮的愿望強烈,且子宮切除后卵巢功能下降,患者生活質量明顯降低[1]。子宮動脈栓塞術(UAE)是通過向雙側子宮動脈血管注入栓塞劑而阻斷子宮肌瘤的血供,使子宮肌瘤組織發生缺血、壞死,其對子宮肌瘤的治療效果已逐步得到臨床認可[2]。有研究發現,子宮肌瘤的形成和生長需要細胞外基質的破壞和重建,基質金屬蛋白酶(MMPs)是鋅離子依賴的中性蛋白酶,參與細胞外基質降解,并能促進血管內皮細胞生長、新生血管形成,在子宮肌瘤的生長過程中發揮重要作用[3]。基質金屬蛋白酶抑制劑(TIMPs)是MMPs的特異性組織抑制劑,TIMPs、MMPs水平變化與子宮肌瘤的發生發展有關[4]。目前,臨床上關于UAE治療子宮肌瘤對血清MMPs、TIMPs水平影響的相關報道較少。本研究觀察了UAE治療子宮肌瘤的效果及其對患者血清MMPs、TIMPs、性激素水平的影響,進一步探討UAE治療子宮肌瘤的機制。現報告如下。
1 資料與方法
1.1 臨床資料 選取丹陽市人民醫院2015年6月~2017年1月收治的子宮肌瘤患者160例。納入標準:①年齡35~56歲;②術前經超聲或磁共振檢查診斷為子宮肌瘤;③臨床表現為經期腹痛、月經量增多及經期延長等;④患者簽署知情同意書。排除標準:①凝血功能疾病;②肝腎功能疾病;③惡性腫瘤;④伴有嚴重的糖尿病、免疫系統疾病;⑤合并生殖系統炎癥。將患者根據手術方法分為UAE組、對照組各80例。UAE組年齡(46.3±6.0)歲,肌瘤單發32例、肌瘤多發48例;術前子宮肌瘤體積(87.9±16.2)mm3,術前血紅蛋白(Hb)為(89.4±8.2)g/L。對照組年齡(45.9±7.0)歲,肌瘤單發35例、肌瘤多發45例;術前子宮肌瘤體積(89.3±20.2)mm3,術前Hb(90.2±6.7)g/L。本研究獲得醫學倫理委員會的批準,兩組年齡、肌瘤數目及術前肌瘤體積、Hb水平具有可比性。
1.2 手術方法 UAE組接受UAE手術治療,于月經結束3 d后進行手術。患者取平臥位,在局麻狀態下采用Seldinger技術行右側股動脈穿刺。穿刺成功后將5 F Yashiro導管插管至腹主動脈,行數字減影血管造影觀察子宮肌瘤供血情況。確認導絲到達子宮動脈后,推注聚乙烯醇(PVA)顆粒栓塞子宮細小血管,以直徑1 mm明膠海綿栓塞子宮動脈主干。術畢再次進行數字減影血管造影,以確定是否達到完全栓塞效果。術后穿刺點加壓包扎,穿刺側下肢制動6 h,絕對臥床24 h。對照組采取子宮切除手術治療,行氣管插管全身麻醉,取下腹正中切口;進腹后探查腹腔,離斷子宮韌帶、輸卵管間質,游離子宮膀胱腹膜反折,切除子宮;術畢縫合盆腔腹膜、陰道斷端。
1.3 臨床效果觀察 分別于術前及術后3、6個月時,采用彩色多普勒超聲檢查UAE組的子宮體積、肌瘤體積變化。
1.4 血清MMPs、TIMPs及性激素檢測 患者均于術前、術后3個月采集清晨空腹靜脈血,以3 000 r/min離心10 min,取上層血清于-20 ℃保存。采用酶聯免疫吸附法檢測血清MMP-2、MMP-9、TIMP-2、TIMP-9水平,檢測儀器為美國伯騰公司多功能酶標儀,試劑盒購自深圳晶美生物工程有限公司。另取一份血標本,采用電化學發光法檢測促卵泡激素(FSH)、黃體生成素(LH)、雌二醇(E2)水平,檢測儀器為瑞士羅氏公司Cobas e601電化學發光全自動免疫分析儀,試劑盒購自南京建成生物工程研究所。所有操作嚴格參照試劑盒說明書進行。
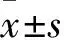
2 結果
2.1 UEA組手術前后子宮體積、肌瘤體積比較 術后3、6個月,UEA組子宮體積、肌瘤體積較術前均減小(P均<0.05)。見表1。

表1 UEA組手術前后子宮體積、肌瘤體積比較
注:與術前比較,*P<0.05;與術后3個月比較,#P<0.05。
2.2 兩組血清MMPs、TIMPs水平比較 術前兩組血清MMP-2、MMP-9、TIMP-2、TIMP-9水平差異無統計學意義(P均>0.05);術后3個月兩組血清MMP-2、MMP-9、TIMP-2、TIMP-9較本組術前均降低(P均<0.05),兩組比較差異無統計學意義(P均>0.05)。見表2。

表2 兩組血清MMP-2、MMP-9、TIMP-2、TIMP-9水平比較
注:與本組術前比較,*P<0.05。
2.3 兩組血清性激素水平比較 術前兩組血清FSH、LH、E2水平差異無統計學意義(P均>0.05);術后3個月UEA組血清FSH、LH、E2水平高于對照組(P均<0.05),對照組血清LH、E2較術前降低(P均<0.05)。見表3。
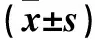
表3 兩組血清FSH、LH、E2水平比較
注:與本組術前比較,*P<0.05;與對照組術后3個月比較,#P<0.05。
3 討論
子宮肌瘤是育齡期女性的常見病、多發病,盡管其屬于良性腫瘤,但可引起經期延長、經量過多、腹部疼痛等癥狀,嚴重影響患者的生活質量,因此在確診后應給予積極的治療[5]。目前臨床對于子宮肌瘤的發病機制尚未完全闡明,已有的研究認為與多因素、多環節相關;其中性激素對子宮肌瘤的影響較大,此外還與雌激素受體、孕激素受體、生長因子、遺傳因素、微量元素等有關[6]。
手術切除子宮是徹底根治子宮肌瘤的方法,但手術創傷較大,患者因此失去生育能力,同時會引起內分泌變化,患者往往不能接受[7]。有研究發現,子宮肌瘤血供豐富,瘤體越大,血供越豐富,為子宮肌瘤提供的營養越充足[8]。基于這一理論,有學者提出通過阻斷子宮肌瘤供血血管的方式來治療本病[9]。UAE屬于介入治療,通過向子宮肌瘤供血血管注入栓塞劑而阻斷病灶的供血及營養來源,進而使其自然萎縮,同時不影響子宮肌層的正常功能,有利于保留子宮及生育功能[10]。
子宮肌瘤的血供多來源于一側或雙側子宮動脈,潛在的側支循環豐富。因此,在栓塞時應逐級栓塞靶血管,不僅應重視栓塞血管主干,還應注意對末梢血管進行栓塞,以達到完全栓塞的效果[11]。本研究中首先采用PVA顆粒栓塞子宮細小血管,再采用明膠海綿栓塞子宮動脈主干,獲得了滿意的栓塞效果。術后3、6個月時,采用UEA治療者的子宮體積、肌瘤體積較術前均顯著減小。這一結果提示,采用UEA治療子宮肌瘤的療效確切,可有效切斷子宮肌瘤的供血,促使其自然萎縮。
MMPs是鋅依賴性蛋白酶家族,從細胞內分泌至細胞外可發生活化,參與降解細胞外基質,與腫瘤細胞的侵襲、轉移過程密切相關[12]。有研究發現,子宮肌瘤組織中MMPs含量豐富,可能是促進子宮肌瘤生長的重要原因之一[13]。MMP-2、MMP-9均是MMPs家族的重要成員,MMP-2可水解細胞基底膜,促使病灶浸潤;MMP-9可降解細胞外基質和基底膜,調節其他蛋白酶、細胞因子活性,釋放血管內皮生長因子促進新生血管形成,進而促進子宮肌瘤的生長[14]。TIMPs是MMPs特異性組織抑制劑,可與MMPs發生非共價結合形成復合體,從而抑制其活性,抑制新生血管形成、細胞外基質降解[15]。本研究結果顯示,術后3個月時,兩組血清MMP-2、MMP-9、TIMP-2、TIMP-9水平均較本組術前降低,組間不具有統計學差異。這一結果提示,UAE治療子宮肌瘤對血清MMPs、TIMPs水平的影響作用與子宮切除術相仿。
子宮是產生月經、保護胚胎成長的重要器官,同時也是卵巢內分泌功能的靶器官,其在女性內分泌狀態的維持方面具有重要作用。本研究結果顯示,術后3個月時,采用UEA治療者血清FSH、LH、E2水平高于采用子宮切除術治療者,采用子宮切除術治療者血清LH、E2較術前降低更明顯。這一結果提示,UAE治療子宮肌瘤對患者的卵巢功能影響更小。這是由于子宮切除術后可能影響血液動力學,導致卵巢動脈的血流速度減慢,進而對卵巢功能產生一定的抑制作用;而UAE僅阻塞子宮肌瘤的供血血管,對卵巢供血無明顯影響,因此對性激素水平的影響更小。
綜上所述,UAE治療子宮肌瘤患者的效果可靠,與子宮切除術一樣可以改善血清MMPs、TIMPs水平,同時對患者的卵巢功能影響更小。

