表觀擴散系數灰度直方圖在多形性膠質母細胞瘤鑒別診斷中的價值
任琦,程敬亮,馬楨,張勇(鄭州大學第一附屬醫院,鄭州450052)
多形性膠質母細胞瘤(GBM)是成人最常見、最具侵襲性的原發性腦瘤,在免疫功能正常個體中的發病率逐步增加,占顱內原發腫瘤的1%~6%[1]。術后PCNSL患者缺乏生存獲益且神經功能缺陷風險增加[2],因此手術不作為PCNSL患者治療的首選,通常采用高劑量聯合放化療進行治療[3,4]。在采取治療措施前,GBM常需與原發性中樞神經系統淋巴瘤(PCNSL)及單發腦轉移瘤(SMT)進行鑒別診斷。單發轉移瘤患者需要系統的臨床及影像學檢查來確定原發腫瘤及其他遠處轉移病灶的位置[5]。GBM、PCNSL及SMT的治療方法不同,術前鑒別診斷具有重要臨床意義。本研究提取表觀擴散系數(ADC)圖腫瘤全域感興趣區(ROI)內的灰度值并對相應參數進行分析,量化腫瘤全域水分子擴散情況,以期從腫瘤全域ADC圖中獲取鑒別GBM、PCNSL和SMT的可靠信息,為臨床決策提供參考。
1 資料與方法
1.1 臨床資料 2014年5月~2017年10月于本院就診的腦腫瘤患者95例,納入標準:均行顱腦MRI檢查,成像序列包括軸位T1WI、T2WI、T2FLAIR、DWI和動態增強T1WI,圖像質量佳;MRI檢查前無任何影響腫瘤形態學特征的醫療行為,如穿刺、放化療等;均經術后病理檢查確診。其中GBM 29例(GBM組),男17例、女12例,年齡10~69(51.2±14.5)歲;PCNSL 38例(PCNSL組),男17例、女21例,年齡33~81(57.1±12.5)歲,彌漫性大B細胞淋巴瘤37例、淋巴漿細胞性淋巴瘤1例,均無獲得性免疫缺陷;SMT 28例(SMT組),男15例、女13例,年齡36~76(59.8±10.32)歲,原發腫瘤部位為肺24例(腺癌18例、神經內分泌癌4例、鱗癌2例)、乳腺2例(浸潤性導管癌1例、原發病理類型不明1例)、胃2例(腺癌2例)。三組性別、年齡比較差異無統計學意義(P均>0.05)。本研究經醫院醫學倫理委員會批準,患者均簽署知情同意書。
1.2 ADC灰度直方圖的獲取與處理 采用德國Siemens Skyra 3.0T磁共振掃描儀,32通道標準頭頸聯合線圈。掃描序列包括軸位T1WI、T2WI、T2液體衰減反轉恢復、磁共振擴散加權成像(SE-EPI序列,b值分別為0、1 000 s/mm2),參數:TR/TE分別為260.0 ms/2.46 ms、3 800 ms/93.0 ms、4 500 ms/93.0 ms、3 500 ms/119 ms;FOV 23 cm×23 cm,層間距0.3 mm,層厚5 mm,層數20。增強掃描序列包括軸位、矢狀位和冠狀位T1WI,掃描參數與T1WI平掃相同。對比劑使用釓噴替酸葡胺,劑量0.2 mmol/kg,注射速率2 mL/s,按0.5 mL/kg生理鹽水以同速率進行注射沖洗。以BMP格式導出軸位ADC圖像,導出前圖像窗寬、窗位保持一致。參照增強掃描圖像上的腫瘤范圍,利用MaZda軟件在導出的ADC圖像上沿腫瘤邊緣手動勾畫ROI,由軟件自動生成ROI直方圖數據,選取灰度值的均值、方差、偏度、峰度及第1、10、50、90、99百分位數(Perc.01%、Perc.10%、Perc.50%、Perc.90%、Perc.99%)等參數用于統計學分析。勾畫過程由從事影像診斷工作10年以上的2位影像專家進行指導。
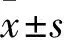
2 結果
2.1 三組ADC灰度直方圖參數比較 三組的ADC圖灰度值、方差、偏度、峰度、Perc.01%、Perc.10%、Perc.50%、Perc.90%、Perc.99%比較差異有統計學意義(P均<0.05)。GBM組與PCNSL組比較,以上參數差異有統計學意義(P均<0.05);GBM組與SMT組比較,均值、偏度、Perc.01%、Perc.10%、Perc.50%、Perc.99%差異有統計學意義(P均<0.05),方差、峰度、Perc.90%差異無統計學意義(P均>0.05);PCNSL組與SMT組比較,均值、方差、偏度、Perc.50%、Perc.90%差異有統計學意義(P均<0.05),峰度、Perc.01%、Perc.10%差異無統計學意義(P均>0.05)。

表1 三組ADC灰度直方圖灰度值、方差、偏度、峰度值比較

表2 三組ADC灰度直方圖灰度值第1、10、50、90、99百分位數比較
2.2 ADC灰度直方圖鑒別診斷GBM、PCNSL及SMT的效能 繪制ROC曲線。ADC灰度直方圖參數中Perc.50%鑒別診斷GBM、PCNSL的AUC最大(0.90),靈敏度與特異度分別為84.21%、86.21%),見表3。Perc.50%鑒別GBM、PCNSL的AUC最大(0.794),靈敏度和特異度相同,分別為96.43%、55.17%,見表4。Perc.90%鑒別PCNSL與SMT的AUC最大(0.814),靈敏度和特異度分別為92.86%、68.42%,見表5。

表3 ADC灰度直方圖參數鑒別診斷GBM與PCNSL的效能
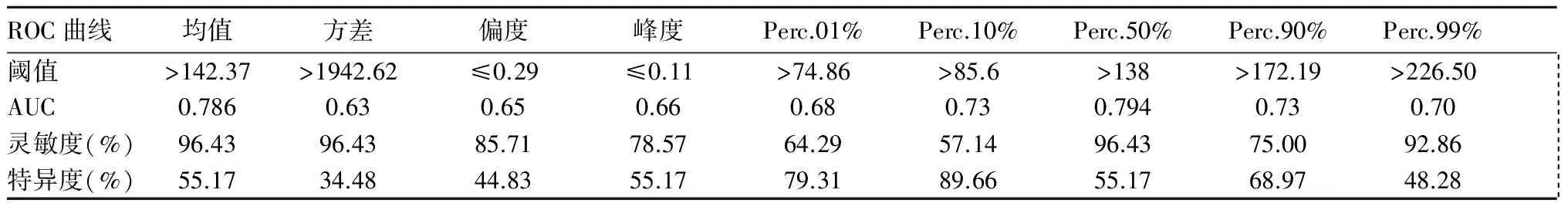
表4 ADC灰度直方圖參數鑒別診斷GBM與SMT的效能
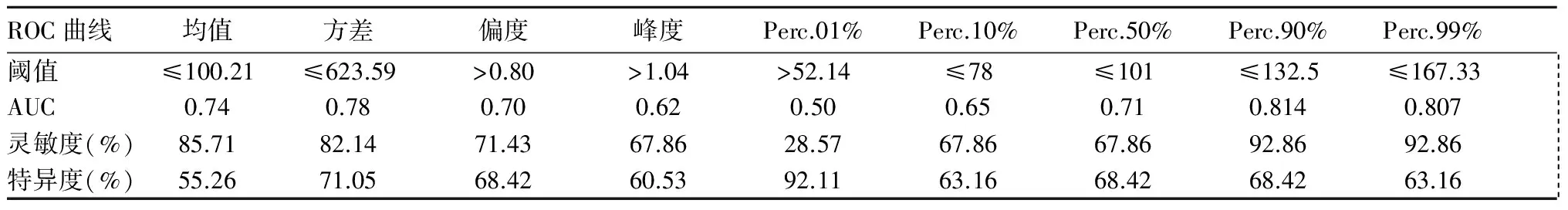
表5 ADC灰度直方圖參數鑒別診斷PCNSL與SMT的效能
3 討論
紋理分析量化了圖像表面密度的變化及其模式[4],描述了醫學圖像中像素灰度空間分布,可反映病變的組織類型和病理特征,常應用于數字圖像的分析,因此在人工智能醫學影像領域中引起了越來越多的關注。灰度直方圖分析主要描述的是腫瘤內每個灰度級出現的頻率,與來自血流動力學模型的局部腦血容量和局部腦血流量等灌注參數不同,灰度直方圖參數沒有直接的生理意義。然而,這些描述性特征被認為是由MRI掃描儀將組織的結構和功能特征具體可視化的結果。在神經腫瘤影像學方面,基于MRI的紋理分析涉及放射性治療所致壞死和復發腫瘤的鑒別[6]、GBM患者的生存預測[7]、腦膠質瘤的分級[8]、不同類型肺腫瘤的腦轉移的鑒別[9]、后顱窩腫瘤病理類型的鑒別[10]及髓母細胞瘤復發風險預測[11]等方面,應用價值可觀。
ADC值反映了腫瘤微環境內水分子擴散情況,與腫瘤細胞密度呈反比[12],有助于疾病的診斷、生物侵襲性評估及治療反應預測。ADC圖像灰度反映的是ADC值的大小,灰度越低(黑)ADC值則越低。而灰度直方圖作為圖像紋理的一級特征[13],可量化圖像體素內的灰度分布。因此,灰度直方圖分析可用于評估腫瘤內部ADC值的整體分布情況。傳統的彌散加權成像研究多以病變局部區域為ROI進行分析,本研究以腫瘤全域ADC值為對象,分析GBM、PCNSL和SMT整體ADC值,以期對腫瘤整體水分子擴散情況提供一個更為全面的認識。
PCNSL的ADC圖灰度均值低于GBM和SMT,其余5項百分位數當存在組間統計學差異時也保持了這一特征。這可能由于PCNSL細胞密集且核質比較大等組織學特征導致其細胞外水分子擴散受限,ADC值降低明顯[1]。GBM惡性程度高,腫瘤細胞增殖與核異型性明顯,常出現缺血性改變或血栓形成導致的大片壞死,從而使GBM的全域ADC圖灰度均值高于PCNSL和SMT。Lu等[1,3]研究發現,PCNSL的相對ADC值及相對ADC均值低于GBM,這與本研究結果一致。
方差描述的是數據的離散程度。本研究發現GBM與SMT的ADC灰度直方圖方差值高于PCNSL,而GBM的ADC灰度直方圖方差雖高于SMT,但差異無統計學意義。GBM的傳統MRI信號表現多不均勻,其ADC值灰度方差較大,說明GBM微環境中水分子擴散受限程度的異質性較大;而PCNSL較低的方差值則反映了PCNSL更為單一均勻的細胞成分,水分子擴散受限程度差異小。灰度直方圖分析參數量化了這一傳統的主觀性概念。腫瘤異質性是GBM治療耐藥、影響預后的主要原因之一[14],灰度直方圖參數能否間接反映GBM治療及預后情況還需進一步研究證實。
峰度表示灰度值總體分布形態的平坦程度,反映該圖像灰度頻數分布形態,比正態分布更為尖銳或平坦,尖銳者峰度值為正,相反為負[15]。本研究中,PCNSL峰度值高于PCNSL,說明PCNSL的ADC值灰度分布圖像上部分灰度值頻數較多,直方圖分布形態更為尖銳,表明PCNSL的ADC圖灰度值分布更為集中,這一結果與PCNSL較小的方差值相一致,均體現了PCNSL更為均勻的MRI信號表現。
ADC灰度直方圖參數鑒別GBM-PCNSL、GBM-SMT、PCNSL-SMT的最高效能分別為0.90(第50百分位數)、0.794(第50百分位數)、0.814(第90百分位數)。本研究中的ADC灰度直方圖參數對這三種腫瘤的鑒別診斷效能高于之前的多數研究[1,2,16~18]。與之前的研究不同,灰度直方圖分析量化了不同腫瘤影像圖像細微特征,包括人眼察覺不到的細微差異,可幫助提高對腫瘤傳統影像表現的客觀認識。
ADC腫瘤灰度直方圖分析是一種有前途的非侵入性圖像分析方法,可幫助鑒別GBM、PCNSL和SMT,易從常規MRI掃描中獲取參數,無需增加額外的掃描時間,將有望成為使患者受益的輔助診斷方法。
本研究的局限性:本研究的回顧性性質導致偏倚;讓2名經驗豐富的神經腫瘤影像診斷醫師指導畫取ROI以減小誤差;本研究結果缺少直接的病理影像相關證據驗證灰度直方圖參數與病理組織學的相關性。因此,需針對直方圖參數與組織學特征的關系進行更大樣本量的相關性研究,進一步探究灰度直方圖分析的診斷潛力。
參考文獻:
[1] Lu S, Wang S, Gao Q, et al. Quantitative evaluation of diffusion and dynamic contrast-enhanced magnetic resonance imaging for differentiation between primary central nervous system lymphoma and glioblastoma[J]. J Comput Assist Tomogr, 2017,41(6):898-903.
[2] Lin X, Lee M, Buck O, et al. Diagnostic accuracy of T1-weighted dynamic contrast-enhanced-MRI and DWI-ADC for differentiation of glioblastoma and primary CNS lymphoma[J]. AJNR Am J Neuroradiol, 2017,38(3):485-491.
[3] Ma JH, Kim HS, Rim NJ, et al. Differentiation among glioblastoma multiforme, solitary metastatic tumor, and lymphoma using whole-tumor histogram analysis of the normalized cerebral blood volume in enhancing and perienhancing lesions[J]. AJNR Am J Neuroradiol, 2010,31(9):1699-1706.
[4] Kunimatsu A, Kunimatsu N, Kamiya K, et al. Comparison between glioblastoma and primary central nervous system lymphoma using MR image-based texture analysis[J]. Magn Reson Med Sci, 2018,17(1):50-57.
[5] Cha S, Lupo JM, Chen MH, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging[J]. AJNR Am J Neuroradiol, 2007,28(6):1078-1084.
[6] Tiwari P, Prasanna P, Wolansky L, et al. Computer-extracted texture features to distinguish cerebral radionecrosis from recurrent brain tumors on multiparametric MRI: a feasibility study[J]. AJNR Am J Neuroradiol, 2016,37(12):2231-2236.
[7] Lee J, Jain R, Khalil K, et al. Texture feature ratios from relative CBV maps of perfusion MRI are associated with patient survival in glioblastoma[J]. AJNR Am J Neuroradiol, 2016,37(1):37-43.
[8] Skogen K, Schulz A, Dormagen JB, et al. Diagnostic performance of texture analysis on MRI in grading cerebral gli-omas[J]. Eur J Radiol, 2016,85(4):824-829.
[9] Li Z, Mao Y, Li H, et al. Differentiating brain metastases from different pathological types of lung cancers using texture analysis of T1 postcontrast MR[J]. Magn Reson Med, 2016,76(5):1410-1419.
[10] Rodriguez Gutierrez D, Awwad A, Meijer L, et al. Metrics and textural features of MRI diffusion to improve classification of pediatric posterior fossa tumors[J]. AJNR Am J Neuroradiol, 2014,35(5):1009-1015.
[11] 朱晨迪,張勇,程敬亮,等.MRI灰度直方圖分析在髓母細胞瘤復發風險評估中的應用[J].中國介入影像與治療學,2017,14(8):480-483.
[12] Guo AC, Cummings TJ, Dash RC, et al. Lymphomas and high-grade astrocytomas: comparison of water diffusibility and histologic characteristics[J]. Radiology, 2002,224(1):177-183.
[13] Liu Y, Xu X, Yin L, et al. Relationship between glioblastoma heterogeneity and survival time:an MR imaging texture analysis[J]. AJNR Am J Neuroradiol, 2017,38(9):1695-1701.
[14] Inda MM, Bonavia R, Seoane J, et al. Glioblastoma multiforme: a look inside its heterogeneous nature[J]. Cancers (Basel), 2014,6(1):226-239.
[15] 張勝,李玉林,黃送,等.增強T1WI直方圖在膠質母細胞瘤和腦單發轉移瘤鑒別診斷中的應用[J].中國醫學影像學雜志,2017,25(2):89-92.
[16] Lu S, Gao Q, Yu J, et al. Utility of dynamic contrast-enhanced magnetic resonance imaging for differentiating glioblas-toma,primary central nervous system lymphoma and brain metastatic tumor[J]. Eur J Radiol, 2016,85(10):1722-1727.
[17] Bauer AH, Erly W, Moser FG, et al. Differentiation of solitary brain metastasis from glioblastoma multiforme: a predictive multiparametric approach using combined MR diffusion and perfusion[J]. Neuroradiology, 2015,57(7):697-703.
[18] Mouthuy N, Cosnard G, Abarca-Quinones J, et al. Multiparametric magnetic resonance imaging to differentiate high-grade gliomas and brain metastases[J]. J Neuroradiol, 2012,39(5):301-307.

