Smad真核表達質粒構建及其在小鼠T淋巴瘤細胞中的表達
王婧帆,季然,李鑫宇,陳金鈴(南通大學醫學院病原生物學系,江蘇南通226000)
Smad同源蛋白在將轉化生長因子β1(TGF-β1)信號從細胞表面受體傳導至細胞核的過程中起關鍵作用,且不同的Smad蛋白介導不同家族成員的信號轉導[1]。TGF-β1通過與絲氨酸/蘇氨酸激酶受體結合,誘導Smad2和Smad3磷酸化,磷酸化的Smad2、Smad3與Smad4形成蛋白復合物,進入細胞核內調節靶基因的轉錄[2]。TGF-β1能通過誘導Smad蛋白調節叉頭/翼狀螺旋轉錄因子3(Foxp3)的表達,因此TGF-β/Smad信號通路與Foxp3的表達密切相關。Foxp3是調控調節性T細胞發育及功能的關鍵性轉錄因子[3]。Foxp3依靠其叉頭樣結構和DNA結合,并停留在細胞核內[4]。由于Foxp3的DNA結合域靠近蛋白C端,能抑制基因轉錄。因此,Foxp3能不同程度減少白細胞介素2(IL-2)、IL-4等細胞因子的轉錄活性[5]。Foxp3基因突變可引起scurfy(sf)突變小鼠中X-連鎖的淋巴細胞增生性疾病,而在人類中的突變可導致調節性T細胞的缺陷,導致免疫調節失調-多(種)內分泌病-腸病-X-連鎖綜合征[6]。Smad蛋白尤其是Smad3蛋白,作為TGF-β信號轉導器,參與調節TGF-β的活性[5]。有研究結果顯示,Smad3缺失導致Smad3-/-小鼠炎癥反應增強,同時伴有Th2和Th17型免疫應答減弱,小鼠淋巴結中Foxp3的mRNA表達下調[6]。Tardif等[7]觀察到Foxp3增強子與轉錄因子Smad3、活化T細胞核因子(NFAT)結合,提示TGF-β可能通過此位點實現對Foxp3的轉錄調節。2016年4月~2018年3月,本研究構建并鑒定pcDNA3.1-Smad2、pcDNA3.1-Smad3和pcDNA3.1-Smad4真核表達質粒,探討Smad真核表達質粒在小鼠T淋巴瘤細胞(EL4)中是否能穩定表達,為進一步探究Smad蛋白調控Foxp3表達的機制奠定基礎。
1 材料與方法
1.1 細胞、試劑及儀器 EL4細胞購自中國科學院細胞庫;Smad2購自Santa Cruz Biotechnology;Smad3、Smad4購自Cell Signaling Technology;大腸桿菌DH5α、pcDNA3.1真核表達載體、pMD19-T載體、T4連接酶、DNA聚合酶、質粒提取試劑盒、DNA凝膠回收試劑盒及DNA marker均購自大連TaKaRa公司;Hind Ⅲ、EcoR Ⅰ及Xho Ⅰ等限制性內切酶均購自中國Fermentas公司;電轉液購自北京Engreen Biosystem公司;電擊杯購自美國BTX公司。
1.2 Smad2、Smad3、Smad4基因擴增與克隆 采用PCR技術。根據GenBank的Smad2、Smad3、Smad4基因組序列,分別設計相應的特異性引物,擴增Smad2、Smad3、Smad4基因。Smad2上游引物:5′-AAGCTTGCCACCATGTCGTCCATCTTGCCATTC-3′,下游引物:5′-GAATTCTTTGCTCTGGAATTTTTGGATAG-3′;Smad3上游引物:5′-GAATTCGCCACCATGTCGTCCATCCTGCCCTTC-3′,下游引物:5′-CTCGAGCCTGGGGTTTTCTTCTGTGGTC-3′;Smad4上游引物:5′-GAATTCGCCACCATGGACAATATGTCTAT-AACAAATACAC-3′,下游引物:5′-CTCGAGTCAGTCTAAAGGCTGTGGGTC-3′。以EL4細胞獲得的cDNA為模板,通過PCR反應擴增出目的基因Smad2、Smad3、Smad4。PCR反應總體系為50 μL,引物各1.5 μL。反應條件:94 ℃預變性2 min,98 ℃變性10 s,60 ℃復性30 s,68 ℃延伸1 min,循環25次后68 ℃延伸30 min。PCR產物加“A”尾反應,72 ℃反應30 min,經1%的瓊脂糖凝膠電泳鑒定產物,目的片段按照DNA膠回收試劑盒說明書切膠回收。
1.3 pMD19-T載體構建 制備DH5α感受態,PCR產物與pMD19-T載體經T4 DNA連接酶連接過夜。反應體系總體積為10 μL,其中目的片段4 μL,pMD19-T 1 μL,Solution Ⅰ 5 μL。第2天取連接產物,轉化DH5α感受態細胞,于37 ℃倒置培養過夜,挑取單克隆菌落至LB液體培養基,37 ℃搖菌過夜,進行菌液PCR。挑選PCR結果陽性的菌液抽提質粒DNA進行鑒定。重組質粒置37 ℃水浴2 h,分別進行單酶切和雙酶切驗證。產物經瓊脂糖凝膠電泳檢測,驗證正確后,送由上海生工生物工程股份有限公司測序并通過DNAMAN軟件分析測序結果。
1.4 表達載體pcDNA3.1的構建 將pMD19-T重組質粒和pcDNA3.1質粒分別用限制性內切酶Hind Ⅲ/EcoR Ⅰ和EcoR Ⅰ/Xho Ⅰ進行雙酶切,置于37 ℃水浴2 h,經瓊脂糖凝膠電泳后切膠回收。純化獲得的酶切后的目的片段和pcDNA3.1載體通過T4連接酶連接,16 ℃反應過夜,反應體系:pcDNA3.1 1 μL,目的片段6 μL,5×T4 DNA ligase buffer 2 μL,T4 DNA ligase 1 μL。連接產物轉化DH5α感受態細胞,PCR鑒定為陽性的克隆通過雙酶切進行驗證后,由上海生工生物工程股份有限公司測序并通過DNAMAN軟件分析測序結果。
1.5 轉染 將EL4細胞調整至5×106/mL,加入2 μg構建好的pcDNA3.1-Smad2、pcDNA3.1-Smad3、pcDNA3.1-Smad4過表達質粒,電轉液(100 μL)吹打混勻,電轉儀電轉后置37 ℃、5% CO2培養箱中培養72 h。
1.6 EL4細胞中Smad2、Smad3及Smad4蛋白表達檢測 采用Western blotting法。轉染后72 h,收集EL4細胞置EP管中,離心棄上清,PBS重懸細胞,離心棄上清。加入蛋白裂解液100 μL,冰上裂解20 min。細胞經超聲破碎后,離心收集上清,檢測蛋白濃度。加入5×上樣緩沖液,沸水中煮沸10 min,置于-20 ℃冰箱備用。配制10%的分離膠,行電泳。轉膜后用10%脫脂牛奶封閉PVDF膜,室溫2 h。Smad2按1∶200稀釋,Smad3、Smad4 按1∶1 000稀釋,4 ℃孵育過夜。二抗1:5 000稀釋,室溫孵育1 h。TBST充分洗膜后,ECL顯影。
2 結果
2.1 重組質粒pcDNA3.1-Smad2、pcDNA3.1-Smad3、pcDNA3.1-Smad4鑒定結果 圖1A顯示,4號泳道上可見兩條清晰的條帶,其中一條與pcDNA3.1空載體(5 428 bp)的大小一致,另一條帶與第5泳道的PCR產物(Smad2)大小一致,提示pcDNA3.1-Smad2重組質粒構建成功。圖1B顯示,4號泳道上可見兩條清晰的條帶,其中一條帶與pcDNA3.1空載體(5 428 bp)的大小一致,另一條帶與第5泳道的PCR產物(Smad3)大小一致,提示pcDNA3.1-Smad3重組質粒構建成功。圖1C顯示,4號泳道上可見兩條清晰的條帶,其中一條條帶的大小與PCR產物(Smad4)的大小一致,提示pcDNA3.1-Smad4重組質粒構建成功。測序結果證實插入的Smad2、Smad3、Smad4無突變。

注:M1為λ-Hind Ⅲ digest DNA Marker;1為pcDNA3.1質粒;2為pcDNA3.1-Smad重組質粒;3為pcDNA3.1-Smad重組質粒經EcoR Ⅰ單酶切產物;4為pcDNA3.1-Smad重組質粒雙酶切產物;5為菌液PCR產物;M2為DL2000 DNA Marker。
圖1Smad真核表達質粒鑒定結果
2.2 EL4細胞中Smad2、Smad3及Smad4蛋白表達變化 將構建成功的pcDNA3.1-Smad2、pcDNA3.1-Smad3、pcDNA3.1-Smad4質粒轉染至EL4細胞72 h后,EL4細胞中Smad2、Smad3、Smad4蛋白表達上調。見圖2。
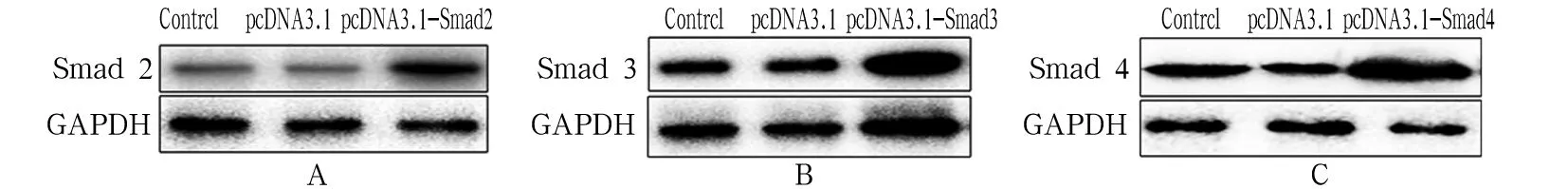
注:A為Smad2蛋白表達;B為Smad3蛋白表達;C為Smad4蛋白表達。
圖2EL4細胞中Smad2、Smad3及Smad4蛋白表達
3 討論
Smad蛋白最早從果蠅及線蟲基因篩查中鑒定出來[8,9],是TGF-β家族受體下游的信號轉導分子。根據Smad蛋白在TGF-β信號轉導中的功能差異,分為受體調控Smad(R-Smad1/2/3/5/6)、通用Smad(Co-Smad4)及抑制型Smad(I-Smad6/7)。R-Smad能夠與受體結合并被受體磷酸化而激活;Co-Smad能夠與活化的R-Smad結合形成復合物,復合物進入細胞核結合DNA,與多種轉錄輔因子相互作用共同調控基因轉錄;I-Smad 作為R-Smad的競爭性抑制子,能負性調控TGF-β信號通路。經典的Smad信號通路通過TGF-β與絲氨酸/蘇氨酸激酶Ⅰ型和Ⅱ型受體結合發揮效應。Ⅰ型受體激酶上游存在一個富含甘氨酸/絲氨酸的G 序列,TGF-β與Ⅱ型受體結合從而磷酸化Ⅰ型受體GS區,GS區的磷酸化隨之活化Ⅰ型受體,活化的Ⅰ型受體繼而磷酸化R-Smad C末端的SXS基序中的絲氨酸。活化的R-Smad與Smad4形成蛋白復合物,隨后轉入細胞核內,與不同的Smad結合原件、DNA轉錄因子、轉錄共激活劑或共抑制劑結合,從而實現對靶基因的調控[10]。
Foxp3是調控調節性T細胞發育及功能的關鍵性的轉錄因子。TGF-β1通過誘導Smad蛋白調節Foxp3的表達[11]。有研究證實,TGF-β誘導的轉錄因子Smad3和NFAT協同作用,與Foxp3內含子中的增強子元件相結合實現對Foxp3的調控。Smad3是TGF-β1信號通路的近端分子,在Foxp3的表達中起主要作用。在野生型小鼠中TGF-β1是T細胞表達Foxp3的一個有效的誘導劑;在Smad3敲除小鼠中,Foxp3+T細胞明顯減少[12]。因此,Smad3在TGF-β1誘導的Foxp3的產生過程中起重要的調節作用[13]。在之前的研究中,Smad3和Smad4已被證實能調節由TGF-β誘導的調節性T細胞,但在Th17細胞的產生中作用不大[7]。當Smad2缺失時,TGF-β誘導的Foxp3的表達會急劇減少。小鼠脾細胞經細粒棘球蚴囊液處理后,細粒棘球蚴囊液能上調對小鼠脾臟細胞中Treg相對特異分子Foxp3的表達,而下調TGF-β1的下游信號通路Smad4的表達,兩者之間呈負相關[14]。外周血中,Smad7和Foxp3水平能提示慢性移植腎腎病的發展程度,是檢測慢性移植腎腎病的一個無創指標。Smad7可能通過某種機制調控Foxp3的表達。
本研究將提取的重組質粒pcDNA3.1-Smad2、pcDNA3.1-Smad3及pcDNA3.1-Smad4分別用限制性內切酶雙酶切后,進行瓊脂糖凝膠電泳。結果重組質粒經雙酶切后可見2條清晰條帶,一條與目的片段的大小一致,另一條與pcDNA3.1空載體的大小一致,提示構建的重組質粒pcDNA3.1-Smad2、pcDNA3.1-Smad3、pcDNA3.1-Smad4中有目的片段插入。DNA測序及比對結果表明,重組質粒pcDNA3.1-Smad2,pcDNA3.1-Smad3和pcDNA3.1-Smad4中的插入片段序列與目的基因的CDS區序列完全相同,進一步說明成功構建Smad2、Smad3、Smad4高表達載體。且將Smad真核表達質粒成功轉染入EL4細胞后,能誘導目的蛋白高表達。本研究為進一步探究Smad蛋白調控Foxp3表達的機制奠定了基礎。
參考文獻:
[1] Zeng H, Yang Z, Xu N, et al. Connective tissue growth factor promotes temozolomide resistance in glioblastoma through TGF-beta1-dependent activation of Smad/ERK signaling[J]. Cell Death Dis, 2017,8(6):e2885.
[2] Wang W, Song B, Anbarchian T, et al. Smad2 and Smad3 regulate chondrocyte proliferation and differentiation in the growth plate[J]. PLoS Genet, 2016,12(10):e1006352.
[3] 王立志,秦雪梅,孫元欣,等.FOXP3免疫調節基因表達與異基因造血干細胞移植后急性移植物抗宿主病的關系[J].山東醫藥,2012,52(9):58-60.
[4] Zou JY, Su CH, Luo HH, et al. Curcumin converts Foxp3+regulatory T cells to T helper 1 cells in patients with lung cancer[J]. J Cell Biochem, 2018,119(2):1420-1428.
[5] Bluestone JA. FOXP3, the Transcription factor at the heart of the rebirth of immune tolerance[J]. J Immunol, 2017,198(3):979-980.
[6] Seghezzo S, Bleesing JJ, Kucuk ZY. Persistent enteropathy in a toddler with a novel FOXP3 mutation and normal FOXP3 protein expression[J]. J Pediatr, 2017,186:183-185.
[7] Tardif G, Pelletier JP, Fahmi H, et al. NFAT3 and TGF-beta/SMAD3 regulate the expression of miR-140 in osteoarthritis[J]. Arthritis Res Ther, 2013,15(6):R197.
[8] Sekelsky JJ, Newfeld SJ, Reftery LA, et al. Genetic characterization and cloning of mothers against dpp, a gene required for decapentaplegic function in Drosophila me1anogaster[J]. Genetics, 1995,139(3):1347-1358.
[9] Savage C, Das P, Finelli A, et al. Caenorhabditis elegans sma-2, sma-3 and sma-4 genes define a novel conserved family of TGF-β pathway components[J]. Proc Natl Acad Sci USA, 1996,93(1):790-794.
[10] Schmierer B, Hill CS. TGFbeta-SMAD signal transduction:molecular specificity and functional flexibility[J]. Nat Rev Mol Cell Biol, 2007, 8(12):970-982.
[11] Ma S, Wang Q, Ma X, et al. FoxP3 in papillary thyroid carcinoma induces NIS repression through activation of the TGF-beta1/Smad signaling pathway[J]. Tumour Biol, 2016,37(1):989-998.
[12] Zhang C, Zhang X, Chen XH. Hypothesis: human umbilical cord blood-derived stromal cells regulate the Foxp3 expression of regulatory T cells through the TGF-beta1/Smad3 pathway[J]. Cell Biochem Biophys, 2012,62(3):463-466.
[13] Schlenner SM, Weigmann B, Ruan Q, et al. Smad3 binding to the foxp3 enhancer is dispensable for the development of regulatory T cells with the exception of the gut[J]. J Exp Med, 2012,209(9):1529-1535.
[14] Chakraborty S, Panda AK, Bose S, et al. Transcriptional regulation of FOXP3 requires integrated activation of both promoter and CNS regions in tumor-induced CD8+Treg cells[J]. Sci Rep, 2017,7(1):1628.

