乳腺癌組織中小谷氨酰胺三角四肽重復區蛋白α的表達變化及其意義
施育華,劉小兵,龔建平
(1 鹽城市第三人民醫院,江蘇鹽城 224001;2江蘇省腫瘤醫院)
乳腺癌是女性最常見的惡性腫瘤,是婦女惡性腫瘤死亡的主要原因[1],因此乳腺癌的早期診斷尤為重要。靶基因在乳腺癌預防、診斷和治療中的作用是目前研究熱點[2]。SGT是一種細小病毒NS1蛋白的結合伴侶,可參與細胞周期調控、蛋白質折疊、蛋白質運輸以及蛋白質泛素化等細胞生物過程[3]。SGT能夠參與激素受體或其他途徑的蛋白質之間的相互作用[4]。SGT與β-淀粉樣肽相互作用有關[5]。SGT與細胞有絲分裂有關,在哺乳動物細胞分裂,細胞凋亡和基因調控中發揮作用[6]。小谷氨酰胺三角四肽重復區蛋白α(SGTA)是SGT家族中的重要成員,與SGT具有60%的氨基酸序列同源性。SGTA是一個新的細胞周期調節蛋白,SGTA的過表達與肺癌、肝癌和食管鱗狀細胞癌等腫瘤的發生發展及預后有關[7~9]。但目前SGTA在乳腺癌組織中的表達及其意義尚未明確。增殖細胞核抗原(Ki-67)是一種增殖細胞相關的核抗原,目前臨床將其作為標記細胞增殖狀態的抗原。本研究觀察了乳腺癌組織中的表達變化,分析其與臨床病理參數及預后的關系,現將結果報告如下。
1 資料與方法
1.1 臨床資料 選擇2002年6月~2012年06月間鹽城市第三人民醫院和江蘇省腫瘤醫院收治的90例女性乳腺癌患者,均行腫瘤切除術,術中留取乳腺癌組織及相應癌旁組織(距離癌組織≥5 cm)的石蠟包埋標本。患者中年齡29~78 歲,中位年齡50歲;所有患者在術前均未接受過任何治療,病理診斷由病理科高級職稱專家經雙盲法確認,臨床病理資料完整。本研究經本院倫理委員會批準。
1.2 乳腺癌組織及癌旁正常組織SGTA、Ki-67檢測 采用免疫組織化學法。取乳腺癌組織、癌旁正常組織將石蠟組織切4 μm片, 4 %甲醛和梯度酒精脫蠟, 0.3 %過氧化氫封閉內源性過氧化物酶的活性。雙蒸水沖洗后100 ℃烤箱5 min ,自然冷卻;PBS沖洗3遍,加入10 %小牛血清封閉非特異性抗原, PBS沖洗后,滴加多克隆兔抗人SGTA抗體、Ki-67抗體(1∶100,均購自Santa Cruz, USA),36 ℃孵育120 min,PBS沖洗3遍;滴加生物素抗兔IgG PBS二抗孵育30 min,用PBS緩沖液沖洗3遍;DAB顯色,蘇木精復染,明膠甘油封片。鏡下觀察判斷。SGTA以乳腺癌細胞質和(或)細胞核(極少數)出現棕黃色或棕褐色顆粒為陽性表達,Ki-67陽性細胞指細胞核染色為淡黃至棕黃色或棕褐色顆粒。每張切片隨機選擇5個有代表性的高倍視野(×400),計算陽性細胞百分率。陽性細胞百分率≤32%者為低表達,>32%者為高表達。
1.3 乳腺癌患者生存情況隨訪 對90例患者進行隨訪,采用門診或住院復查與電話隨訪相結合的方式進行。生存時間按患者手術時間為起始點,以月為單位進行計算。總生存時間(OS)定義為從手術之日開始至死亡或末次隨訪時間,隨訪時間為18~120個月,中位隨訪時間為64個月。
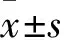
2 結果
乳腺癌組織、癌旁正常組織中SGTA的陽性表達率分別為76.7%(69/90)、35.5%(32/90),二者比較,P<0.05。乳腺癌組織、癌旁正常組織中Ki-67的陽性表達率分別為80.0%(72/90)、32.2%(29/90),二者比較,P<0.05。
SGTA、Ki-67的表達與乳腺癌臨床病理參數的關系見表1。SGTA的表達與乳腺癌的組織分化程度、淋巴結轉移及雌激素受體(ER)有關(P均<0.05),與患者年齡、腫瘤直徑、組織學類型、孕激素受體(PR)、人表皮生長因子受體2(HER2)及p53等無關(P均>0.05)。Ki-67的表達與乳腺癌的組織分化程度、淋巴結轉移及ER有關(P均<0.05),而與患者年齡、腫瘤直徑、組織學類型、p53等無關(P均>0.05)。
乳腺癌組織中SGTA和Ki-67的表達呈正相關(r2=0.356,P=0.003)。
組織分化程度、淋巴結轉移、Ki-67高表達及SGTA高表達與患者預后有關(P均<0.05),而與患者年齡、腫瘤直徑、ER、PR、HER2及p53無關(P均>0.05)。多因素分析進一步發現,SGTA和Ki-67影響乳腺癌術后生存時間的危險系數分別為3.303、2.468(P均<0.05)。SGTA高表達者與低表達者的OS分別為51.8月、74.6月,二者比較,P<0.05。 乳腺癌患者OS比較見圖1。

表1 SGTA 及Ki-67 的表達與乳腺癌臨床病理參數的關系

圖1 90例乳腺癌患者生存曲線
3 討論
在我國乳腺癌已經成為女性惡性腫瘤患者死亡的主要原因之一[10]。乳腺癌早期診斷率的提高和女性患者生存和預后息息相關。目前臨床上有特異性能提高確診率及改善治療預后相關的靶向分子極少,雖然近年來乳腺癌的診斷方法有所改善,但早期乳腺癌患者診斷率依然較低,預后仍然很差[11]。
SGT最初被鑒定為病毒蛋白的結合蛋白,通過不同的結構域廣泛參與細胞的各種生物進程,進一步產生相互作用。研究發現SGTA為其家族成員,它能夠參與激素受體或其他途徑蛋白相互作用,如可以與Bag-6/Bat-3等蛋白相互作用并且減少其蛋白水平,從而導致細胞有絲分裂停滯在早中期,進而凋亡[9]。SGTA作為SGT家族中的重要成員,它可以作為雄激素受體共同伴侶之一,在細胞質中,通過維持雄激素受體來限制相關信號通路[16],參與某些細胞的發展進程[6,12]。SGTA稱為有絲分裂觸發因子[8],可能參與腫瘤的進展和轉移[13,14],因而研究其在乳腺癌中的發生發展具有重要的意義。本文通過分析乳腺癌中SGTA表達,探討其與乳腺癌相關參數及患者預后可能存在的關聯。通過免疫組化方法發現SGTA在乳腺癌組織與鄰近癌旁組織中的表達有顯著性的差異。
Ki-67已被證實是腫瘤細胞增殖活性的標記物[15,16],Ki-67在乳腺癌組織與鄰近癌旁組織中的表達也有顯著性的差異,結果提示SGTA與Ki-67的高增值活性可能與乳腺癌的發生發展存在關聯,SGTA過度表達可能代表乳腺癌發展的一個重要機制[17,18]。 本研究評估了患者SGTA與Ki-67的表達與臨床病理參數之間的關系,結果表明,SGTA與Ki-67表達與組織學分級、ER、淋巴轉移與否有關,患者組織學分級越差更容易顯示出高活性的SGTA。相關性分析結果顯示乳腺癌組織中SGTA的表達與Ki-67呈正相關,提示SGTA可能與腫瘤的增殖有關,SGTA可能通過調控乳腺癌組織中Ki-67表達或介導它們之間的某種通路發生作用。臨床病理參數與生存狀況的關系研究表明,組織分化程度,淋巴結轉移,Ki-67高表達及SGTA高表達與患者預后相關,且SGTA和Ki-67的危險系數分別達到3.303、2.468,SGTA高表達乳腺癌患者OS低于SGTA低表達者。提示SGTA和Ki-67對乳腺癌的侵潤轉移有重要的作用。
綜上所述,乳腺癌組織中SGTA高表達,SGTA參與了乳腺癌的發生、發展。SGTA是影響乳腺癌患者預后的獨立危險因素。SGTA可能成為乳腺癌一個新的靶向檢測指標,但其具體作用機制以及對患者預后的影響尚需進一步臨床驗證。
參考文獻:
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005,55(2):74-108.
[2] Kelloff GJ, Sigman CC. Cancer biomarkers: selecting the right drug for the right patient[J]. Nat Rev Drug Discov, 2012,11(3):201-214.
[3] Cziepluch C, Lampel S, Grewenig A, et al. H-1 parvovirus-associated replication bodies: a distinct virus-induced nuclear structure[J]. J Virol, 2000,74(10):4807-4815.
[4] D′Andrea LD, Regan L. TPR proteins: the versatile helix[J]. Trends Biochem Sci, 2003,28(12):655-662.
[5] Fonte V, Kapulkin WJ, Taft A, et al. Interaction of intracellular beta amyloid peptide with chaperone proteins[J]. Proc Natl Acad Sci U S A, 2002,99(14):9439-9444.
[6] Winnefeld M, Grewenig A, Schnolzer M, et al. Human SGT interacts with Bag-6/Bat-3/Scythe and cells with reduced levels of either protein display persistence of few misaligned chromosomes and mitotic arrest[J]. Exp Cell Res, 2006,312(13):2500-2514.
[7] Xue Q, Lv L, Wan C, et al. Expression and clinical role of small glutamine-rich tetratricopeptide repeat (TPR)-containing protein alpha (SGTA) as a novel cell cycle protein in NSCLC[J]. J Cancer Res Clin Oncol, 2013,139(9):1539-1549.
[8] Lu C, Liu G, Cui X, et al. Expression of SGTA correlates with prognosis and tumor cell proliferation in human hepatocellular carcinoma[J]. Pathol Oncol Res, 2014,20(1):51-60.
[9] Yang X, Cheng L, Li M, et al. High expression of SGTA in esophageal squamous cell carcinoma correlates with proliferation and poor prognosis[J]. J Cell Biochem, 2014,115(1):141-150.
[10] Wilson CM, Tobin S, Young RC. The exploding worldwide cancer burden: the impact of cancer on women[J]. Int J Gynecol Cancer, 2004, 14(1):1-11.
[11] Wang H, Shen H, Wang Y, et al. Overexpression of small glutamine-rich TPR-containing protein promotes apoptosis in 7721 cells[J]. FEBS Lett, 2005,579(5):1279-1284.
[12] Buchanan G, Ricciardelli C, Harris JM, et al. Control of androgen receptor signaling in prostate cancer by the cochaperone small glutamine rich tetratricopeptide repeat containing protein alpha[J]. Cancer Res, 2007,67(20):10087-10096.
[13] Moritz A, Li Y, Guo A, et al. Akt-RSK-S6 kinase signaling networks activated by oncogenic receptor tyrosine kinases[J]. Sci Signal, 2010, 3(136):64.
[14] Mann CD, Neal CP, Garcea G, et al.Prognostic molecular markers in hepatocellular carcinoma: a systematic review[J]. Eur J Cancer, 2007, 43(6):979-992.
[15] Schantl JA, Roza M, De Jong AP, et al. Small glutamine-rich tetratricopeptiderepeat-containing protein (SGT) interacts with the ubiquitin-dependent endocytosis (UbE)motif of the growth hormone receptor[J]. Biochem J,2003,373( 3):855-863.
[16] 李靜平,張香梅.乳腺浸潤性導管癌組織FOXP3表達及其預后意義[J].中華腫瘤防治雜志,2017,24(1):23-29.
[17] 陳萬青,鄭榮壽.中國女性乳腺癌發病死亡和生存狀況[J].中國腫瘤臨床,2015,42(13):668-674.

