人前列腺癌PC-3細胞系中腫瘤干細胞的富集、鑒定以及生物學特征的初步研究
汪 洋 馮楊焜 吳 巖 徐新宇 于得水 董 堅 馮寧翰 包文平
1.南京醫科大學附屬無錫第二醫院泌尿外科(江蘇無錫 214002);2.江蘇省錫山高級中學;3.南通大學附屬南通第三醫院泌尿外科
前列腺癌是威脅男性健康的重要疾病。在美國,前列腺癌已經超越肺癌,成為男性發病率第一的腫瘤[1]。在中國,雖然前列腺癌的發病率遠低于歐美地區,但是近年來發病率呈現明顯的上升趨勢[2]。目前前列腺癌主要依賴人前列腺特異性抗原(PSA)進行早期診斷[3,4]。然而前列腺癌早期癥狀不明顯,缺乏特異性體征,導致患者就診時往往已經進展至中晚期,只能進行內分泌保守治療,多數患者病情進一步惡化,最終轉為激素非依賴性腫瘤[5],發生復發、轉移而預后不佳,迄今仍無有效的治療方法。
腫瘤干細胞(cancer stem cell,CSC)是存在于腫瘤細胞系或腫瘤組織中的一小群特殊的細胞,具有自我更新、多向分化以及高致瘤性等特點[6],而且對化療以及放療具有高度抵抗[7,8],不易被常規治療手段所根除,被認為是腫瘤形成的母細胞并能維持腫瘤不斷生長,是腫瘤發生、進展、轉移和復發的根源。起初,學者們認為CD44、CD133以及整合素α2β1可以作為分離前列腺癌的特異性標記物[9],隨后人們又發現轉運蛋白G超家族成員2(ABCG2)陽性的細胞具有前列腺癌干細胞特征[10],因此本研究通過流式細胞儀篩選出ABCG2陽性的PC-3 側群(SP)細胞,利用體外功能實驗研究SP細胞與NST細胞在生物學特征上的差異,探索SP細胞在前列腺癌發生、轉移和與復發中扮演的角色。但是,由于其在總體腫瘤細胞中所占比例極低[10],實驗研究中極難獲得足夠數量的前列腺癌干細胞,因此,尋找到簡便而高效地富集前列腺癌干細胞的方法具有重要科學價值和現實意義。
材料與方法
一、實驗材料
(一)細胞
人前列腺癌PC-3細胞系,購自中國科學院上海細胞庫。
(二)試劑
胎牛血清(F B S)、表皮細胞生長因子(EGF)、堿性成纖維細胞生長因子(bFGF)、無血清添加劑B27均購自美國GIBCO公司。牛血清白蛋白(BSA)、胰島素、Hoechst 33342細胞核染料、PI染料、維拉帕米購自美國Sigma公司。反轉錄試劑盒購自美國Promega公司。實時定量 PCR試劑盒購自日本Takara公司。Anti-α-Tubulin MAb、Anti-VEGF mAb、 HRP 標記的羊抗鼠以及羊抗兔 IgG抗體購自美國Santa Cruz 公司。Anti-MMP7 mAb和Anti-ABCG2 mAb抗體購自美國Abcam公司。Transwell小室購自Millipore公司。Matrigel購自加拿大BD Biosciences公司。血管生成載玻片購自德國Ibidi公司。CCK8試劑盒購自日本同仁公司。
(三)儀器
流式細胞儀購自加拿大BD Biosciences公司,由南京醫科大學分析測試中心提供。
二、實驗方法
(一)PC-3細胞系懸浮聚球培養法
選擇常規貼壁培養的,處于對數生長期的PC-3細胞株,用PBS 緩沖液洗滌2遍,隨后利用含有0.2g/L EDTA的 胰蛋白酶對貼壁細胞進行消化,重懸于SFM培養液中,調整細胞密度為1×103/mL,然后接種于超低黏附的6孔板中,每個孔接種1×103個細胞,以SFM 培養液進行懸浮培養,每天搖動6孔板數次以阻止細胞貼壁。待細胞增殖形成顯著團塊后,收集于離心管中,待自然沉降30 min后小心棄去一半量的陳舊上清液,加入等量新鮮SFM 并緩慢機械吹打成單細胞懸液,再次重懸于SFM,繼續在37 ℃、5% CO2細胞培養箱中培養。接種細胞后每隔3d在倒置顯微鏡下觀察懸浮細胞球數目及形態。
(二)觀察PC-3 細胞兩種生長方式的轉化
當PC-3 細胞在SFM 培養液中形成懸浮細胞球后, 收集并重懸于SSM 培養液中常規培養,待其呈單層細胞貼壁生長后,再次消化、收集并重懸于SFM培養液中,細胞可以再次形成懸浮細胞球。以上可重復多次。
(三)流式細胞學分選側群細胞
以PC-3懸浮成球細胞為實驗組,常規以含血清培養液(SSM)中單層貼壁培養的PC-3細胞為對照組;分別將兩種細胞制備成單細胞懸液,調整細胞密度為1×106/mL, 分別設實驗管及對照管。實驗管加入Hoechst 33342(終質量濃度為5mg/L),對照管則先加入維拉帕米(終質量濃度為50μmol/L)孵育30 min,然后再加入Hoechst 33342(終濃度為5mg/L),37 ℃避光孵育90min,期間每15min振蕩混勻1次,然后4℃低溫離心5min,棄上清液,4 ℃預冷,PBS緩沖液洗滌2遍, 重懸于含體積分數為2% FBS 的PBS 中,加入PI 溶液(終質量濃度為1mg/L),冰上孵育30min。采用FACS 流式細胞儀(激發光350nm,采集波長為450nm和675nm)檢測SP 細胞比率。
(四)Transwell小室細胞遷移實驗檢測SP 細胞遷移能力
胰酶消化細胞,終止消化后離心棄去培養液,用PBS洗1~2遍,用無血清培養基重懸。調整細胞密度至5×104/mL。取細胞懸液100μL加入Transwell小室。在24孔板下室中加入600μL含20% 血清的完全培養基。37 ℃、5% CO2細胞培養箱中常規培養12~24h,每隔6h收取24孔板中的Transwell小室,棄去孔中培養液,用無鈣的PBS洗2遍,甲醇固定30min,將小室適當風干。0.1%結晶紫染色20 min,用棉簽輕輕擦掉上層未遷移細胞,用PBS洗3遍。400倍顯微鏡下隨機5個視野觀察細胞,通過計數軟件統計實驗中進入下室的細胞數,從而獲得兩種細胞的遷移情況。
(五)Transwell小室細胞侵襲實驗檢測SP 細胞侵襲能力
采用BD公司的Matrigel按照1:8稀釋,包被Transwell小室底部膜的上室面,置37℃培養箱孵育30min使Matrigel聚合成凝膠。使用前進行基底膜水化。
胰酶消化細胞,終止消化后離心棄去培養液,用PBS緩沖液洗1~2遍,用無血清培養基重懸。調整細胞密度至5×105/mL。取細胞懸液100μL加入Transwell小室。24孔板下室加入600μL含20% 血清的完全培養基。37 ℃、5% CO2細胞培養箱中常規培養12~48h,每隔6h收取24孔板中的Transwell小室,棄去孔中培養液,用無鈣的PBS緩沖液洗2遍,甲醇固定30min,將小室適當風干。0.1%結晶紫染色20 min,用棉簽輕輕擦掉上層未遷移細胞,用PBS緩沖液洗3遍。400倍顯微鏡下隨機5個視野觀察細胞,通過計數軟件統計實驗中進入下室的細胞數,從而獲得兩種細胞的侵襲情況。
(六)分析SP 細胞促血管生成能力
實驗前一天將Matrigel置于冰盒中,放入4 ℃冰箱,使膠能過夜緩慢融化(同樣要準備4 ℃預冷的槍頭用于吸取Matrigel)。開始實驗前,將Matrigel始終保持放在冰盒中。隨后取出血管生成載玻片。每孔中加入10 μL Matrigel后蓋上血管生成載玻片的蓋子,放入37 ℃培養箱中,靜置30min左右,等待膠凝結。胰酶消化人臍靜脈內皮細胞(HUVEC),準備密度為2×105/mL的細胞懸液,充分混勻。每孔加入50 μL的細胞懸液(即每孔種104個細胞)。放入37℃培養箱中孵育,每1h倒置顯微鏡下觀察微管形成情況并及時在顯微鏡下進行拍照,最后按照以下公式進行計算:

公式中,“發芽細胞”表示單個細胞形態由圓形演變成帶尖角的細胞形態;“相連的細胞”指單個細胞相互接觸、呈串連接的細胞;“多角形”表示多個細胞相互連接圍成的多角形的管腔;分值“0”表示出現的多角形結構的細胞只有 1 層;“1”表示出現的多角形結構的細胞有 2~3 層;“3”表示出現的多角形結構的細胞超過 4 層以上。
(七)CCK8實驗檢測SP 細胞增殖能力
選擇對數期生長的單層貼壁生長的細胞,消化計數后重懸于10% FBS的RPMI-1640培養基。調整細胞濃度,保證每孔100μL細胞懸液中含有2×103個細胞,每組設置4個復孔,將培養板在培養箱預培養24h(37℃, 5% CO2的條件下)后,每24h檢測一塊培養板中細胞的增殖活性。向每孔加入10 mL CCK-8溶液,將培養板在培養箱內孵育2h,用酶標儀測定在450 nm處的吸光度。
(八)反轉錄實時定量PCR(RT-qPCR)
提取細胞總RNA后通過反轉錄體系獲取cDNA,經過實時定量PCR反應測得最終的Ct值。
(九)Western blot實驗
收集處于對數期生長的細胞,經預冷的PBS洗滌后加入細胞裂解液提取細胞總蛋白。采用預先配好的10% SDS-PAGE電泳凝膠,將提取的蛋白樣品按照每孔30 μL加入各泳道。電泳分離后進行電轉,使得蛋白從凝膠轉移至聚偏氟乙烯(PVDF)膜上,結束后將PVDF膜放入體積分數為5%的脫脂牛奶中室溫封閉1h,將膜按照不同蛋白分子量進行裁剪,分別用1:1000稀釋的Anti-Tubulin mAb、Anti-VEGF mAb、Anti-MMP7 mAb、Anti-ABCG2 mAb抗體孵育4℃過夜。孵育后的膜放入TBS-T中洗滌3次,用5%脫脂牛奶分別制備HRP標記羊抗鼠抗體和羊抗兔抗體作為二抗,分別在室溫度孵育1h,結束后用TBS-T洗滌3次。最后利用化學發光劑進行發光檢測。
結 果
一、PC-3 懸浮細胞球形成
PC-3腫瘤 細胞系在無血清替代培養液SFM 中懸浮培養48 h 后可見少量體積較小、松散的懸浮細胞球,第7天開始觀察到典型的PC-3 懸浮細胞球,直徑>60μm。此后細胞球逐漸增大、增多,第14天時懸浮細胞球數量較第7天時數量顯著增多(P<0.05),且形態大小各異。隨著時間延長,細胞球數量和體積繼續增大(圖1)。而用SSM 培養的PC-3 細胞系,則在接種后2 h 左右開始貼壁,不產生懸浮細胞團。
二、PC-3 懸浮球細胞在有無血清的條件下其生長方式可以出現交替轉換
將PC-3 懸浮細胞球吹散、重懸為單細胞懸液后接種于SSM 中,12 h 后可以于顯微鏡下觀察到PC-3 成球細胞沉于培養皿的底部并貼壁生長,且逐漸形成單細胞層, 形態上與常規培養的PC-3NST細胞無明顯差異。經胰蛋白酶消化、 重懸為單細胞懸液后,重新培養于SFM中,7~9d細胞仍懸浮存活并聚集成球狀(圖2)。重復以上過程,相同現象可以完全復制出現, 而且這種轉換能力并不會隨著傳代而減弱。

圖1 第14天時懸浮細胞球數量較第7天時數量顯著增多

圖2 前列腺癌細胞株PC3在不同細胞培養條件下的細胞生長形態比較
三、PC-3 懸浮球細胞中富集了SP 細胞
FACS 雙波長分析顯示,PC-3 懸浮球細胞中SP細胞比率為(0.768±0.101)%(圖3A), 且保持相對穩定,而在PC-3 NST細胞中SP細胞比率為(0.035±0.023)%(圖3B)。兩者間差異具有統計學意義(P<0.05)。
四、Transwell小室細胞遷移實驗檢測SP細胞遷移能力
我們利用Transwel小室遷移實驗檢測細胞的遷移能力,觀察到在6h時NST細胞和SP細胞遷移到小室底部的細胞數,分別為(82±14)個細胞/視野 和(105±18)個細胞/視野;12h時分別為(134±21)個細胞/視野和(244±31)個細胞/視野。與NST細胞相比較,SP細胞在6h和12h遷移到小室底部的細胞數明顯增多,差異具有統計學意義(P<0.05,圖4),這提示我們SP細胞具有更強的遷移能力。
五、Transwell小室細胞侵襲實驗檢測SP細胞穿膜侵襲能力
我們又對兩組細胞進行了Transwel小室細胞侵襲實驗,與常規培養的NST細胞相比較,在8h時NST細胞和SP細胞穿過Matrigel 膠到達小室底部的細胞數分別為(68±5)個細胞/視野和(87±8)個細胞/視野;16h時分別為(120±22)個細胞/視野和(222±25)個細胞/視野。SP細胞在8h和16h穿過Matrigel膠到達小室底部的細胞數明顯增多,差異具有統計學意義(P<0.05,圖5),提示SP細胞具有更強的侵襲能力。

圖3 PC-3 懸浮球細胞中SP細胞比率顯著高于單層貼壁細胞
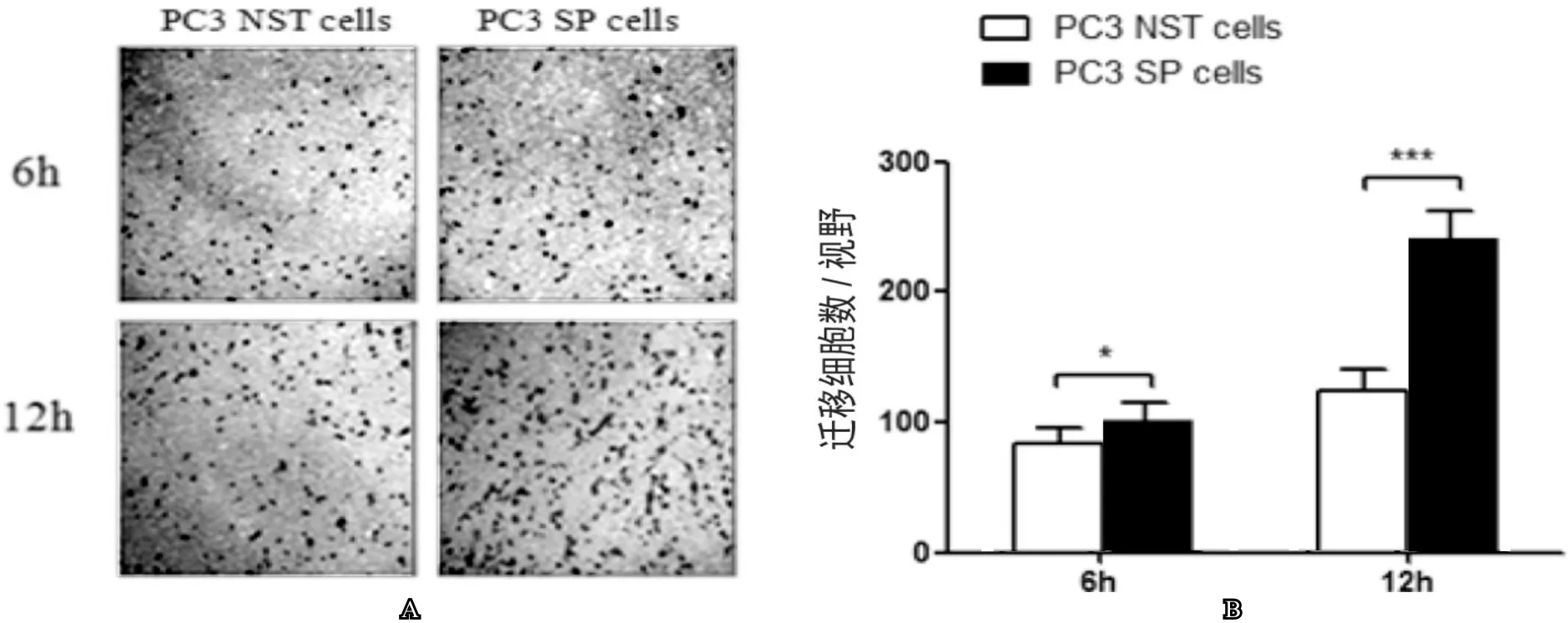
圖4 利用Transwell小室細胞遷移實驗比較SP細胞與NST細胞之間遷移能力
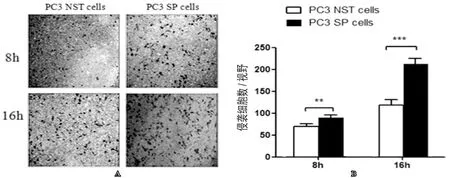
圖5 利用Transwell小室細胞侵襲實驗比較SP細胞與NST細胞之間細胞侵襲能力
六、利用HUVEC血管形成實驗檢測SP細胞的促血管生成能力
我們于不同時間段拍攝兩組HUVEC細胞在血管生成載玻片中的血管生成情況,3h時NST細胞和SP細胞血管生成指數分別為(2.36±0.17)/視野和(2.92±0.2)/視野,6h時分別為(3.33±0.11)/視野和(4.86±0.12)/視野;與NST細胞相比,SP細胞促血管形成速度快,同時生成血管數目多,差異具有統計學意義(P<0.05,圖6),說明SP細胞的促HUVEC血管生成能力強于NST細胞。

圖6 利用血管生成實驗觀察SP細胞與NST細胞促HUVEC細胞血管生成情況的差異
七、CCK8實驗檢測SP細胞增殖能力
利用CCK8實驗連續測量兩組細胞1d、2d、3d、4d、5d、6d的細胞增殖情況。結果顯示(圖7),與NST細胞相比,SP細胞的增殖能力相對較弱。
八、利用實時定量PCR檢測SP細胞中相關關鍵基因表達情況

圖7 CCK8實驗檢測SP細胞與NST細胞之間增殖能力的數據統計
我們利用RT-qPCR檢測SP細胞與NST細胞之間與血管生成相關的VEGF家族以及與遷移、侵襲關系密切的MMP家族基因和缺氧誘導因子HIF家族基因的表達水平,觀察兩組細胞之間各個基因表達水平差異情況。結果顯示,SP細胞中HIF2α、VEGFA、VEGFR2、VEGFD、MMP7、MMP10等基因的表達量明顯高于NST細胞,分別有2.47、2.34、2.75、6.69、1.62以及4.51倍左右的升高(圖8)。
九、利用Western blot檢測SP細胞中關鍵基因蛋白水平表達情況
根據RT-qPCR結果,我們發現了SP細胞與NST細胞之間差異表達明顯的一組關鍵基因,我們進一步利用Western blot分別檢測兩組細胞在VEGF、MMP7 和HIF2α蛋白水平上的表達情況,結果顯示,SP細胞中以上關鍵基因在蛋白水平上的表達量也顯著高于NST細胞,分別有2.87、1.29以及2.85倍左右的升高(圖9A、圖9B、圖9C)。與RT-qPCR結果相符。此外,我們還對兩種細胞內的ABCG2蛋白進行檢測,結果顯示SP細胞中ABCG2蛋白表達水平顯著高于NST細胞,差異具有統計學意義(圖9D)。

圖8 RT-qPCR檢測SP細胞與單層貼壁細胞之間關鍵基因的統計分析結果

圖9 利用Western blot分別檢測兩組細胞間與細胞侵襲以及血管生成相關的蛋白表達水平
討 論
目前很多腫瘤干細胞并沒有明確的表面標記物,這給篩選并分離出腫瘤干細胞提出了難題。Collins等[9]最早發現CD44、CD133以及整合素α2β1可以作為分離前列腺癌腫瘤干細胞的特異性標記物,然而隨后有文獻報道可以以CD44+/CD24-作為標記物從DU145[11]以及LNCaP[12]細胞系中分選出具有多向分化潛能的細胞群。其他的標記物類似乙醛脫氫酶(ALDH)[13-15]、轉錄因子Nanog[16-19]、OCT4[20]、Sox2[21]、CXCR4[22]、Sca-1[23,24]等也有報道可以作為前列腺癌干細胞的標記物進行應用。學者們在對這些標記物高表達的細胞群進行研究時,發現這些細胞也都具有干細胞的自我更新和多向分化潛能。然而,最近有研究表明[25],作為前列腺癌干細胞標記物的CD133,當表達陰性時依然擁有在小鼠內成瘤的能力。利用免疫熒光染色技術分析DU145細胞系中腫瘤干細胞表型,結果發現它們表現為CD44+/CD24+/α2β1+,而不是之前發現的CD44+/CD24-[26]。這些結果與之前的發現相矛盾,說明根據特異性標記物分選前列腺癌干細胞存在一定的困難,因此我們采用流式細胞儀側群分選的方法來分離得到側群細胞,通過研究前列腺癌側群細胞的生物學特征來探索前列腺癌干細胞。SP側群分選最初是Goodell等[27]提出,他們用Hoechst 33342細胞核染料對細胞進行染色,通過流式分選得出一部分染色較淡的細胞,稱為SP細胞。在后續的研究中,人們發現這群細胞也具有腫瘤干細胞的相關特性,可以用來替代表面標志物作為獲取腫瘤干細胞的新途徑,目前在膠質瘤[28]、卵巢癌[29]和鼻咽癌[30]中SP細胞的存在和功能也得到了進一步證實,因此人們認為側群細胞可以作為腫瘤干細胞的一種進行深入研究,而且相對于表面標記物的復雜性,側群分選更加簡單易行。
腫瘤干細胞理論為前列腺癌發病機制和靶向治療的研究開辟了嶄新的方向,迅速成為研究熱點。但是由于腫瘤干細胞在總體細胞中所占的比例極為稀少,為進一步深入研究設置障礙。因此,如何高效分離、富集和純化前列腺癌干細胞仍是目前學術界急待解決的難題。依靠表面特異性標記物流式分選腫瘤干細胞,雖然一度被認為是金標準,但長期研究發現,此方法仍存在較多局限性。在本研究中,我們采用體外無血清懸浮聚球法對常規貼壁培養的人雄激素非依賴性前列腺癌PC-3 細胞株進行懸浮培養,并成功富集了具有前列腺癌干細胞特性的細胞群,方法簡便并且高效。置于SSM 和SFM 兩種培養液中交替培養后,我們發現PC-3 懸浮球細胞與NST細胞之間可以相互轉換,而且這種生長形式的相互轉換并不會隨著傳代而減弱,證明PC-3 懸浮球細胞具有自我更新、多向分化潛能和微環境依賴性,并且可以相對穩定地遺傳。
同時,在本研究中,通過流式檢測技術得知PC-3 懸浮球細胞中SP 細胞比例顯著高于NST細胞中SP 細胞的比例,同樣證明通過懸浮聚球培養法可以從PC-3 細胞系中有效富集SP側群細胞。
除此之外,在本研究中,我們通過Transwel小室遷移、侵襲實驗,發現與NST細胞相比較,SP細胞具有更強的遷移以及侵襲能力。微管形成實驗結果顯示,SP細胞無論在促血管生成的速度以及HUVEC血管生成的數目上都顯著高于NST細胞。腫瘤干細胞生長周期受到調控,相對于腫瘤中其他癌細胞生長緩慢,這是為了維持其自身的穩定性,只有當腫瘤組織癌細胞減少時,腫瘤干細胞才會進行分裂,分化為癌細胞,補充損失的部分。因此,本次研究中CCK8實驗結果顯示SP細胞的增殖能力相對較弱,也驗證了這一假說,這也從另一方面證實SP細胞與腫瘤干細胞之間存在必然的關聯。
缺氧誘導因子在腫瘤的能量代謝、血管生成和轉移中起到重要作用,但是目前關于HIF2α的研究尚少。最新報道指出HIF2α在腎癌中參與CXCR4的擴增[31]以及VEGFA的表達調控[32],而CXCR4是目前報道的前列腺癌干細胞的標記物之一,說明HIF2α也可能參與了前列腺癌干細胞表面標記物的調節。此外,研究還發現[33]HIF2α參與CCL5/HIF2α/AR通路的信號調控,對前列腺癌干細胞的增殖和前列腺癌的轉移起到重要作用。VEGF是主要的血管生成因子,而VEGFR2作為VEGF受體,兩者結合后能夠促進腫瘤血管生成,引起腫瘤的增殖和侵襲。同時VEGF可能與HIF2α相互作用,共同調節前列腺癌中血管生成,但兩者之間是直接作用還是間接作用還需要進一步研究。基質金屬蛋白酶MMP家族與腫瘤形成密不可分,有研究證實MMP參與腫瘤的遷移侵襲過程,通過降解細胞外基質,侵蝕破壞基膜,使得腫瘤穿過并進入血管,轉移至繼發部位,MMP7和MMP10作為MMP家族中的成員,也被發現與前列腺癌轉移和侵襲相關[34]。本次研究我們利用RT-qPCR和Western blot實驗分別對與遷移、侵襲和血管生成可能相關的基因在mRNA、蛋白水平上進行檢測,我們發現SP細胞中HIF2α、VEGF、MMP表達量無論在mRNA水平還是蛋白水平上都明顯高于NST細胞,這與體外功能實驗結果相符合,進一步在分子水平上證實了SP細胞具有更強的遷移、侵襲以及促微管形成能力。
利用側群分選的方法避免了篩選前列腺癌標記物的困難,但是分離出的SP細胞是否與前列腺癌干細胞的所有特征相一致需要進一步去驗證。本課題只對前列腺癌PC-3細胞系進行了探討,其他的細胞系中如DU145、LNCaP等也需要進行同樣的研究。
綜上所述,前列腺癌SP細胞雖然在前列腺癌組織中含量很低,但是其對前列腺癌難以治愈提供了一種解釋,SP細胞具有腫瘤干細胞的自我更新以及多向分化潛能,它的遷移、侵襲以及促血管生成能力可能是晚期腫瘤轉移的關鍵所在,而較弱的增殖能力與其分裂周期長相關,大部分時間SP細胞都處于靜息狀態,能夠避免被作用于細胞周期的抗腫瘤藥物殺傷,這有可能是目前前列腺癌對臨床藥物治療不敏感的重要原因之一。在這些現有研究的基礎上,下一步我們將進一步深入研究調控前列腺癌SP細胞表達的基因,通過升高或者降低目的基因的表達,從而達到抑制前列腺癌SP細胞的作用,希望借此能夠尋找到一條治療前列腺癌的有效方案。
參考文獻
1 Siegel RL, Fedewa SA, Miller KD,et al.Cancer statistics for Hispanics/Latinos, 2015.CA Cancer J Clin2015;65(6):457-480
2 彭鵬, 龔楊明, 鮑萍萍, 等.中國2008年前列腺癌發病、死亡和患病情況的估計及預測.中華流行病學雜志2012; 33(10): 1056-1059
3 Stamey TA, Yang N, Hay AR,et al.Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate.N Engl J Med1987; 317(15): 909-916
4 Stamey TA, Kabalin JN, Ferrari M,et al.Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate.IV.Anti-androgen treated patients.J Urol1989; 141(5): 1088-1090
5 Semenas J, Allegrucci C, Boorjian SA,et al.Overcoming drug resistance and treating advanced prostate cancer.Curr Drug Targets2012; 13(10): 1308-1323
6 Clarke MF, Dick JE, Dirks PB,et al.Cancer stem cells--perspectives on current status and future directions:AACR Workshop on cancer stem cells.Cancer Res2006;66 (19): 9339-934
7 Li X, Lewis MT, Huang J,et al.Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy.J Natl Cancer Inst2008; 100(9): 672-679
8 Diehn M, Cho RW, Lobo NA,et al.Association of reactive oxygen species levels and radioresistance in cancer stem cells.Nature2009; 458 (7239): 780-783
9 Collins AT, Berry PA, Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells.Cancer Res2005; 65(23): 10946-10951
10 Gangavarapu KJ, Azabdaftari G, Morrison CD, et al.Aldehyde dehydrogenase and ATP binding cassette transporter G2 (ABCG2) functional assays isolate different populations of prostate stem cells where ABCG2 function selects for cells with increased stem cell activity.Stem Cell Res Ther2013; 4(5): 132
11 Salvatori L, Caporuscio F, Verdina A,et al.Cell-to-cell signaling influences the fate of prostate cancer stem cells and their potential to generate more aggressive tumors.PloS One2012; 7(2): e31467
12 Hurt EM, Kawasaki BT, Klarmann GJ,et al.CD44+CD24(-) prostate cells are early cancer progenitor/stem cells that provide a model for patients with poor prognosis.Br J Cancer2008; 98(4): 756-765
13 Hellsten R, Johansson M, Dahlman A,et al.Galiellalactone inhibits stem cell-like ALDH-positive prostate cancer cells.PloS One2011; 6(7): e22118
14 Li T, Su Y, Mei Y,et al.ALDH1A1 is a marker for malignant prostate stem cells and predictor of prostate cancer patients' outcome.Lab Invest2010; 90(2): 234-244
15 Yu C, Yao Z, Jiang Y,et al.Prostate cancer stem cell biology.Minerva Urol Nefrol2012; 64(1): 19-33
16 Chambers I, Colby D, Robertson M,et al.Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells.Cell2003; 113(5): 643-655
17 Mitsui K, Tokuzawa Y, Itoh H,et al.The Homeoprotein Nanog Is Required for Maintenance of Pluripotency in Mouse Epiblast and ES Cells.Cell2003; 113(5): 631-642
18 Noh KH, Kim BW, Song KH,et al.Nanog signaling in cancer promotes stem-like phenotype and immune evasion.J Clin Invest2012; 122(11): 4077-4093
19 Miyazawa K, Tanaka T, Nakai D,et al.Immunohistochemical expression of four different stem cell markers in prostate cancer: High expression of NANOG in conjunction with hypoxiainducible factor1α expression is involved in prostate epithelial malignancy.Oncol Lett2014;8(3):985-992
20 Lin Y, Yang Y, Li W,et al.Reciprocal regulation of Akt and Oct4 promotes the self-renewal and survival of embryonal carcinoma cells.Mol Cell2012; 48(4):627-640
21 Rodriguez-Pinilla SM, Sarrio D, Moreno-Bueno G, et al.Sox2: a possible driver of the basal-like phenotype in sporadic breast cancer.Mod Pathol2007; 20(4): 474-481
22 Miki J, Furusato B, Li H,et al.Identification of putative stem cell markers, CD133 and CXCR4, in hTERT-immortalized primary nonmalignant and malignant tumorderived human prostate epithelial cell lines and in prostate cancer specimens.Cancer Res2007; 67(7): 3153-3161
23 Mulholland D J, Li X, Morim A,et al.Lin-Sca-1+CD49fhigh stem/progenitors are tumor-initiating cells in the Pten-null prostate cancer model.Cancer Res2009;69(22): 8555-8562
24 Xin L, Lawson DA, Witte ON.The Sca-1 cell surface marker enriches for a prostate-regenerating cell subpopulation that can initiate prostate tumorigenesis.Proc Natl Acad Sci U S A2005; 102(19): 6942-6947
25 Grosse-Gehling P, Fargeas CA, Dittfeld C,et al.CD133 as a biomarker for putative cancer stem cells in solid tumours: limitations, problems and challenges.J Pathol2013; 229(3): 355-378
26 Rybak AP, He L, Kapoor A,et al.Characterization of sphere-propagating cells with stem-like properties from DU145 prostate cancer cells.Biochim Biophys Acta2011;1813(5): 683-694
27 Goodell MA, Brose K, Paradis G,et al.Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo.J Exp Med1996; 183(4):1797-1806
28 Kondo T, Setoguchi T, Taga T.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line.Proc Natl Acad Sci U S A2004; 101(3): 781-786
29 Bapat SA, Mali AM, Koppikar CB,et al.Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer.Cancer Res2005;65(8): 3025-3029
30 Wang J, Guo LP, Chen LZ,et al.Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line.Cancer Res2007;67(8): 3716-3724
31 Micucci C, Matacchione G, Valli D,et al.HIF2α is involved in the expansion of CXCR4-positive cancer stem-like cells in renal cell carcinoma.Br J Cancer2015;113(8): 1178-1185
32 Song W, Yeh CR, He D,et al.Infiltrating neutrophils promote renal cell carcinoma progression via VEGFa/HIF2α and estrogen receptor β signals.Oncotarget2015; 6(22): 19290-19304
33 Luo J, Lee SO, Cui Y,et al.Infiltrating bone marrow mesenchymal stem cells (BM-MSCs) increase prostate cancer cell invasionviaaltering the CCL5/HIF2α/androgen receptor signals.Oncotarget2015; 6(29):27555-27565
34 周洪瀾, 邢春偉, 葛巖, 等.前列腺癌中基質金屬蛋白酶7,9的表達及其與VEGF的關系.中國老年學雜志 2007;27(14): 1385-1387

