特發性少、弱精子癥患者精液質量指標及輔助生殖妊娠結局相關性研究*
孫寶剛 管福來 曹井賀** 梁魯南 董業浩 房 姣 楊愛軍
1.濟寧醫學院附屬醫院(山東濟寧 272000);2.濰坊醫學院
目前,世界范圍內不育影響著近20%的夫婦,其中,男性因素約占50%[1]。隨著臨床先進診斷技術的應用,多數男性不育的病因已被確定,但仍有30%~40%病例尚無法探知其確切病因,被診斷為特發性男性不育癥(包括特發性少精子癥、弱精子癥和畸形精子癥)[2]。
資料與方法
一、研究對象
收集在我院生殖醫學科就診的132例特發性男性不育癥患者為實驗組以及50例已生育的成年健康男性為對照組,在我們的研究中,無論是常規體外受精(IVF)周期還是卵胞漿內單精子注射(ICSI)周期,雙原核受精率的計算都是雙原核受精卵子數除以獲卵數。將132例患者分為IVF治療周期組72例,ICSI治療組60例納入本項研究。
為盡量減少外變量的影響,回顧性研究對患者的入選條件進行了嚴格規定。特發性少弱畸精子癥符合 WHO-5推薦標準診斷。無遺傳性疾病史、無傳染性疾病、無接觸 X 光和有害化學物質史,排除先天畸形、睪丸發育不良、內分泌系統疾病、生殖道感染、隱睪癥、睪丸萎縮;精路梗阻、精索靜脈曲張等病史及其他可能導致男性不育癥的,屬原因不明確的特發性男性不育癥。為減少女方因素對結果的影響,我們規定女方年齡在35歲及以下,繼發不孕,不孕年限為1.5至8年,且第一次行IVF/ICSI治療,僅有單純輸卵管因素,沒有其他相關婦科病史和盆腔手術史,且至少獲得了 5枚MII卵。
本項研究得到了我院生殖醫學倫理委員會的批準。所有的研究對象均在自愿的前提下簽署了科研知情同意書。
二、方法
(一)實驗方法
1.精液常規分析。
2.計算機輔助精子分析(CASA):采用計算機輔助精子分析儀(西班牙,SCA)檢測精子密度、總數、各級運動精子百分率和數量等。
3.精子形態學分析(Diff-Quik法):檢測精子形態正常率=正常形態精子數/計數精子總數×100%
4.精子功能檢查:依照 WHO 技術規范采集、處理和檢測精液標本, 檢測實驗組與對照組相關精子功能指標水平。精子-透明質酸結合率;精子核蛋白不成熟率;精子DNA 碎片率,頂體酶檢測均采用深圳市博銳德生物科技有限公司產品試劑盒,檢測操作均按試劑盒說明書要求進行。
5.精子處理:將實驗組與對照組的男性精液標本采用密度梯度分離法分離:其具體步驟為:取精子密度梯度分離培養基,吸取1mL下層(高密度)分離培養基置于離心管中,再吸取1mL上層分離培養基(低密度)緩慢地注于下層分離培養基的上面.兩層培養基的中間形成一個清晰的界面,37℃培養箱復溫。小心吸取1mL培養基化的精液覆蓋于上層分離培養基的液面。以(300~600)×g的速度離心20min。移去所有的分層溶液,只剩底部的沉淀。加2~3mL洗精培養基,將沉淀混勻。200×g離心5min。移去上清,再加入洗精培養基,重復離心洗滌步驟。用0.5mL IVF受精培養基沉淀。進行精于計數和精子質量評估。將處理獲得的精子調整密度至(50~300)×103/mL為宜,后置5%CO2、37℃、95%濕度培養箱待用。
(二)臨床操作
控制性超促排卵 實驗組與對照組女方均選擇長方案超促排卵:于啟動周期前次月經黃體中期肌注GnRH (達菲林1.33mg),月經第3天開始使用Gn促排卵,月經第6天起,行陰道B超檢查卵泡和子宮內膜發育情況,并以此及時調整用藥。直至有2~3個主導卵泡直徑在18mm以上時,結合激素檢測結果提示卵泡發育成熟,停用促排卵藥物,于當晚8點注射hCG5000~10000u。注射hCG后34~36h在陰道B超引導下穿刺取卵,記錄取卵數。
(三)受精及胚胎培養
實驗組與對照組均采用常規的體外受精。受精后18h觀察原核,出現2個原核和2個極體為正常受精卵,未出現兩原核期(2PN)為受精完全失敗。取卵后培養72h觀察胚胎形態,將優質胚胎移植到宮腔內。胚胎移植后14d檢測尿或血hCG陽性,移植后4~5周超聲檢查見胎心搏動為臨床妊娠。移植時先選擇常規受精來源的胚胎,若無常規受精來源胚胎則移植ICSI受精胚胎。
(四)胚胎按以下評分標準分級
形態學指標:4’-卵裂球大小均勻,碎片為≤5%;3’-卵裂球大小均勻或不等,碎片6%~20%;2’-卵裂球體積相等或不等,碎片21%~50%;1’-卵裂球少,碎片>50%。1、2級胚胎在發育過程中出現下列情況,胚胎評級時在形態學基礎上降一級:(1)授精20h內未見到原核,48h證實為延遲受精的胚胎。(2)取卵后48h超過8細胞或72h未超過5細胞。正常受精4、3級胚胎為優質胚胎。
(五)計算公式
1.受精率=正常受精卵數/卵-冠-丘復合體數×l00%。
2.優質胚胎率=優質胚胎數/正常受精卵數×l00%。
3.著床率= B超觀察到的妊娠囊數/移植胚胎數×100%。
4.臨床妊娠率=臨床妊娠例數/移植周期數×l00%。
5.生化妊娠率= 生化妊娠周期數/妊娠周期數。
6.流產率= 孕28周前流產周期數/臨床妊娠周期數。
7.早產率= ART受試者在妊娠滿28周至不滿37周期間分娩周期數/分娩周期數。
三、統計學處理
實驗數據采用SPSS 16.0統計軟件進行分析。計量資料用±s表示,比較采用單項方差分析;計數資料用率(比值)表示,比較應用卡方檢驗。P<0.05認為差異有統計學意義,P<0.01差異有顯著統計學意義。
結 果
收集在我院生殖醫學科就診的132例特發性少、弱精子癥患者列為實驗組。并將正常生育組50例男性納入對照組。
一、實驗組與對照組一般資料比較
比較實驗組與對照組患者:男、女方年齡、不孕年限、竇卵泡數、女方基礎 FSH、女方基礎 LH、hCG 日 E2、hCG 日子宮內膜厚度差異無統計學意義(P>0.05),見表1。
二、實驗組與對照組精液質量比較
實驗組與對照組相比,精液參數中,精液量差異無統計學意義(P>0.05)。精子濃度、正常形態率、精子前向運動率(PR,%)、對照組高于實驗組,差異有統計學意義,精子非前向運動率(NP, %)實驗組高于對照組,差異有統計學意義(P<0.05),見表2。
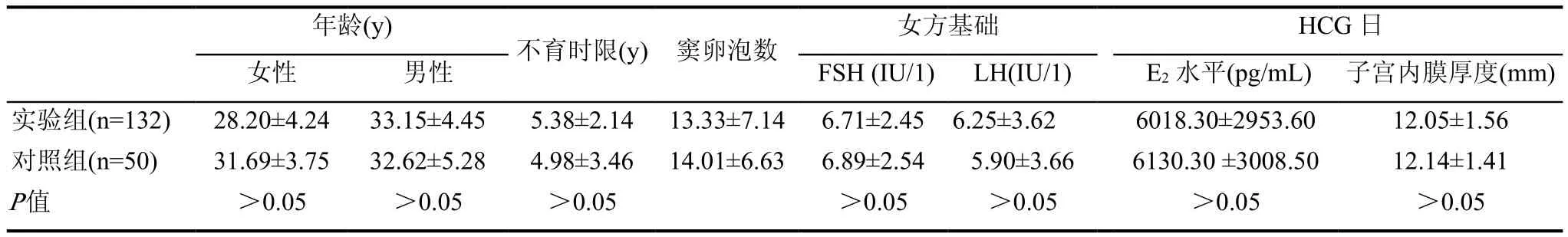
表1 實驗組與對照組一般資料比較
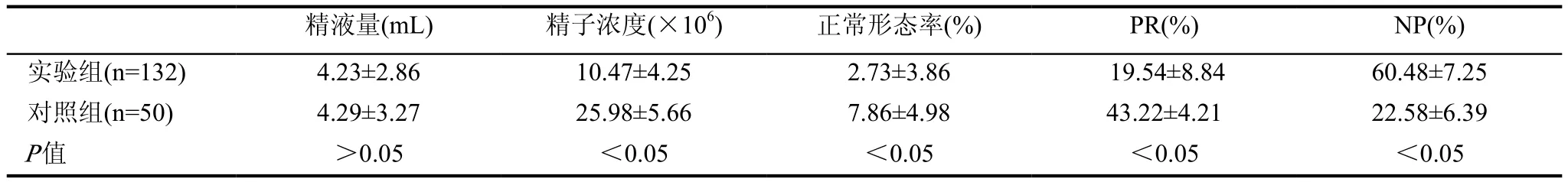
表2 實驗組與對照組患者基本情況比較
三、實驗組與對照組精子功能的比較
實驗組有10例精子濃度過低,由于無法繼續進行精子功能試驗,故將此10例患者剔除出去。其中對比兩組精子功能指標,實驗組的頂體酶活性、精子-透明質酸結合率小于對照組,實驗者組DNA碎片、核蛋白組型大于對照組,差異具有統計學意義(P<0.05),見表3。
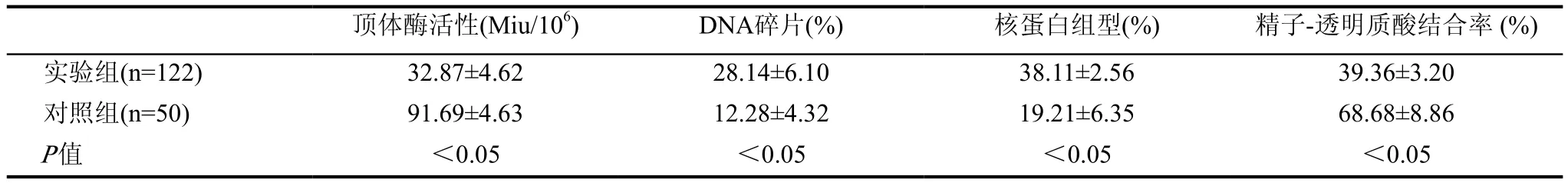
表3 實驗組與對照組患者精子功能比較
四、實驗組與對照組體外受精-胚胎移植(IVFET)和胞漿內單精子注射-胚胎移植(ICSI-ET)妊娠結局的比較
IVF治療者,實驗組受精率、卵裂率、優質胚胎率、著床率、生化妊娠率、臨床妊娠率小于對照組,差異有統計學意義(P<0.05),見表4。ICSI治療者,實驗組受精率、卵裂率、優質胚胎率、著床率、生化妊娠率、臨床妊娠率與對照組相比,差異無統計學意義(P>0.05),見表5。
六、實驗組與對照組對子代影響
實驗組與對照組相比,兩者的早產率、后代出生體質量、雙胎妊娠率、男嬰比例、出生缺陷率兩兩比較后顯示無統計學差異(P>0.05),見表6。

表4 實驗組與對照組IVF-ET妊娠結局的比較

表5 實驗組與對照組ICSI-ET妊娠結局的比較
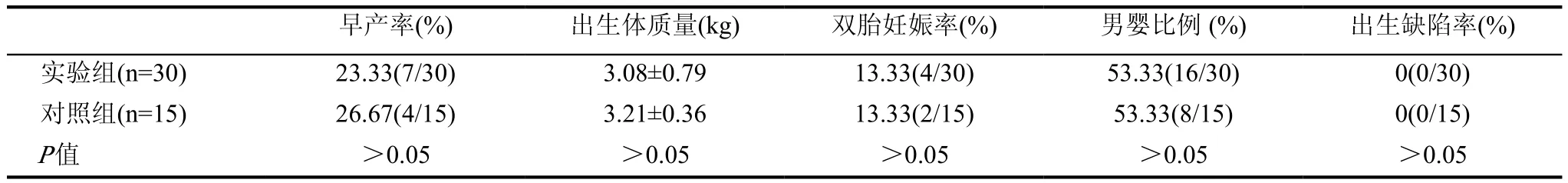
表6 實驗組與對照組對子代影響的比較
討 論
當前,特發性男性不育癥會影響其發生發育的遺傳物質紊亂成為目前及將來人們關注的焦點,目前特發性少弱畸精子癥對精子質量精子功能以及輔助生殖結局的影響研究很少。為了更好地衡量男性生育能力和預測生殖結局,臨床需要準確地測定精子功能。本研究顯示:與正常人相比,特發性不育者的精子濃度、總活力以及正常形態率明顯減少。但是精液量并無顯著性差異,然而對比特發性少、弱精子癥患者與正常生育組兩組精子功能指標時發現:特發性少、弱精子癥患者組的頂體酶活性、精子-透明質酸結合率小于正常生育組,特發性少、弱精子癥患者組DNA碎片、核蛋白組型大于正常生育組,差異具有統計學意義,這與Muratori等[3,4]研究相似,并且Aktan等[5]研究也發現特發性少、弱精子癥患者精子DNA損傷與其高水平的ROS有關,高水平的ROS容易導致特發性少、弱精子癥男性精子核蛋白賴氨酸-精氨酸轉換障礙,從而導致精子DNA 的易損性增大,或者是高水平的ROS可以直接攻擊精子DNA,引起精子DNA片段斷裂,從而導致精子DNA碎片率增高,精子卵子結合障礙,最終導致精子功能降低。因此提示:特發性少、弱精子癥患者除了精液質量異常之外有可能合并精子功能異常,因此針對特發性少、弱精子癥患者在常規精液分析的基礎上進行精子功能相關指標檢測,可以揭示一部分特發性少、弱精子癥患者的病因,并因此可以采取針對性的治療,或者為下一步采取輔助生殖方式的選擇以及治療結局提供參考。
隨著IVF-ET以及ICSI在男性不育患者中的應用,對于一些特發性少、弱精子癥男性患者可以通過此類措施而獲得生育。但是這類技術的應用繞過了自然受精過程中對精子的自然選擇過程,從而對輔助生殖妊娠結局以及對出生后代是否會產生不良的影響,關于這方面的問題目前仍不明朗。
為了更準確反映特發性少、弱精子癥患者對IVF/ICSI-ET結局的影響,我們將研究對象分為IVF診療組以及ICSI治療組,來分析特發性少、弱精子癥患者對IVF/ICSI-ET結局的影響。本研究中,在實行IVF診療組當中特發性少、弱精子癥患者的受精率、卵裂率、優質胚胎率和臨床妊娠率低于正常男性患者,流產率高于對照組。而在實行ICSI治療組,特發性少、弱精子癥患者的受精率、卵裂率、著床率、優質胚胎率、臨床妊娠率和流產率與正常患者相比,無明顯差異,這與Setti等的研究[6]相似。有研究[7]分析,認為精子DNA碎片的增加對輔助生殖結局會產生不良影響,它可能會導致精卵結合障礙從而引起受精率降低,胚胎卵裂率以及胚胎質量下降,最終會導致妊娠率降低以及流產率升高。應用ICSI治療的同時結合糾正不良生活習慣(諸如吸煙、酗酒、服用生殖毒性藥物等),服用抗氧化藥物(如維生素C、維生素E、輔酶Q10等藥物[9]),則可以減少精子DNA異常精子的注射,可能因此會改善輔助生殖技術臨床結局[9]。我們的研究也發現,特發性少、弱精子癥患者組與正常生育組相比,兩者的早產率、后代出生體質量、雙胎妊娠率、男嬰比例、出生缺陷率兩兩比較后顯示無統計學差異。而Fernández-Gonzalez等[10]通過動物研究發現雄性精子DNA碎片化增加可以引起早產率增加以及后代癌癥以及先天性畸形的風險增加,這可能是研究的對象不同,或者所采用的研究方法不同所致,這需要今后更大樣本、更系統的采用回顧性研究,以期為臨床上對此類患者進行生育力評估、治療手段的選擇、胚胎植入前遺傳學診斷的選擇和妊娠結局的預測以及優生優育工作等提供依據。
綜上所述,在男性不育診療過程中,對特發性少、弱精子癥患者進行精子功能檢查有其必要性,充分評估其生育能力,這將有助于其選擇更加合理的生育方式。對于 IVF 治療結局不良的特發性少、弱精子癥患者, 實行ICSI 受精可能會改善其助孕治療結局。然而特發性男性不育往往涉及多個因素,因此對其研究依然任重道遠。
參考文獻
1 J arow JP, Sharlip ID, Belker AM,et al.Best practice policies for male infertility.J Urol2002; 167(5): 2138-2144
2 Dohle GR, Diemer T, Giwercman A,et al.Guidelines on male infertility[R/OL].European Association of Urology2010; 171(2): 246-250
3 Muratori M, Marchiani S, Maggi M,et al.Origin and biological significance of DNA fragmentation in human spermatozoa.Front Biosci2006; 11(3): 1491-1499
4 Laberge RM, Boissonneault G.On the nature and origin of DNA strand breaks in elongating spermatids.Biol Reprod2005; 73(2): 289-296
5 Aktan G, Do?ru-Abbaso?lu S, Kü?ükgergin C,et al.Mystery of idiopathic male infertility; is oxidative stress an actual risk?.Fertil Steril2013; 99(5): 1211-1215
6 Setti AS, Figueira RC, Braga DP,et al.Intracytoplasmic morphologically selected sperm injection is beneficial in cases of advanced maternal age: a prospective randomized study.Eur J Obstet Gyneclo Reprod Biol2013; 171(2):286-290
7 Simon L, Murphy K, Shamsi MB,et al.Paternal influence of sperm DNA integrity on early embryonic development.Hum Reprod2014; 29(11) : 2402-2412
8 Ni W, Xiao S, Qiu X,et al.Effect of sperm DNA fragmentation on clinical outcome of frozen-thawed embryo transfer and on blastocystformation.PLoS One2014; 9(4): e94956
9 商學軍, 陳亮, 夏欣一, 等.男性生殖遺傳學檢查專家共識.中華男科學雜志 2015; 21(12): 1138-1142
10 Fernández-Gonzalez R, Moreira PN, Pérez-Crespo M,et al.Longterm effects of mouse intracytoplasmic sperm injection with DNAfragmented sperm on health and behavior of adult offspring.Biol Reprod2008; 78(4):761-772

