FOLFIRI聯合EGFR單抗治療不同部位Kras基因野生型結直腸癌肝轉移的效果研究
范曉翔,謝陽陽,沈偉男,戴曉宇
結直腸癌(CRC)臨床常見的惡性腫瘤之一,全世界發病率位居腫瘤的第3位,病死率第5位[1]。結直腸癌肝轉移(CRLM)出現概率高達30%~50%,也是CRC患者最主要的死亡原因[2]。研究顯示,存在一些最初的肝轉移灶不能手術或局部治療的病患,在通過醫治之后能夠轉變成可手術或消融,這是CRLM獲得潛在治愈的唯一機會,療效接近III期患者[3]。研究顯示,FOLFIRI化療方案都具有較高的轉化切除率,能夠延長中位無進展生存期(PFS),但總生存期(OS)提高不明顯[4],且化療藥品不良反應依然是大部分病患較難持續醫治的因素。
伴隨著靶向藥物研究進展,以表皮生長因子受體(EGFR)為代表的靶向藥物對于晚期結直腸癌(mCRC)的治療獲得了一定成果。2013年的歐洲腫瘤大會上,發現Kras基因野生型的CRLM患者加用西妥昔單抗組的R0切除率顯著提高[5]。研究發現[6],原發腫瘤位置是mCRC患者不良預后的獨立危險因素,不同藥物聯合治療不同位置存在差異。本研究擬探討EGFR單抗聯合化療治療原發灶不同部位的 Kras基因野生型的CRLM的療效,報道如下。
1 資料與方法
1.1 一般資料 收集 2014年7月至2017年6月寧波市第二醫院收治的Kras野生型CRLM患者38例,納入標準:(1)年齡18~75歲,性別不限;(2)腸鏡活檢或者外科手術切除原發病灶,經組織學證實為CRC且伴有影像學診斷肝轉移;(3)肝轉移灶未經治療或既往末次治療結束1年以上的患者,其中既往治療包括化療、手術、射頻、放療、肝動脈栓塞化療(TACE)和靶向治療;(4)實驗室檢測滿足以下需求:血液學功效正常(血小板> 100×109/L,白細胞> 4×109/L,中性粒細胞>2.0×109/L);血清膽紅素<2.5倍正常值上限(ULN),轉氨酶<2.5倍ULN;(5)ECOG 評分 0 或 1;(6)預期壽命>6個月;(7)簽署書面知情同意書;(8)愿意且能夠接受隨訪直至死亡或研究終止;(9)5年之內以及同期不存在其余惡性病癥,不存在導致不能實行知情同意的精神病癥,不存在伴發其余可能促使存活期減小的嚴重病癥。排除標準:(1)存在除肝外轉移病灶者;(2)肝臟病例初始評價為可切除患者;(3)嚴重的無法控制的全身合并癥如感染或糖尿病;(4)對研究中的任何藥物過敏;(5)孕期及哺乳期婦女;(6)存在任何其他疾病、轉移性病灶所致功能障礙、或體檢發現可疑疾患,提示可能存在使用研究藥物的禁忌證或使患者處于治療相關并發癥高風險人群。終止研究標準:(1)腫瘤進展;(2)患者撤回知情同意;(3)患者未遵守方案;(4)研究者判定存在某種如果繼續研究可能會危害患者安全的醫學事件;(5)研究者認為提前退出研究可使患者最大獲益;(6)研究藥物出現明顯毒副反應,經減量后仍未緩解。
1.2 分組 原發腫瘤部位分為右半結腸癌組(A組)與左半結腸癌組(B組),以結腸脾曲為分界標志,A組包括盲腸、升結腸以及近端2/3的橫結腸;B組包括遠端1/3的橫結腸、降結腸、乙狀結腸以及直腸。最終A組10例,B組28例患者完成入組。
1.3 方法 兩組均采用 EGFR單抗聯合FOLFIRI化療治療。EFGR單抗選用西妥昔單抗,首次劑量為400 mg/m2,滴注時間為120 min,之后每周250 mg/m2或每2周500mg/m2,滴注時間為60min。治療前預防性抗過敏處理。
化療方案采用FOLFIRI方案治療:伊立替康180mg/m2溶解于0.9%氯化鈉注射液250 ml中靜脈滴注90 min,第1天;四氫葉酸鈣400 mg/m2,靜脈滴注(2 h),第1天;氟尿嘧啶 0.4g/m2;氟尿嘧啶 2.4g/m2,維持靜脈灌注和通過化療泵灌注4~6h。每2周為一個循環。2周作為1個周期,共12個周期。
1.4 療效評價標準及方法 根據 RECIST1.1標準將療效分為完全緩解(CR)、部分緩解(PR)、病情穩定(SD)、病情進展(PD),評估總體有效率(ORR)=(PR+CR)/入組總例數×100%;OS,開始入組至隨訪結束或患者死亡時間;PFS,開始入組至病情進展或死亡時間;毒副反應。
每4周期使用CT或MRI檢查根據RECIST 1.1標準對腫瘤進行評估,測量最大腫瘤體積。肝內最大轉移瘤體積退縮>20%為PR+CR;-20%~20%為SD,>20%為PR。每4周期舉行一次MDT會議并根據給定標準決定轉移灶的可切除性。如果肝臟病灶轉變為可切除,將于化療后2周內手術。接受手術的患者將于術后2周開始輔助化療。兩組術前和術后治療的總周期數為12周期。一旦評估發現肝轉移灶接近完全緩解,患者將停止化療直接準備手術治療或者射頻治療,以避免給治療帶來不利影響。對于肝臟病灶可切除的患者,手術延遲超過定義的手術窗口期(延遲超過2周)時需要術前再次接受腫瘤評估。
1.5 隨訪方案 根據研究方案,接受了術前、術后完整的12周期化療的患者,或在因疾病進展或不可耐受的不良反應而中止化療的患者將進入隨訪期,隨訪期將持續至最后一名入組患者完成研究治療后半年。接受術后治療的患者將每4周接受一次隨訪評估直至術后治療結束,之后第1年每3個月接受一次隨訪評估,第2年開始每6個月接受一次評估直至研究終止或死亡。隨訪方式:門診復診、電話、信件等。隨訪內容:血常規、肝腎功能、血清癌胚抗原(CEA)、胸部CT、腹部CT/MRI及腸鏡等,對部分患者可行PET/CT檢查以及時發現腫瘤的復發轉移。
1.6 統計方法 數據采用 SPSS17.0統計軟件分析,率的比較采用2檢驗;采用Kaplan-Meier生存分析及Log-rank檢驗分析生存率差異。P<0.05為差異有統計學意義。
2 結果
2.1 一般情況 A組男4例,女6例;年齡32~75歲,平均(52±5.8)歲;病理分型為高分化腺癌4例,中分化腺癌4例,低分化腺癌1例,黏液腺癌1例。B組男18例,女10例;年齡28~74歲,平均(48±6.3)歲;病理分型為高分化腺癌7例,中分化腺癌16例,低分化腺癌3例,黏液腺癌1例,管狀腺癌1例。兩組一般情況差異無統計學意義(P>0.05),有可比性。
2.2 ORR比較 經治療,A組PR3例,SD 2例,PD 6例;B組PR 17例,SD 4例,PD7例。A組ORR為 30.0%(3/10),B組為60.7%(17/28),差異有統計學意義(X2=3.78,P<0.05)。共8例PR患者的肝轉移瘤轉化成功,達到了可切除標準,行手術或局部射頻消融治療,其中R0切除(消融)6例,R1切除(消融)2例。
2.3 生存期變化 兩組均完成治療及隨訪,A組OS為19.9個月,B組為37.7個月,差異具有統計學意義(P=0.03)。A組PFS為9.6個月,B組為16.0個月,差異無統計學意義(P=0.1)。見封四彩圖1~2。

圖1 兩組OS生存曲線比較
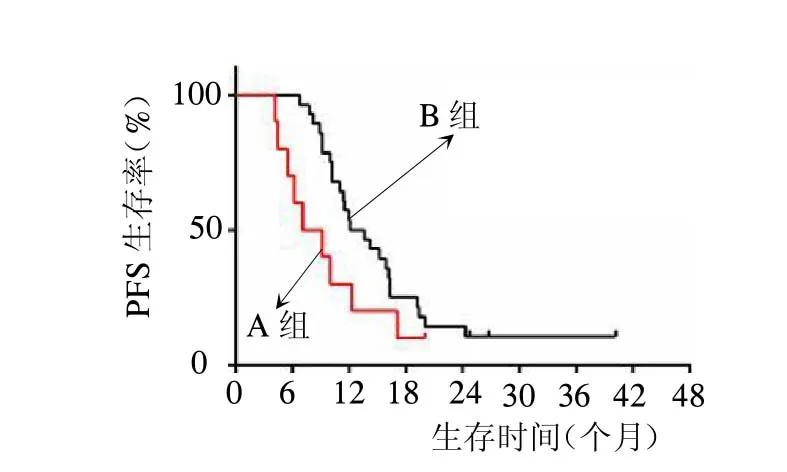
圖2 兩組PFS生存曲線比較
2.4 毒副反應 兩組毒副反應大部分為0~II級,對癥治療后均可耐受,未影響后續治療。
3 討論
CRC傳統治療模式是以手術治療為主,化療、放療及其他綜合治療為輔,但對于發生肝轉移的患者總體療效仍無法讓人滿意。隨著靶向治療研究的進展,EGFR單抗自2004年起應用于CRC的治療,由三線治療逐步向一線治療轉變,取得了良好的療效[7],其毒副反應較單純化療并無明顯差異,少有Ⅲ~Ⅳ級的嚴重不良反應發生[8],本研究也證實了這一觀點。
David等對伊立替康治療失敗的329例CRC患者隨機分為西妥昔單抗+伊立替康聯合用藥組與西妥昔單抗單藥組,聯合組較單藥組有更高的ORR,但PFS差異無統計學意義(P>0.05);考慮EGFR單抗在FOLFIRI治療過程中,西妥昔單抗似乎可以逆轉伊立替康的耐藥,兩者聯合可以發揮更有效的抗腫瘤作用[9]。但將其OS與Giachetti課題組[10]單純應用FOLFOX方案的Ⅲ期臨床試驗對比,發現EGFR的靶向藥物雖有獲益但僅延長了不到1個月的OS(9.2個月 vs 8.7個月),究其原因,可能是因為研究未對CRC患者Kras基因的狀態進行區別分組。Kras基因作為RAS基因家族中的一員,在EGFR及其下游RASRAF-MAPK信號通路的中起重要作用。Karapetis課題組的研究顯示[11],Kras基因的突變能夠讓下游訊息傳輸導路不按照EGFR的活化從而反常激活,導致細胞發育、繁殖以及死亡反常,由此讓EGFR遏制劑的醫治失效。Van課題組通過對不同對Kras狀態的CRC患者應用西妥昔單抗聯合化療的治療發現[12],Kras基因野生型的患者的ORR與PFS均顯著高于突變者。國內外多項的研究成果也證明,對于Kras基因第12、13號密碼子突變的患者,應用對EGFR單抗治療效果有限[13]。2017年NCCN終于將 Kras的狀態作為應用西妥昔單抗的重要耐藥預測指標寫入指南。
有研究顯示,原發病灶的切除位置不但同治療效果相關,也同樣和預后相關,原發于右半結腸者預后差于左半結腸者[14]。CALGB/SWOG80405 III期臨床研究數據,納入了293例右半結腸癌患者、732例左半結腸癌患者,Kras基因均為野生型,研究結果顯示,西妥昔單抗聯合FOLFIRI治療的ORR達60%;而且源于左半結腸癌之中,西妥昔單抗治療同貝伐珠單抗比對獲取了更久的生存獲益,然而源于右半結腸癌之中,貝伐珠單抗同西妥昔單抗對比展示了更長久的生存獲益。但是秦叔逵等的TAILOR研究選取了RAS野生型mCRC患者,應用西妥昔單抗+FOLFOX治療,與目前其他的研究結果相反,研究中并未發現原發瘤部位(左半對比右半)是西妥昔單抗的療效預測因素,西妥昔單抗聯合FOLFOX均能給左半和右半mCRC帶來生存獲益[15]。綜合目前的研究結果,左半結腸CRLM選擇西妥昔單抗聯合FOLFIRI治療能達到患者獲益,可以作為一線方案,但右半結腸CRLM患者,是否也可以應用西妥昔單抗聯合化療治療尚存在爭議。
從外科角度來看,對于CRLM的治療,手術切除是目前唯一公認的可以使患者獲得長期生存的機會,因此對于轉移臟器比較局限的患者,比如僅肝轉移、或者肝肺轉移的患者,我們更希望能快速縮小腫瘤,通過轉化治療,最大化腫瘤退縮幅度來爭取手術R0切除的機會。雖然左半結腸癌患者較右半結腸癌患者應用西妥昔單抗獲益更多,但西妥昔單抗聯合FOLFIRI無論在左右半結直腸癌肝轉移患者中都是有一定優勢的,對于以腫瘤縮小為目標的右半RAS野生型結腸癌肝轉移患者的轉化治療,依然值得選擇。
綜上所述,FOLFIRI聯合EGFR單抗對于不同部位Kras野生型CRLM患者均安全有效,可以達到的治療獲益。左半結腸CRLM患者顯著優于右半,可以作為一線治療方案。右半結腸 Kras野生型 CRLM 患者以腫瘤縮小為目標的轉化治療也可以選擇。
參考文獻:
[1]Xu J,Qin X,Wang J,et al.Chinese guidelines for the diagnosis and comprehensive treatment of hepatic metastasis of colorectal cancer[J].Cancer Res Clin Oncol,2011,137(9):1379-1396.
[2]Sharma S,Camci C,Jabsbour N.Management of hepatic metastasis from colorectal cancers:an update[J].Hepatobiliary Pancreat Surg,2008,15(6):570-580.
[3]Tsalis K,Vasiliadis K,Christoforidis E,et al.Current treatment of colorectal liver metastases[J].Tech Coloproctol,2004,8(Suppl 1):174-176.
[4]中華醫學會外科學分會胃腸外科學組,中華醫學會外科學分會結直腸肛門外科學組,中國抗癌協會大腸癌專業委員會,等.結直腸癌肝轉移診斷和綜合治療指南(V2010)[J].中華胃腸外科雜,2010,13(6):457-470.
[5]Price TJ,Beeke C,UllahS,et al.Does the primary site of colorectal cancer impact outcomes for patients with metastatic disease[J].Cancer,2015,121(6):830-835.
[6]Chua TC,Saxena A,Liauw W,et al.Systematicreview of radonmized and nonrandomized trials of the clinical response and outcomes of neoadjuvant systemic chemotherapy for resectable colorectal liver metastases[J].Ann Surg Oncol,2010,17(2):492-501.
[7]李智字,周志祥.結直腸癌靶向治療的應用及前景[J].實用腫瘤雜志,2013,28(1):10-14.
[8]Karapetis CS,Khambata-Ford S,Jonker DJ,et al.K-ras mutations and benefit from cetuximab in advanced colorectal cancer[J].N Engl J Med,2008,359(17):1757-1765.
[9]許劍民,任黎.結直腸癌肝轉移診斷和綜合治療指南(V2013)[J].中國實用外科雜志,2013,33(8):635-644.
[10]李凡,韓琤波,馬潔韜.結直腸癌原發灶和轉移灶KRAS基因狀態比較的Meta分析[J].中華臨床醫師雜志,2011,5(13):3834-3838.
[11]Memon MA,Beckingham IJ.Surgical resection of colorectal liver metastases[J].Colorectal Dis,2001,3(6):361-373.
[12]Nordlinger B,Sorbye H,Glimelius B,et al.Perioperative chemotherapy with FOLFOX4 and surgery alone for respectable liver metastases from colotectal cancer:a randomized controlled trial[J].Lancent,2008,371(9617):1007-1016.
[13]Adam R,Bhangui P,Poston G,et al.Is perioperative chemotherapy useful for solitary,metachronous,colorectal liver metastases[J].Ann Surg,2010,252(5):774-787.
[14]劉學偉.KRAS基因遺傳變異對結直腸癌患者預后評估的價值[J].中國老年學雜志,2014,23:6608-6610,6611.
[15]Lee GH,Malietzis G,Askari A,et al.Is right-sided colon cancer different to leftsided colorectal cancer.A systematic review[J].Eur J Surg Oncol,2015,41(3):300-308.

