心肌分層應變評估重度主動脈瓣狹窄患者左室心肌收縮功能變化
林潔,嚴志漢
(1.溫州醫科大學附屬黃巖醫院 超聲科,浙江 臺州 318020;2.溫州醫科大學附屬第二醫院育英兒童醫院 放射影像科,浙江 溫州 325027)
主動脈瓣狹窄(aortic stenosis,AS)是非常常見的心臟瓣膜疾病,其特征是瓣膜狹窄進行性加重和心肌的繼發性改變[1],在疾病早期,肥厚的心肌細胞仍發揮著代償作用,隨著疾病的進展,心肌逐漸失去代償能力引起一系列的血流動力學改變,進而出現臨床癥狀、心力衰竭及各種心血管不良事件[2]。AS患者一旦出現心衰癥狀,其預后往往不佳[3],所以對重度AS患者,早期發現其心功能改變為心外科醫師提供臨床決策依據具有非常重要的意義。本研究采用最新發展的心肌分層應變(layerspecific strain,LSS)來定量研究左室射血分數(left ventricular ejection fraction,LVEF)正常的重度AS患者左室壁多層心肌收縮功能變化。
1 對象和方法
1.1 對象 選取2012年1月至2017年9月在溫州醫科大學附屬黃巖醫院經超聲心動圖和臨床確診的重度AS患者57例,其中左室壁增厚組36例,年齡48~80歲,平均(63.1±8.5)歲,男21例,女15例,左室壁不厚組21例,年齡41~80歲,平均(63.60±8.75)歲,男11例,女10例。所有患者LVEF≥55%,心電圖均為竇性心律。重度AS參考2017年歐洲心臟病協會和歐洲胸心外科協會心臟瓣膜病管理指南[4]的診斷標準。左室壁肥厚標準[5]:舒張期室間隔厚度(diastolic inter-ventricular septum dimension,IVSd)>11 mm,舒張期左室后壁厚度(diastolic left ventricular posterior wall thickness,LVPWd)>11 mm。排除標準:二尖瓣疾病、主動脈瓣中度以上的關閉不全、心律失常(心房顫動、左束支傳到阻滯、右束支傳到阻滯)、惡性或者進行性高血壓、慢性腎病、有冠狀動脈旁路移植或者冠狀動脈支架植入病史,所有患者均經冠狀動脈造影排除中度、重度冠狀動脈狹窄。同時選取年齡、性別和AS相匹配的健康志愿者30例作為對照組,年齡40~75歲,平均(59.8±8.2)歲,其中男17例,女13例,均為竇性心律,無心血管病史,無慢性肺部疾病史,排除其他各種器質性疾病。本研究經本院倫理委員會審核批準。
1.2 主要儀器和檢測方法 采用美國GE公司生產的Vivid E9超聲診斷儀,M3S探頭,頻率1.7~3.4 MHz,幀頻>60幀/s。囑受檢者左側臥位,連接同步心電圖,采集心尖四腔心、心尖二腔心、心尖左室長軸切面、二尖瓣口水平短軸切面、乳頭肌水平短軸切面及心尖水平短軸切面各連續3個心動周期的動態圖像,并采集主動脈口及二尖瓣口血流頻譜(E峰和A峰)、組織多普勒二尖瓣環(室間隔側)運動速度頻譜(e峰和a峰),將上述圖像導入移動硬盤以供脫機分析。
1.3 圖像處理與數據分析 采用EchoPAC軟件對圖像進行脫機分析。LSS參數測量:進入EchoPAC軟件工作站,調出動態圖像,在收縮末期沿著心內膜緣手動勾畫左室輪廓,再調整感興趣區寬度,使整個左室心肌剛好全部落在感興趣區域內,軟件會自動給出各切面心肌的應變曲線或牛眼圖,同時給出各切面或整體(global)的內膜(endocardial,Endo)、中層(mid wall,Mid)、外膜(epicardial,Epi)的縱向峰值應變(longitudinal peak strain,LS)和Endo、Mid、Epi的圓周峰值應變(circuferential peak strain,CS),見圖1。
1.4 重復性分析 隨機抽取20例病例,2周后分別由2名有經驗的超聲醫師進行圖像分析,評估觀察者內和觀察者間的重復性。
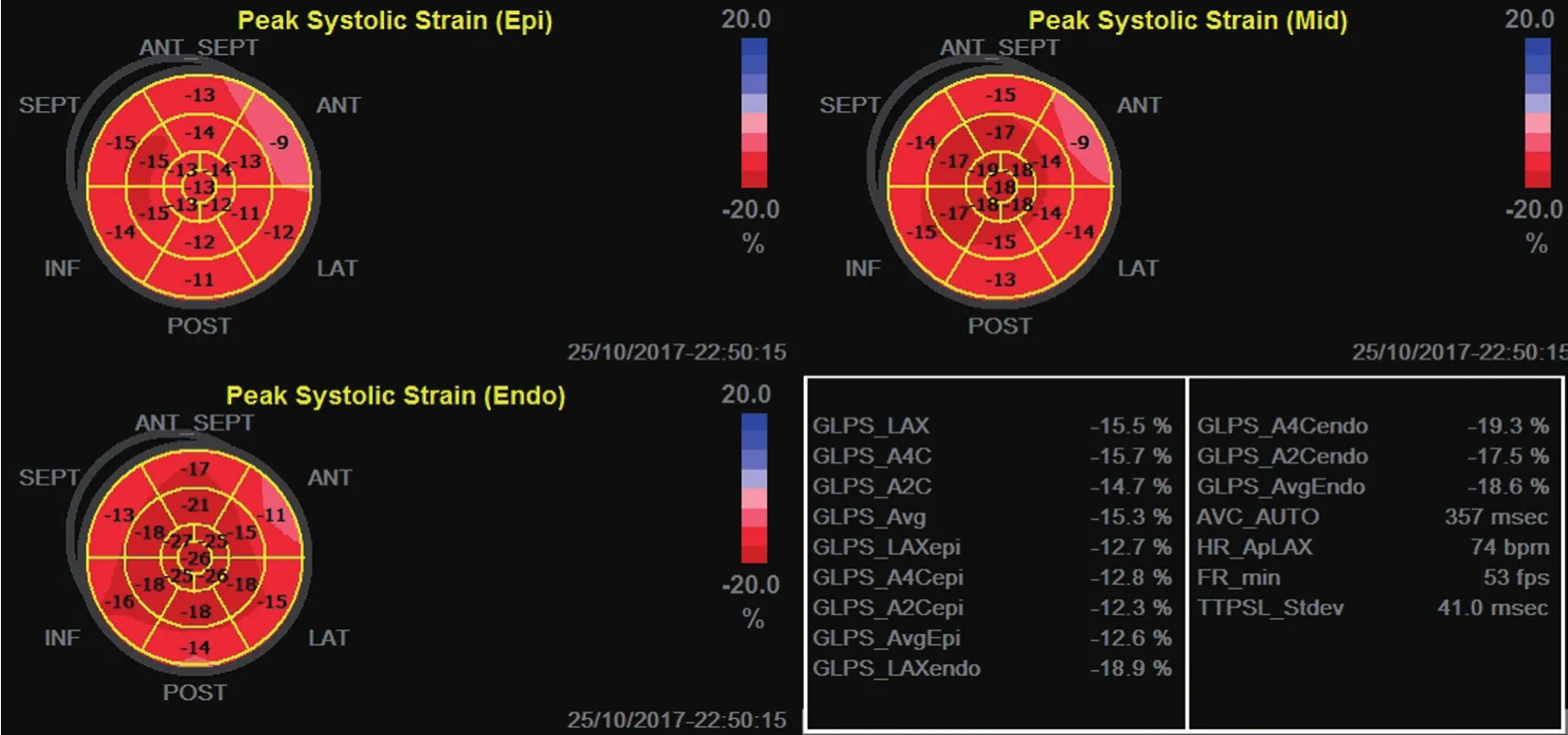
圖1 左室Endo-LS、Mid-LS、Epi-LS牛眼圖顯示各切面具體的Endo-LS、Mid-LS、Epi-LS
1.5 統計學處理方法 使用SPSS17.0及MedCalc統計軟件進行統計分析。計量資料以±s表示,多組間計量資料采用單因素方差分析,組間兩兩比較采用采用LSD-t檢驗;重復性檢驗采用Bland-Altman分析。P<0.05為差異有統計學意義。
2 結果
2.1 常規二維超聲心動圖比較 和對照組比,AS左室壁不厚組IVSd、LVPWd、E/e明顯增加,差異有統計學意義(P<0.05);和對照組及AS左室壁不厚組比較,AS左室壁增厚組IVSd、LVPWd、左心房內徑(left atrial diameter,LAD)及E/e均明顯增加,差異有統計學意義(P<0.05);3組間左室舒張末期內徑(left ventricular end diastolic diameter,LVEDD)、左室收縮末期內徑(left ventricular end systolic diameter,LVESD)、左室舒張末期容積指數(left ventricular end diastolic volume index,LVEDVI)、左室收縮末期容積指數(left ventricular end diastolic volume index,LVESVI)、LVEF、E/A及e/a差異均無統計學意義(P>0.05),見表1。
表1 二維超聲心動圖常規參數比較(±s)
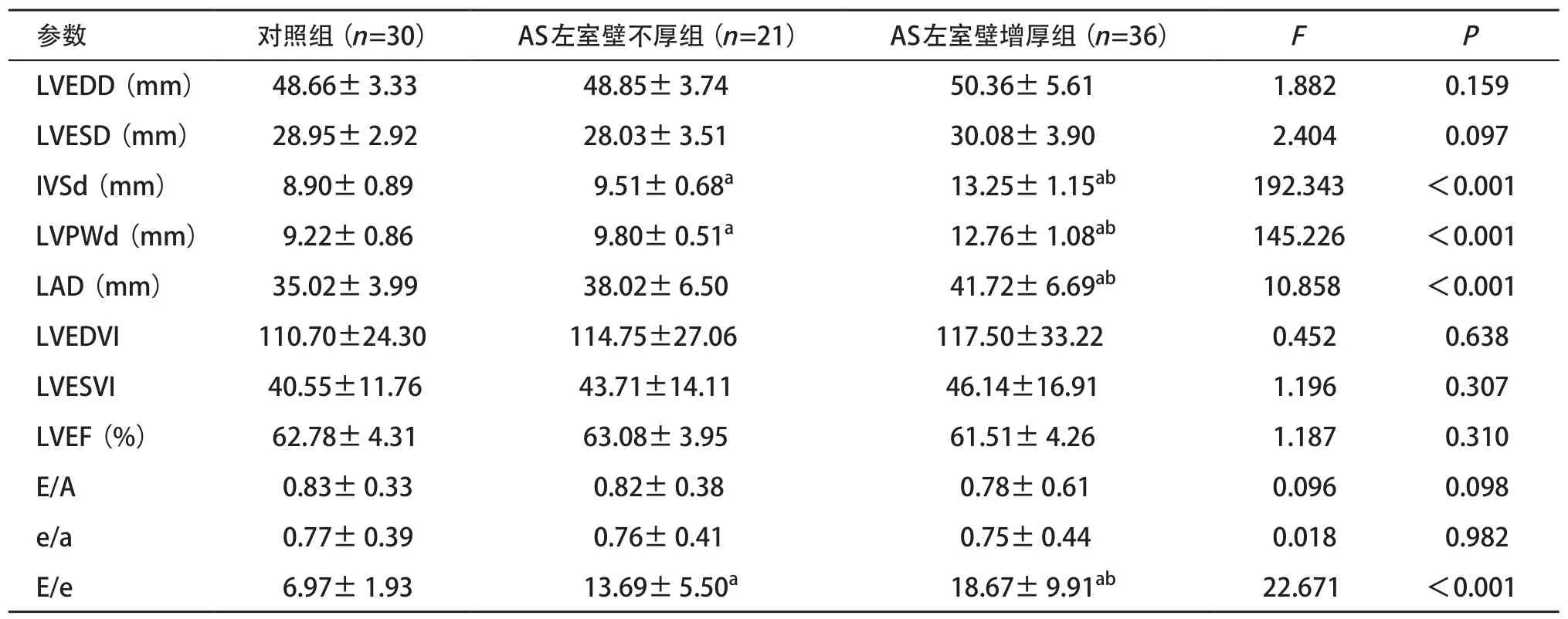
表1 二維超聲心動圖常規參數比較(±s)
與對照組比:aP<0.05;與AS左室壁不厚組比:bP<0.05
?
2.2 應變參數比較 和對照組比,AS左室壁不厚組和AS左室壁增厚組Endo-GLS、Mid-GLS、Epi-GLS均明顯降低,差異有統計學意義(P<0.05)。和AS左室壁不厚組比,AS左室壁增厚組Endo-GLS、Mid-GLS、Epi-GLS均明顯降低,差異有統計學意義(P<0.05)。3組間Endo-GCS、Mid-GCS、Epi-GCS差異無統計學意義(P>0.05)。左心室室壁三層的應變符合如下規律:Endo-GLS>Mid-GLS>Epi-GLS,Endo-GCS>Mid-GCS>Epi-GCS。見圖2。
2.3 重復性檢驗 左室應變參數觀察者內和觀察者間差異的均值在-1.0%~1.0%之間,95%CI在-5.0%~5.0%之間,見圖3。因此,心肌LSS所測的各應變參數具有較高的重復性。
3 討論
重度AS的病理生理改變是主動脈瓣開放受限,引起左室后負荷增加及左室肥厚,目前治療的有效手段就是通過手術或者介入行主動脈瓣置換,AS患者的預后與術前心功能狀態密切相關[6-7],因此,早期發現AS患者左心功能改變對臨床醫師作出決策具有非常重要的意義。
傳統的超聲心動圖評估左室收縮功能主要是測量LVEF和短軸縮短率,不能充分反映左室壁這種復雜的收縮活動機制以及心內膜與心外膜之間的關系,近些年發展起來的斑點追蹤技術可以充分評估左室心肌斑點的運動軌跡,更早地發現各種疾病狀態下左室收縮功能的改變[8]。
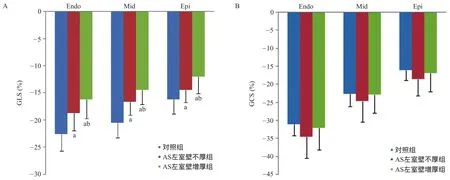
圖2 對照組、AS左室壁不厚組和AS左室壁增厚組患者左室GLS和GCS比較
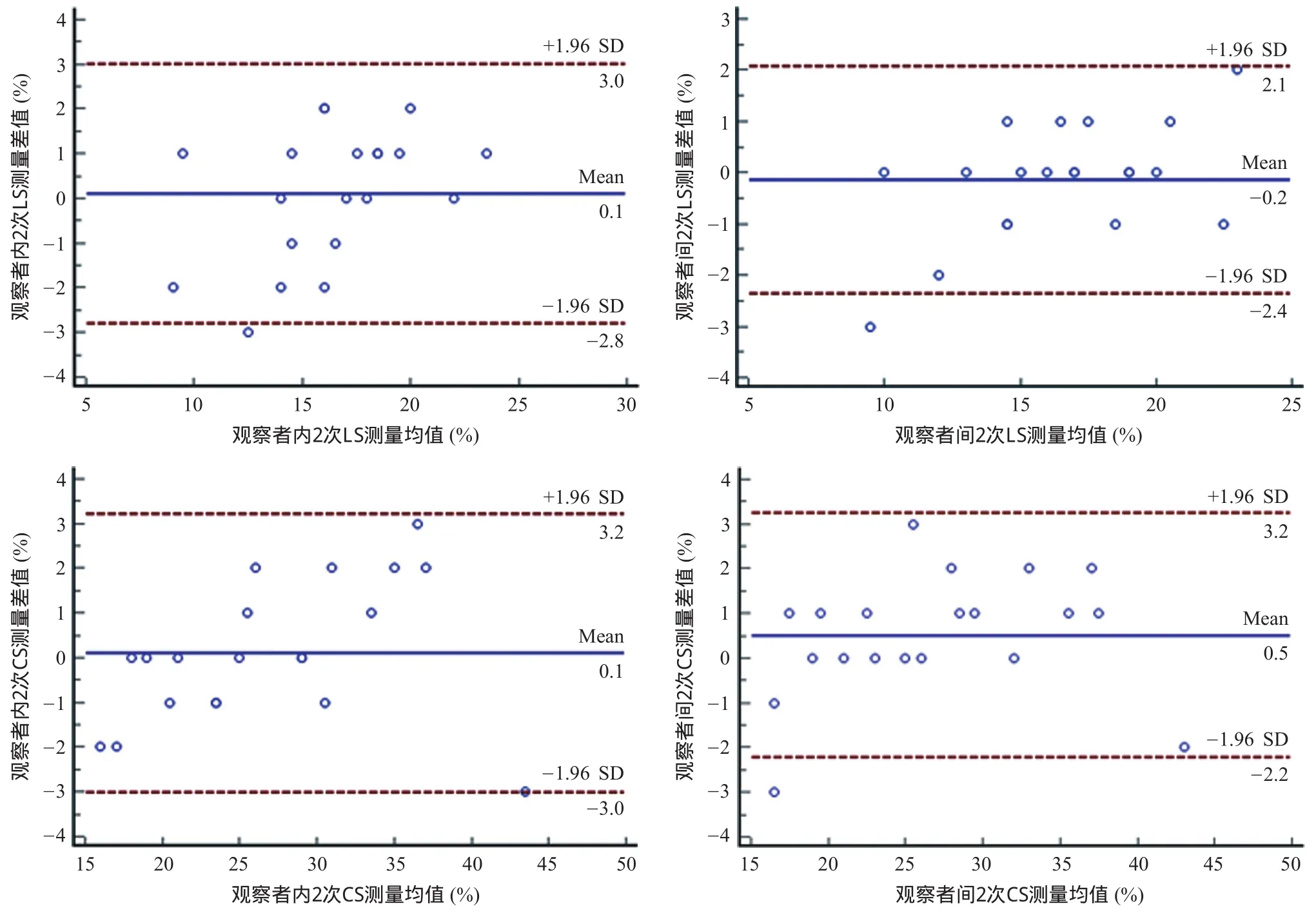
圖3 LS和CS重復性檢驗的Bland-Altman分析圖
研究顯示斑點追蹤技術可以定量評估AS患者左心功能改變[9-15],但都是以心室壁的整體平均應變作為研究對象,實際上心室壁的心肌由三層不同結構和走向的心肌纖維組成,左室功能是由這三層心肌纖維的收縮和舒張共同作用決定的[16]。左室心肌纖維分布無論從心內膜到心外膜還是從基底部到心尖部都是不均勻的,史靜等[17]對正常人左室心肌進行LSS分析,發現LS和CS值均從心內膜向心外膜依次減低,從基底部向心尖部依次增高,這種不均勻分布的心肌纖維共同作用使左室協同收縮。本研究發現對照組與AS左室壁增厚組和不厚組均符合這種規律。本研究顯示,隨著AS左室厚度增加,左室Endo-GLS、Mid-GLS、Epi-GLS逐漸減低,合理的解釋是:AS患者通過主動脈瓣口的血流明顯減少,使供應冠狀動脈的血流量減少,同時由于左室壁心肌肥厚,使左室壁毛細血管分布密度減少,而心內膜下心肌是毛細血管分布最豐富的區域,上述原因導致心內膜下心肌缺血,而心內膜下主要是縱向纖維,因此,在AS中首先出現GLS的降低。有研究顯示,AS左室肥厚所引起的心肌收縮功能損害是從心內膜開始,然后逐漸擴展到心外膜[18]。心肌多層GLS的減低可能預示左室收縮功能開始出現減退,因此測量AS患者左室心肌各層的GLS對早期評估AS患者心功能損害具有十分重要的臨床意義[19]。隨著AS狹窄進行性加重和左室后負荷的進一步增加,左室壁心肌向心性重構,必然會導致Endo-GLS、Mid-GLS、Epi-GLS進一步減低,甚至可能是其他方向心肌應變的減低[11]。本研究對GCS研究顯示,對照組、AS左室壁不厚組和AS左室壁增厚組中,Endo-GCS、Mid-GCS、Epi-GCS值均無明顯差異。心肌各層GCS改變不明顯,而GLS減低,可能是GCS在AS患者中為維持正常的LVEF發揮代償作用。ARONSON等[20]認為AS患者早期GCS是增高的,以作為GLS減低的補償機制,從而維持正常LVEF,本研究AS左室壁無增厚組心肌各層GCS有增高趨勢,但無顯著增高,可能與入選的AS標準不同有關。也有研究[12]認為在AS患者中GLS減低,而LVEF維持正常,與左室扭轉運動增強有關。隨著室壁進一步增厚,GCS開始減低。GCS的明顯減少預示左室心肌更廣泛的損害,導致LVEF下降,預后更差[6-7]。
本研究也存在一定局限性:樣本量較小;LSS對圖像質量要求較高,需要有較高的幀頻和圖像清晰度。
總之,在AS患者中,隨著左室壁逐漸增厚,LSS可在早期發現左室收縮功能的改變,因此LSS可以提供傳統的超聲心動圖所不能提供的敏感參數用于定量評估AS患者左室收縮功能情況,為醫師做出重要的臨床決策提供幫助。
參考文獻:
[1] DWECK M R, BOON N A, NEWBY D E. Calcific aortic stenos is: a disease of the valve and the myocardium[J]. J Am Coll Cardiol, 2012, 60(19): 1854-1863.
[2] CARASSO S, MUTLAK D, LESSICK J, et al. Symptoms in severe aortic stenos is are associated with decreased compensatory circumferential myocardial mechanics[J]. J Am Soc Echocardiogr, 2015, 28(2): 218-225.
[3] KAMPERIDIS V, JOYCE E, DEBONNAIRE P, et al. Left ventricular functional recovery and remodeling in low-flow low-gradient severe aortic stenos is after transcatheter aortic valve implantation[J]. J Am Soc Echocardiogr, 2014, 27(8):817-825.
[4] BAUMGARTNER H, FALK V, BAX J J, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease[J]. Eur Heart J, 2017, 38(36): 2739-2791.
[5] LANG R M, BADANO L P, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. J Am Soc Echocardiogr, 2015, 28(1): 1-39.
[6] 姜勝利, 高長青, 李伯君, 等. 左心室功能嚴重受損合并跨主動脈瓣壓差減低的重度主動脈瓣狹窄患者的外科治療[J]. 中華胸心血管外科雜志, 2012, 28(7): 415-417.
[7] 楊勇, 劉楠, 侯曉彤. 70歲以上中重度主動脈瓣狹窄患者手術高危因素分析[J]. 心肺血管病雜志, 2016, 35(6): 442-444, 461.
[8] ADDETIA K, TAKEUCHI M, MAFFESSANTI F, et al. Simultaneous longitudinal strain in all 4 cardiac chambers: A novel method for comprehensive functional assessment of the heart[J]. Circ Cardiovasc Imaging, 2016, 9(3): e003895.
[9] NAGATA Y, TAKEUCHI M, WU V C, et al. Prognostic value of LV deformation parameters using 2D and 3D speckle-tracking echocardiography in asymptomatic patients with severe aortic stenos is and preserved LV ejection fraction[J].JACC Cardiovasc Imaging, 2015, 8(3): 235-245.
[10] 趙映, 李治安, 孫琳, 等. 斑點追蹤技術評價重度主動脈瓣狹窄瓣膜置換術前后左室收縮功能[J]. 中國超聲醫學雜志, 2011, 27(3): 224-227.
[11] 高菡靜, 謝明星, 楊莉, 等. 二維斑點追蹤顯像評價重度主動脈瓣狹窄患者左室壁心肌功能改變[J]. 中華超聲影像學雜志, 2013, 22(11): 921-926.
[13] 丁錢山, 張平洋, 董靜, 等. 三維斑點追蹤技術評價左心室射血分數正常的重度主動脈瓣狹窄患者主動脈瓣置換術后左心室心肌功能[J]. 中華醫學超聲雜志(電子版), 2017,14(4): 285-291.
[13] 丁錢山, 張平洋, 董靜, 等. 三維斑點追蹤技術評價左心室射血分數正常的重度主動脈瓣狹窄患者主動脈瓣置換術后左心室心肌功能[J]. 中華醫學超聲雜志(電子版), 2017,14(4): 285-291.
[14] 丁錢山, 張平洋, 李林, 等. 三維斑點追蹤技術評價射血分數正常的重度主動脈瓣狹窄患者左室心肌收縮特性[J].中國超聲醫學雜志, 2017, 33(2): 128-131.
[15] 陳麗萍, 魏薪, 馮沅, 等. 三維斑點追蹤技術評價經導管主動脈瓣植入術患者左心室整體及局部收縮功能[J]. 中華超聲影像學雜志, 2014, 23(10): 829-834.
[16] 陳小果, 舒先紅. 超聲心動圖心肌分層應變的臨床應用進展[J]. 中華超聲影像學雜志, 2016, 25(7): 638-640.
[17] 史靜, 潘翠珍, 舒先紅, 等. 二維斑點追蹤顯像技術定量評價正常成年人左心室心肌分層應變[J]. 中華超聲影像學雜志, 2015(5): 378-380, 381.
[18] DAHL J S, CHRISTENSEN N L, VIDEB?K L, et al. Left ventricular diastolic function is associated with symptom status in severe aortic valve stenosis[J]. Circ Cardiovasc Imaging, 2014, 7(1): 142-148.
[19] CARSTENSEN H G, LARSEN L H, HASSAGER C, et al.Association of ischemic heart disease to global and regional longitudinal strain in asymptomatic aortic stenosis[J]. Int J Cardiovasc Imaging, 2015, 31(3): 485-495.
[20] ARONSON D, MUTLAK D, BAHOUTH F, et al. Restrictive left ventricular filling pattern and risk of new-onset atrial fibrillation after acute myocardial infarction[J]. Am J Cardiol, 2011, 107(12): 1738-1743.

