SIRT1在非酒精性脂肪肝病大鼠肝臟中的表達及姜黃素衍生物L6H4的干預作用
丁婷婷,吳杭菲,劉成,湯雯,王圣凱,鄭靖宇,朱再勝,彭天慶
(溫州醫科大學附屬第一醫院,浙江 溫州 325015,1.病理科;2.老年病科)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除外乙醇和其他明確的損肝因素所致的以肝細胞內脂肪過度沉積為主要特征的臨床病理綜合征[1]。研究表明氧化應激與脂質過氧化是導致NAFLD發生、發展的重要機制之一[2-3]。沉默調節蛋白1(silent information regulater 1,SIRT1)是一種煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依賴的蛋白去乙酰化酶。REN等[4]研究發現,SIRT1可通過減少脂肪酸及甘油三酯(triglycer-ide,TG)產生、調節脂質穩態及抵抗氧化應激而在NAFLD中發揮重要作用。L6H4是去除了姜黃素β-二酮基團的姜黃素衍生物,具有更好的穩定性,已被證實具有強大的抗炎、抗氧化等廣泛的藥理作用。目前,已有研究表明姜黃素能夠明顯阻礙NAFLD的進展,但關于姜黃素衍生物L6H4防治NAFLD的研究卻少有報道。本研究通過高脂誘導NAFLD大鼠模型,用姜黃素衍生物L6H4進行干預,觀察大鼠血脂、肝臟氧化應激水平和形態學改變,并檢測SIRT1、發動相關蛋白1(mitochondrial dynamin-related protein1,DRP 1)和線粒體融合蛋白2(mito fusion 2,MFN2)在大鼠肝臟組織中的表達,探討姜黃素衍生物L6H4對NAFLD發揮保護作用的可能機制,為NAFLD的防治提供理論依據。
1 材料和方法
1.1 動物模型建立與處理 選用12周齡、體質量為(280±20)g的雄性SD大鼠(由溫州醫科大學實驗動物中心提供,動物使用許可號:WYDW2014-0052)。適應性喂養1周后,隨機分為3組,正常組(control組)、模型組(NAFLD組)和治療組(L6H4組),每組8只。control組給予基礎飼料,余2組全程給予高脂飼料(上海普路騰生物科技有限公司),配方及營養素占比見表1-2。L6H4組并從第9周開始用姜黃素衍生物L6H4干預治療。具體方法:于每天下午1∶00-2∶00按實驗設計給予L6H4組0.2 mg?kg-1姜黃素衍生物L6H4溶于1%的羧甲基纖維素鈉(sodium carboxymethyl cellulose,CMC)灌胃,control組和NAFLD組給予相應體積的1% CMC灌胃。至20周末禁食12 h后,用腹腔注射水合氯醛處死各組大鼠。分別收集全血及取部分肝組織置4%中性甲醛溶液中固定,用于肝組織形態學觀測;另取部分肝組織置-80 ℃冰箱迅速冷凍備用。
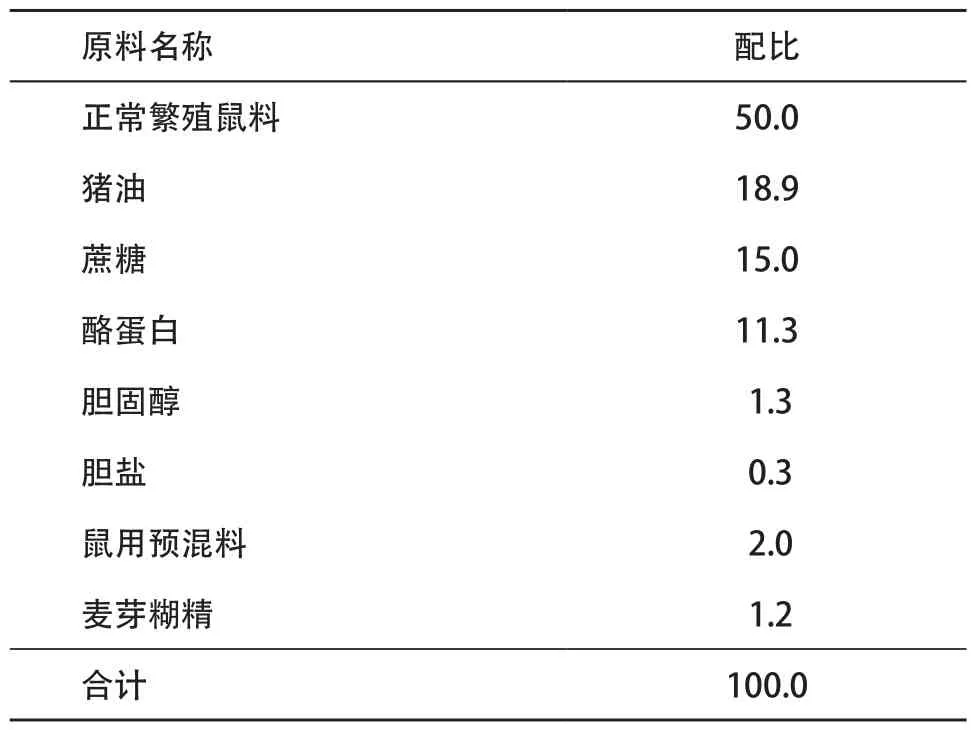
表1 高脂飼料配方(g/100 g)
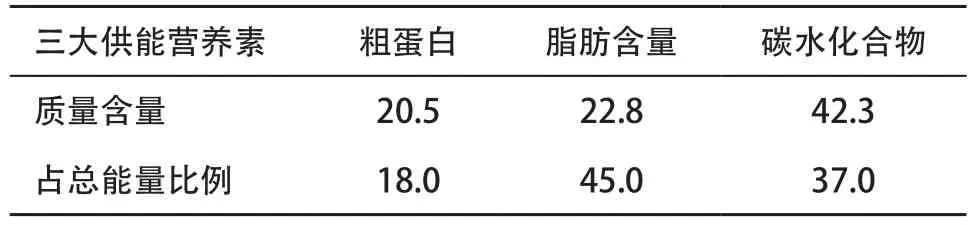
表2 各營養素占比(%)
1.2 藥品與主要試劑 姜黃素衍生物L6H4(溫州醫科大學梁廣教授惠贈);蛋白濃度測定試劑盒(上海碧云天生物公司);蛋白一抗(美國CST公司);蛋白二抗(美國Bioword公司);ECL發光液(杭州弗德生物科技公司);Trizol、PCR引物合成(美國Invitrogen公司);反轉錄試劑盒(大連Takara公司);RT-PCR試劑盒(美國ABI公司);超氧化物歧化酶(super oxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)測定試劑盒(南京建成生物公司)。
1.3 方法
1.3.1 血脂的檢測:大鼠麻醉后斷頭取全血,全自動生化分析儀檢測各組大鼠的TG、總膽固醇(total cholesterol,TC)、低密度脂蛋白膽固醇(lowdensity lipoprotein cholesterol,LDL-C),高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)水平。
1.3.2 光鏡標本制作:取4%中性甲醛溶液固定24 h肝組織,按常規行乙醇梯度脫水、石蠟包埋后,切片(厚度為5 μm),分別用于常規HE染色和Masson染色[5],光鏡下觀察肝組織的病理變化情況。
1.3.3 肝組織中MDA含量及T-SOD活力檢測:分別稱取各組大鼠肝組織,每只15 mg,分別放入已加裂解液的Ep管中,冰上勻漿,置4 ℃離心(13000 r/min,15 min),取上清液,BCA蛋白濃度測定試劑盒測定蛋白濃度,檢測各組肝臟組織內MDA含量及T-SOD活力,具體操作按試劑盒說明書進行,并重復3次。
1.3.4 RT-PCR檢測:分別稱取各組大鼠肝組織,每只20 mg,分別放入已加1 mL Trizol的預冷去酶Ep管中,按Trizon試劑說明書方法提取總RNA。以總RNA為模板反轉錄合成cDNA,取適量cDNA以10 μL體系放入PCR儀進行反應。結果以β-actin為內參照,根據循環(Ct)值用2-△△Ct法計算基因的相對表達量。SIRT1引物序列上游:5’-CGGACAGTTCCAGCC ATCTC-3’,下游引物:5’-CAAAGGAACCATGACACTGAATG-3’;DRP1引物序列上游:5’-GAAGTGGTGCAGTGGAAATG AC-3’,下游引物:5’-GTTTCTATTGGGAACCACTGCC-3’;MFN2引物序列上游:5’-CACTACCACATCGGACACCCTA-3’,下游引物:5’-GAACTTGTGTCTTGCATTTGGC-3’;β-actin引物序列上游:5’-CCTCTATGCCAACACAGTGC-3’,下游引物:5’-ATACTCCTGCTTGCTGATCC-3’,實驗重復3次。
1.3.5 Western blot檢測:如1.3.3處理肝組織,測定蛋白濃度,定容定量后取樣品加熱變性,加樣,電泳分離蛋白,轉膜,5%脫脂牛奶封閉,TRS-T洗膜后4 ℃下一抗搖床過夜,洗膜后 II抗室溫孵育1 h,再次洗膜后加化學發光液,用Image-lab成像儀曝光顯影。用計算機分析軟件對條帶進行分析,以目的蛋白與內參條帶積累吸光度(A)比作為反映目的蛋白表達的相對指標。一抗濃度:各蛋白指標1∶1000;內參1∶5000; II抗濃度1∶5000,實驗重復3次。
1.4 統計學處理方法 運用SPSS19.0統計軟件進行數據分析。計量資料均采用±s表示,多組間比較采用單因素方差分析,方差齊者組間兩兩比較采用LSD法。方差不齊者則用Tamhane’s T2法。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠血脂的比較 與control組比,NAFLD組大鼠血清中TG、TC和LDL-C濃度均顯著升高,而HDL-C濃度顯著降低,差異均具有統計學意義(P<0.05);與NAFLD組比,L6H4組大鼠血清中TG、TC和LDL-C的濃度較均顯著降低,差異均具有統計學意義(P<0.05)。見表3。
表3 各組大鼠血脂水平比較(n=8,±s,mmol/L)
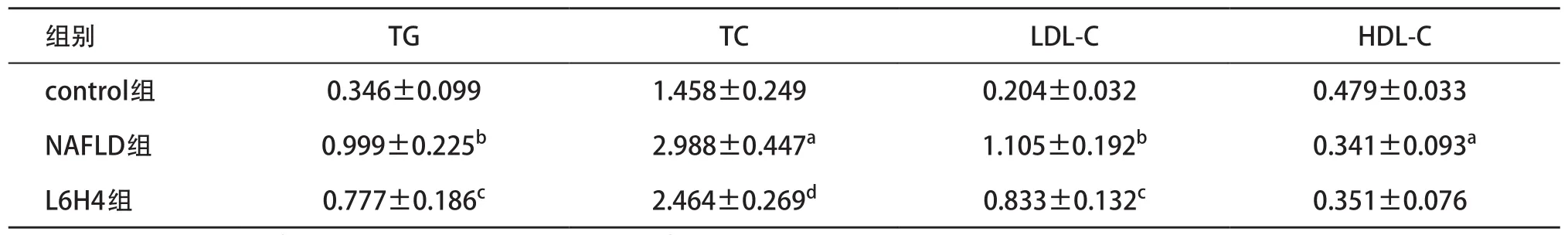
表3 各組大鼠血脂水平比較(n=8,±s,mmol/L)
與control組比:aP<0.05,bP<0.01;與NAFLD組比:cP<0.05,dP<0.01
2.2 肝臟形態學變化 肝組織HE染色顯示:control組大鼠肝小葉結構清晰,肝細胞呈多面體形,胞漿豐富,胞核居中,以中央靜脈為中心,肝細胞呈單行條索狀向周圍呈放射狀排列,肝索間可見明顯的肝竇;NAFLD組肝小葉結構明顯紊亂,大量肝細胞脂肪變性,顯示細胞體積增大,胞漿內可見大小不等的空泡,胞核偏離或靠近胞膜,肝竇消失,肝小葉內可見局灶性壞死及炎癥細胞浸潤;L6H4組肝小葉結構較紊亂,部分肝細胞脂肪變性,胞漿內可見小空泡,大部分胞核居中,小葉內未見明顯的壞死及炎癥細胞浸潤,可見L6H4組脂肪變性較NAFLD組明顯減輕。見圖1A-C。肝組織Masson染色顯示:control組大鼠肝組織匯管區、肝被膜及中央靜脈周圍可見很少量的膠原纖維呈藍色;NAFLD組大鼠肝組織匯管區及中央靜脈周圍見明顯膠原纖維增多并向周圍放射,未見假小葉形成;而L6H4組大鼠肝組織匯管區及中央靜脈膠原纖維明顯減少,見圖1D-F。
2.3 各組大鼠肝組織T-SOD活力及MDA含量測定結果 與control比,NAFLD組大鼠肝組織T-SOD活力明顯降低,而脂質過氧化標志物MDA含量升高,差異均具有統計學意義(P<0.05);與NAFLD組相比,L6H4組大鼠肝組織T-SOD活力明顯升高,而MDA含量明顯下降,差異均具有統計學意義(P<0.05),表明姜黃素衍生物L6H4具有抗氧化性,見圖2。
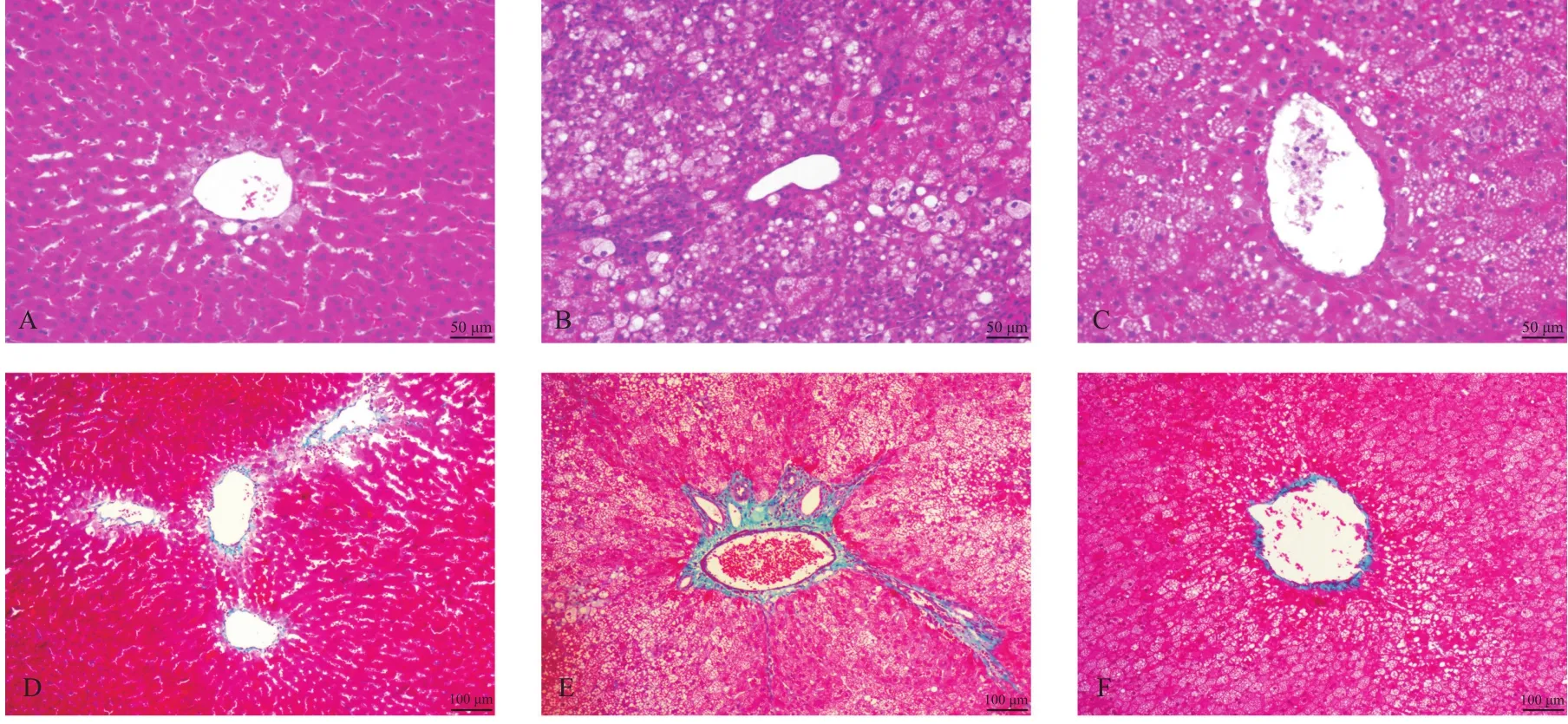
圖1 各組大鼠肝組織HE染色及Masson染色
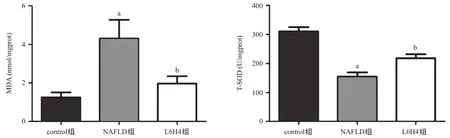
圖2 各組大鼠肝組織SOD活力及MDA含量測定結果
2.4 各組大鼠肝組織SIRT1、DRP1、MFN2的mRNA表達 與control組比,NAFLD組大鼠肝臟組織DRP1 mRNA表達量明顯升高,而SIRT1及MFN2 mRNA表達量明顯降低,差異均有統計學意義(P<0.01);與NAFLD組比,L6H4大鼠DRP1 mRNA表達量明顯降低,SIRT1及MFN2 mRNA表達量明顯升高,差異均有統計學意義(P<0.01),見圖3。
2.5 各組大鼠肝組織SIRT1、DRP1、MFN2的蛋白表達 與control組比,NAFLD組大鼠肝臟組織DRP1蛋白表達量明顯升高,而SIRT1及MFN2蛋白表達量明顯降低,差異均有統計學意義(P<0.01);與NAFLD組相比,L6H4組大鼠DRP1蛋白表達量明顯降低,差異有統計學意義(P<0.01),而SIRT1及MFN2蛋白表達量明顯升高,差異均有統計學意義(P<0.05),見圖4。
3 討論
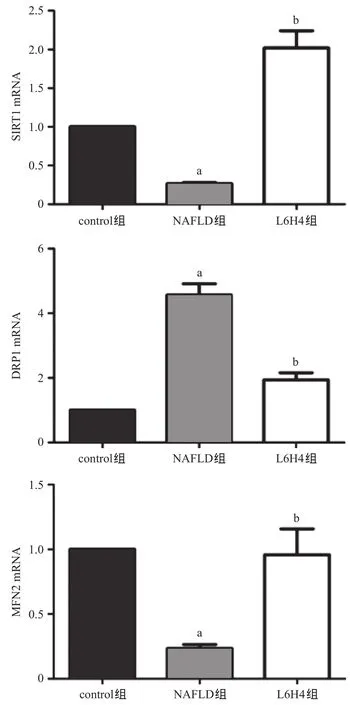
圖3 各組大鼠肝組織mRNA表達結果
目前NAFLD的發病機制尚未明確,但以“二次打擊”學說為基礎的“多重打擊”理論被大多數的學者所接受[6]。近年來,研究發現SIRT1通過調節肝細胞的脂質和碳水化合物的代謝在NAFLD的發生、發展中發揮重要的作用[7],高脂飲食可降低肝組織中SIRT1的表達,減少肝細胞中脂肪酸氧化,從而增加脂肪生成和細胞內的沉積[8],而過表達SIRT1則能夠延緩NAFLD的進展[9]。本研究結果顯示NAFLD模型肝組織內SIRT1的表達量明顯降低,而且外周血中TG和LDL-C升高、HDL-C降低。此結果與TOBITA等[8]的研究結果類似。COLAK等[9]認為SIRT1可降低肝細胞的胰島素抵抗,改善肝細胞的脂質代謝,從而減少脂肪生成和細胞內的沉積。姜黃素衍生物L6H4干預治療后,NAFLD大鼠肝組織內SIRT1的表達量明顯升高,肝組織的脂肪變性和膠原纖維的沉積明顯改善,同時外周血中HDL-C增高,TG和LDL-C降低。表明姜黃素衍生物L6H4改善肝細胞的脂質代謝,減輕肝細胞的脂肪變性。其機制與可能其上調NAFLD大鼠肝組織內SIRT1的表達,從而降低肝細胞對胰島素的抵抗,改善肝細胞的脂質代謝有關。
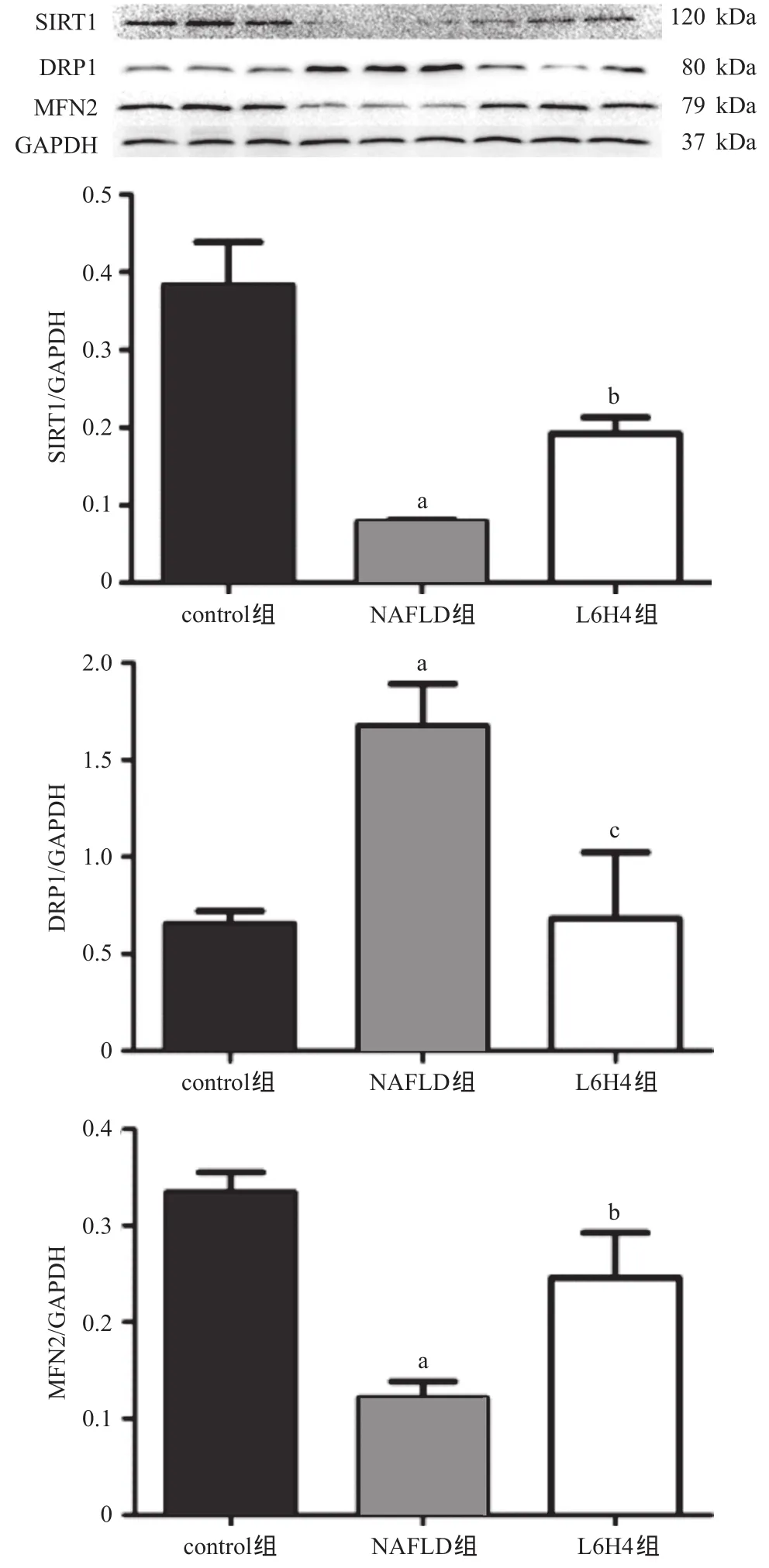
圖4 各組大鼠肝組織蛋白表達結果
SOD和MDA是公認的監測氧化應激的生物標志。SOD活力減弱,MDA含量增加提示氧化應激增強。在NAFLD發展過程中,氧化應激損傷被認為是重要的病理生理基礎[10]。本研究結果表明姜黃素衍生物L6H4能降低NAFLD模型大鼠肝臟的氧化應激損傷。最近的研究表明,在高脂誘導的NAFLD模型中,SIRT1可提高SOD的表達及活性,從而抵抗氧化應激損傷[11]。本研究發現姜黃素衍生物L6H4不僅增加肝組織SIRT1的表達和SOD活性,而且降低肝組織內脂質過氧化的最終產物MDA含量,減少MDA對細胞的毒性作用。提示姜黃素衍生物L6H4具有“雙重”抗氧化應激的作用。其機制可能是姜黃素衍生物L6H4提高NAFLD模型大鼠肝細胞中的SIRT1的表達,一方面通過脫乙酰基活化,提高SOD的表達及活性;另一方面通過減少肝細胞脂質的沉積,降低脂質過氧化產生的MDA。
近年來氧化應激與線粒體功能的關系受到普遍關注,線粒體的功能與其結構密切相關,而線粒體的結構是由線粒體的融合及分裂的平衡來維持的。在哺乳動物中DRP1是線粒體分裂的重要執行分子,而MFN2是線粒體融合的主要執行分子,兩者的作用平衡是保證線粒體功能的關鍵[12]。在病理狀態下,ROS主要產生于線粒體,ROS增多,線粒體分裂增加,引起線粒體凋亡的發生[13]。我們前期的體外實驗發現:棕櫚酸使肝細胞DRP1表達增加,MFN2表達減少;姜黃素衍生物L6H4干預后則明顯減少棕櫚酸環境中肝細胞的DRP1的表達,從而抑制線粒體的分裂及其下游線粒體凋亡途徑的信號傳導[14]。近期研究表明,SIRT1參與調控了多種與線粒體增殖的轉錄因子的表達及活性,從而對線粒體數量及質量調節起重要作用[15-18]。本研究檢測了SIRT1、DRP1和MFN2 mRNA及蛋白的表達水平,發現姜黃素衍生物L6H4能明顯提高高脂誘導NAFLD模型大鼠肝組織內SIRT1、MFN2表達水平,降低DRP1表達水平。表明姜黃素衍生物L6H4可能通過調節或激活SIRT1的表達和活性,促進線粒體融合,同時抑制線粒體分裂,進而發揮其對NAFLD的保護作用,但其機制有待進一步研究證實。
綜上所述,姜黃素衍生物L6H4可顯著改善NAFLD的進展,其機制可能是通過增加SIRT1的表達和活性,降低肝細胞對胰島素的抵抗和脂質過氧化反應,減輕氧化應激、抑制線粒體分裂。代謝調節因子SIRT1可能作為NAFLD潛在的藥物治療靶點。
參考文獻:
[1] CHALASANI N, YOUNOSSI Z, LAVINE J E, et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association[J].Hepatology, 2012, 107(6): 811-826.
[2] WANG L, LIU X, NIE J, et al. ALCAT1 controls mitochondrial etiology of fatty liver diseases, linking defective mitophagy to steatosis[J]. Hepatology, 2015, 61(2): 486-496.
[3] GAMBINO R, MUSSO G, CASSADER M. Redox balance in the pathogenesis of nonalcoholic fatty liver disease:mechanisms and therapeutic opportunities[J]. Antioxid Redox Signal, 2011, 15(5): 1325-1365.
[4] REN T, HUANG C, CHENG M. Dietary blueberry and bifidobacteria attenuate nonalcoholic fatty liver disease in rats by affecting SIRT1-mediated signaling pathway[J]. Oxid Med Cell Longev, 2014, 2014: 469059.
[5] 王玲, 徐夢菲, 劉曦, 等. 姜黃素衍生物 B 06對2型糖尿病大鼠肝臟的保護作用[J]. 中國病理生理雜志, 2014, 30(2):328-332.
[6] MONJUR A. Non-alcoholic fatty liver disease in 2015[J].World J Hepatol, 2015, 7(11): 1450-1459.
[7] WU T, LIU Y H, FU Y C, et al. Direct evidence of sirtuin downregulation in the liver of non-alcoholic fatty liver disease patients[J]. Ann Clin Lab Sci, 2014, 44(4): 410-418.
[8] TOBITA T, GUAMAN-LEPE J, TAKEISHI K, et al. SIRT1 disruption in human fetal hepatocytes leads to increased accumulation of glucose and lipids[J]. PLoS One, 2016, 11(2):e0149344.
[9] COLAK Y, OZTURK O, SENATES E, et al. SIRT1 as a potential therapeutic target for treatment of nonalcoholic fatty liver disease[J]. Med Sci Monitor, 2011, 17(5): HY5-HY9.
[10] ROLO A P, TEODORO J S, PALMEIRA C M. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis[J]. Free Radic Biol Med, 2011, 52(1): 59-69.
[11] DING R B, BAO J, DENG C X. Emerging roles of SIRT1 in fatty liver diseases[J]. Int J Biol Sci, 2017, 13(7): 852-867.
[12] BEREITER-HAHN J, V?TH M. Dynamics of mitochondria in living cells: Shape changes, dislocations, fusion, and fission of mitochondria[J]. Microsc Res Tech, 1994, 27(3):198-219.
[13] SUEN D F, NORRIS K L, YOULE R J. Mitochondrial dynamics and apoptosis[J]. Genes Dev, 2008, 22(12): 1577-1599.
[14] 鄭靖宇, 吳歡, 湯雯, 等. Drp1和Mfn2在棕櫚酸誘導大鼠肝細胞損傷中的作用機制及姜黃素衍生物L6H4的干預作用[J]. 溫州醫科大學學報, 2016, 46(7): 469-475.
[15] VALERO T. Mitochondrial biogenesis: pharmacological approaches[J]. Curr Pharm Design, 2014, 20(35): 5507-5509.
[16] 羅桂平, 蹇朝, 張華剛, 等. Sirt1在缺氧條件下對心肌細胞線粒體融合與分裂中的作用[J]. 第三軍醫大學學報, 2016,38(10): 1121-1126.
[17] BIEL T G, LEE S, FLORES-TORO J A, et al. Sirtuin 1 suppresses mitochondrial dysfunction of is chemic mouse livers in a mitofusin 2-dependent manner[J]. Cell Death Differ,2016, 23(2): 279-290.
[18] MIAO Y, ZHAO S, GAO Y, et al. Curcumin pretreatment attenuates inflammation and mitochondrial dysfunction in experimental stroke: The possible role of Sirt1 signaling[J].Brain Res Bull, 2016, 121: 9-15.

