納米碳示蹤劑在腹腔鏡胃癌淋巴結清掃術中的臨床研究*
賈榮保,姜立新,姚增武,王熙勛,胡金晨,張翼飛,李 波,于華隆
(青島大學附屬煙臺毓璜頂醫院,山東 煙臺,264000)
胃癌是人類最常見的消化道惡性腫瘤之一,病死率居全球惡性腫瘤的第2位[1],且由于胃癌早期無特殊癥狀,而我國大部分人群缺乏查體意識,胃癌發現時多已是進展期,發生周圍擴散。其主要擴散、轉移途徑是淋巴轉移,患者就診時多已發生淋巴結轉移[2]。區域淋巴轉移狀態是判斷胃癌患者預后的獨立因素[3-4],能否徹底清掃腫瘤相關淋巴結關系到術后生存時間。目前手術治療仍是根治胃癌的唯一方法,近年隨著腹腔鏡技術的發展,腹腔鏡手術在國內外得到了廣泛應用,雖然具有良好的視野,可準確、清晰顯示脈管、神經及筋膜,但淋巴結清掃一直是個難題。納米碳作為新型的淋巴示蹤劑,可較好地顯色淋巴結,降低清掃難度。本文主要研究納米碳應用于腹腔鏡胃癌切除術中淋巴結尤其微小淋巴結的檢出數量及對淋巴結轉移率的影響。
1 資料與方法
1.1 臨床資料 回顧分析2015年6月至2017年6月我科為120例胃癌患者行腹腔鏡胃癌切除術的臨床資料,其中63例行常規腹腔鏡胃癌切除術(對照組),57例術中應用納米碳(實驗組)。對比兩組淋巴結檢出情況、微小淋巴結檢出情況、淋巴結黑染情況及淋巴結轉移情況。入組標準:(1)術前均經胃鏡病理確診為胃癌,且無腦、心、腎、肝、肺等重大基礎疾病;(2)術前均未行化療,無明顯手術禁忌;(3)順利施行腹腔鏡手術,且均行R0切除,術中、術前均未發現遠處轉移。排除標準:(1)術前存在遠處轉移;(2)未能完全行R0切除。兩組患者在性別、年齡、TNM分期及腫瘤大小等方面差異均無統計學意義(P>0.05),具有可比性,見表1。
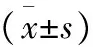
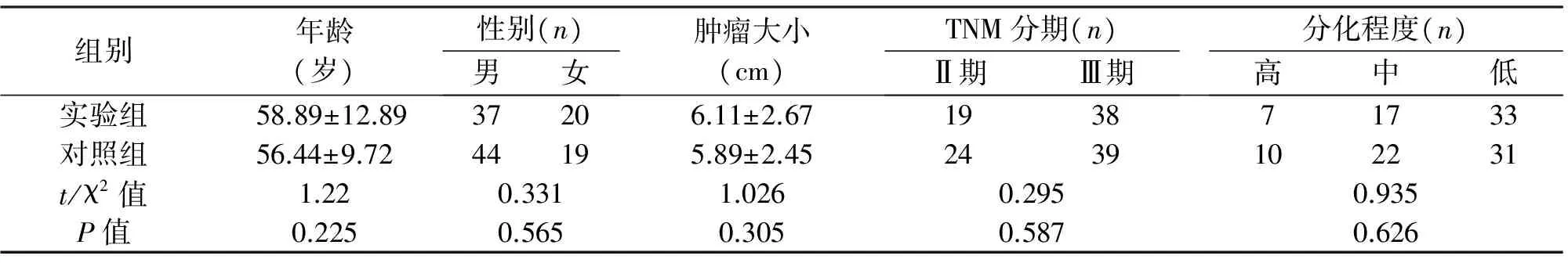
組別年齡(歲)性別(n)男女腫瘤大小(cm)TNM分期(n)Ⅱ期Ⅲ期分化程度(n)高中低實驗組58.89±12.8937206.11±2.67193871733對照組56.44±9.7244195.89±2.452439102231t/χ2值1.220.3311.0260.2950.935P值0.2250.5650.3050.5870.626
1.2 手術方法
1.2.1 納米碳注射方法 患者平躺在手術臺上,待氣管插管麻醉后,建立氣腹。首先置入腹腔鏡探查,待確定腹腔及周圍臟器無轉移后行遠端胃癌D2根治術,實驗組首先于腫瘤周圍注射納米碳,具體方法為:首先用注射器吸入1 ml納米碳懸濁液,選取靜脈輸液器針剪去針柄,在腹腔鏡指示下經主操作孔將靜脈輸液器針置入腹腔,頭皮針的端口與注射器相連。腫瘤邊緣選取4~6個點,用分離鉗固定靜脈輸液器針,斜行穿過漿膜層后,繼續潛行0.5~1.0 cm后注射納米碳懸濁液,共注射1 ml,見圖1。為防止納米碳注射后溢出黑染周圍組織,注射后應靜止5 s再拔出,并用腔鏡紗布按壓。對照組無需注射納米碳,直接行遠端胃癌D2根治術。兩組均由同一組經驗豐富的外科醫生完成。
1.2.2 術后標本淋巴結撿取 標本取下來后由專業的同一組人員檢取標本上的淋巴結,記錄檢出淋巴結直徑、數量,納米碳組還需記錄淋巴結黑染情況。并將術中檢獲的淋巴結進行相同的分類及記錄,兩組標本常規行HE染色,顯微鏡下觀察淋巴結轉移情況。
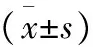
2 結 果
2.1 術中所見 納米碳注射后,可見納米碳沿淋巴管向周圍擴散,并未對周圍組織染色。術中操作時,可見黑染明顯的淋巴結,見圖2、圖3,手術順利。
2.2 淋巴結的檢獲數量 實驗組共檢獲淋巴結2 124枚,對照組共檢獲淋巴結1 466枚,實驗組平均淋巴結檢出數量明顯高于對照組[(37.26±6.81) vs.(23.27±3.49),P=0.000]。直徑≤5 mm的淋巴結,實驗組檢出率為59.56%(1 265/2 124),高于對照組的44.41%(651/1 466),差異有統計學意義(P=0.00)。直徑≤2 mm的淋巴結,實驗組檢出率為23.40%(497/2 124),高于對照組的19.37%(284/1 466),差異有統計學意義(P=0.004)。見表2。
2.3 淋巴結黑染及轉移情況 實驗組黑染淋巴結數量1 393枚,黑染率為65.58%,其中黑染淋巴結有385枚存在轉移,其轉移率為27.64%;而實驗組中未黑染淋巴結共731枚,轉移淋巴結共62枚,轉移率為8.48%。兩者轉移率差異有統計學意義(χ2=105.882,P=0.000)。對照組共發現275枚轉移淋巴結,轉移率為18.76%。黑染淋巴結轉移率明顯高于對照組,差異有統計學意義(χ2=19.810,P=0.000)。見表3、表4。
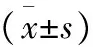
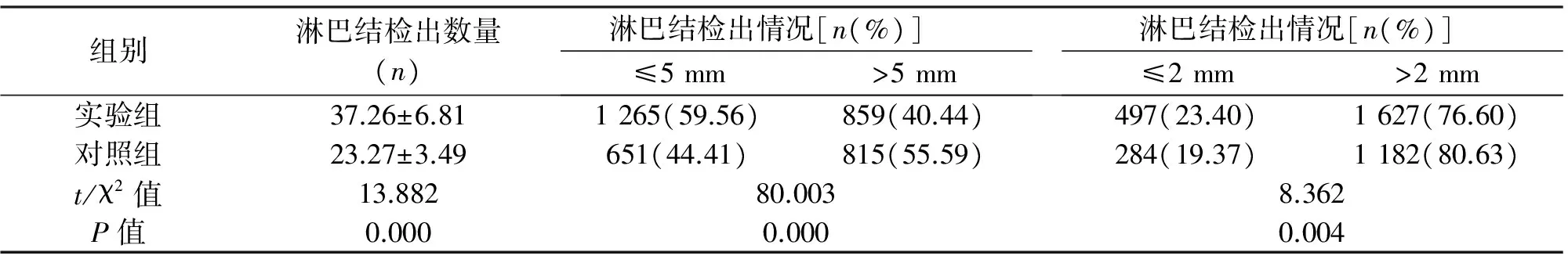
組別淋巴結檢出數量(n)淋巴結檢出情況[n(%)]≤5mm>5mm淋巴結檢出情況[n(%)]≤2mm>2mm實驗組37.26±6.811265(59.56)859(40.44)497(23.40)1627(76.60)對照組23.27±3.49651(44.41)815(55.59)284(19.37)1182(80.63)t/χ2值13.88280.0038.362P值0.0000.0000.004
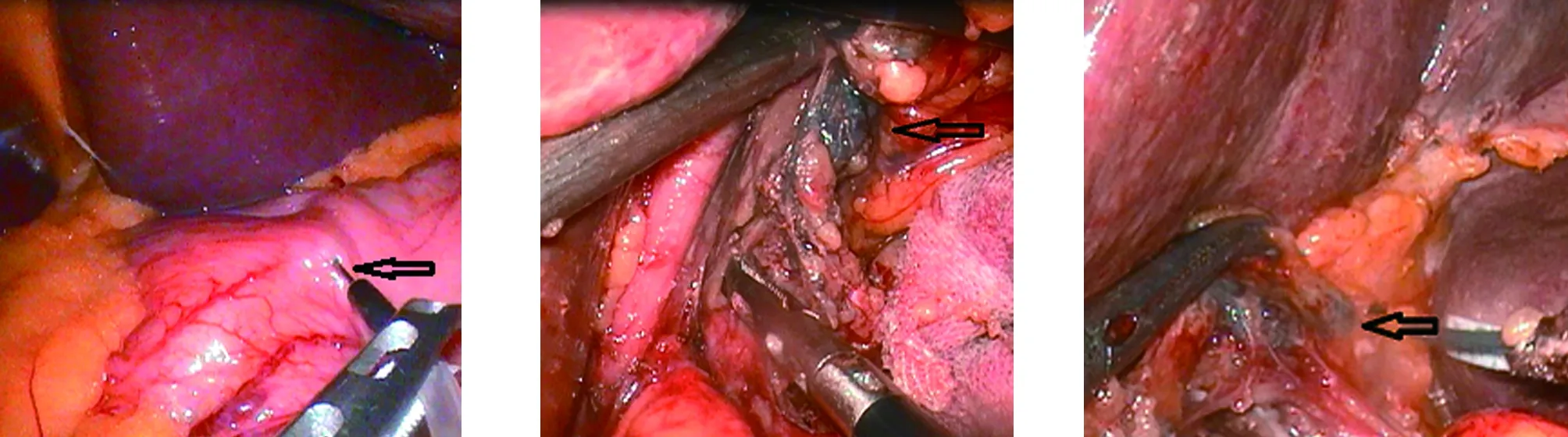
圖1 納米碳注射圖2 黑染淋巴結(箭頭所示)圖3 黑染淋巴結(箭頭所示)
表3 實驗組黑染淋巴結及未黑染淋巴結轉移率的比較[n(%)]
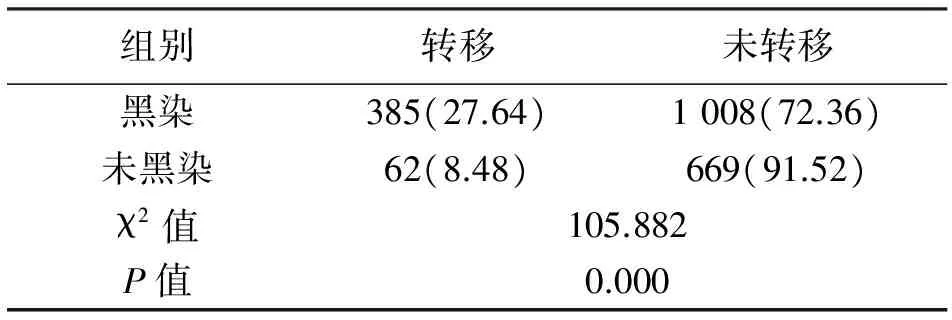
組別轉移未轉移黑染385(27.64)1008(72.36)未黑染62(8.48)669(91.52)χ2值105.882P值0.000
表4 實驗組黑染淋巴結及對照組淋巴結轉移率的比較[n(%)]
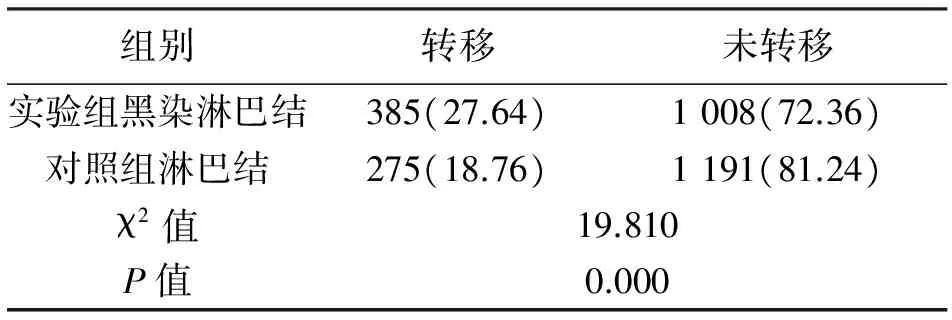
組別轉移未轉移實驗組黑染淋巴結385(27.64)1008(72.36)對照組淋巴結275(18.76)1191(81.24)χ2值19.810P值0.000
3 討 論
目前手術治療仍是胃癌根治的主要方式,1994年Kitano等[5]首次施行腹腔鏡輔助胃癌切除術,相較傳統開腹手術具有明顯的微創優勢,并具有較好的安全性、可行性[6-8]。隨著D2根治術逐漸成為標準術式,對胃癌淋巴結的清掃提出了更高的要求,尤其淋巴結對患者的術后預期及指導治療均具有重要作用。Kwon[9]結合第7版腫瘤TNM分期及多項大型隨機臨床研究建議將獲取>15枚的淋巴結作為腫瘤TNM準確分期的必要條件。即使淋巴結陰性的胃癌中淋巴結仍存在微轉移[10]。研究表明[11],足夠數量的淋巴結清掃能改善淋巴結陰性患者的生存,因此行D2胃癌根治術時應盡最大可能地將淋巴結清掃干凈。傳統開腹手術不僅可靠視覺發現淋巴結,還可靠手的觸覺發現淋巴結,而腹腔鏡只能靠視覺,有一定難度,尤其年輕術者更容易漏檢淋巴結,不利于患者的預后及術者技術水平的提高。納米碳的應用能較好地使淋巴結顯色,與周圍組織形成對比,減少漏檢、錯檢及對患者的損傷。
為精確清掃淋巴結,術中嘗試使用淋巴結示蹤劑,淋巴結示蹤劑主要有核素法、染料法,核素法的準確性雖然高,但儀器、設備價格昂貴,不利于臨床開展。染料法相對簡單、便宜而得到推廣。納米碳作為最新的染料示蹤劑,改善了第一代染料淋巴結示蹤劑(甲藍、印度墨水)等顆粒大、彌散性小、著色不明顯導致示蹤效果欠佳[12],以及第二代(活性炭等)黑染不均、局部黑染嚴重等缺點。納米碳是黑色懸濁液,它由普通活性碳經過技術處理制成光滑碳顆粒,添加助懸劑聚乙烯吡咯烷酮、生理鹽水后制成[13],具有高度的淋巴趨向性,可被巨噬細胞吞噬,直徑較大極少進入血管[14],納米碳作為淋巴結示蹤劑已較廣泛地應用于乳腺癌[15]、甲狀腺癌[16]、結直腸癌[17]等惡性腫瘤手術中;Bara等[18]發現納米碳對人體安全無影響。
本研究中淋巴結黑染率為65.58%,實驗組淋巴結平均檢出數量高于對照組,差異有統計學意義,結果與陳鴻源等[19]的報道一致,表明納米碳對淋巴結具有良好的示蹤效果。納米碳能提高淋巴結檢出數量是因為納米碳沿淋巴管傳導,能使術者較直觀的辨別淋巴結,給術者一定的導向作用,可對淋巴結進行更精細的清掃。其次由于納米碳直徑較大,能較長時間地留在淋巴結內,使術者有充足時間進行清掃,不像美藍會很快褪色[18];即使標本取下后,淋巴結仍然顯示黑色,使我們能較準確地檢出淋巴結。術中由于淋巴伴隨血管走行,黑染的淋巴結在一定程度上可幫助術者了解血管走向,尤其變異血管,減少血管損傷,縮短術者的學習曲線。
本研究還觀察到實驗組小淋巴結檢出數量明顯高于對照組,且病理中發現很多小淋巴結中已存在轉移,術中、術后標本將其檢出及其重要,由于體積較小,術中憑感觀容易漏檢,納米碳不僅可使較大淋巴結顯色,也可使小淋巴結顯色,提高了檢出率。
淋巴結轉移不僅是影響胃癌患者預后生存的獨立因素之一[3-4],也是胃癌術后病理分期的因素之一,轉移淋巴結的檢出尤為重要,本研究中實驗組陽性淋巴結數量明顯高于對照組,利于對胃癌進行更為準確的病理分期,尤其Ⅱ、Ⅲ期,有助于術后為患者提供更精確的治療。本研究還發現黑染淋巴結轉移率高于未黑染淋巴結,提示納米碳對于轉移的淋巴結具有較高的親和性,對于淋巴結清掃范圍的制定有一定輔助作用,尤其有爭議的16組淋巴結,也許在個體化的治療中納米碳的應用能為16組淋巴結的清掃提供指示性作用。
綜上所述,納米碳應用于腹腔鏡胃癌根治術中具有良好的淋巴示蹤效果,能提高淋巴結檢出數量,尤其更有效地檢出微小淋巴結,對患者預后進行更有效的判斷,較準確地進行病理分期。納米碳作為示蹤劑是否利于延長患者術后生存期尚待進一步研究。
參考文獻:
[1] Herrero R,Park JY,Forman D.The fight against gastric cancer-the IARC Working Group report[J].Best Pract Res Clin Gastroenterol,2014,28(6):1107-1114.
[2] 朱海濤,趙宜良,吳云飛.不同漿膜反應類型胃癌淋巴結轉移特點及其對實施合理根治術的指導意義[J].中華腫瘤雜志,2009,31(6):474-477.
[3] Alatengbaolide,Lin D,Li Y,et al.Lymph node ratio is an independent prognostic factor in gastric cancer after curative resection (R0) regardless of the examined number of lymph nodes[J].Am J Clin Oncol,2013,36(4):325-330.
[4] Adachi Y,Kamakura T,Mori M,et al.Prognostic significance of the number of positive lymph nodes in gastric carcinoma[J].Br J Surg,1994,81(3):414-416.
[5] Kitano S,Iso Y,Moriyama M,et al.Laparoscopy-assisted Billroth I gastrectomy[J].Surg Laparosc Endosc,1994,4(2):146-148.
[6] Hallet J,Labidi S,Bouchard-Fortier A,et al.Oncologic specimen from laparoscopic assisted gastrectomy for gastric adenocarcinoma is comparable to D1-open surgery:the experience of a Canadian centre[J].Can J Surg,2013,56(4):245-255.
[7] Hu Y,Huang C,Sun Y,et al.Morbidity and Mortality of Laparoscopic Versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer:A Randomized Controlled Trial[J].J Clin Oncol,2016,34(12):1350-1357.
[8] 田貴,王方平,孫作成.腹腔鏡D2根治術治療進展期胃癌的近期療效分析[J].腹腔鏡外科雜志,2017,22(1):39-41.
[9] Kwon SJ.Evaluation of the 7th UICC TNM Staging System of Gastric Cancer[J].J Gastric Cancer,2011,11(2):78-85.
[10] Chu X,Yang ZF.Impact on survival of the number of lymph nodes resected in patients with lymph node-negative gastric cancer[J].World J Surg Oncol,2015,13:192.
[11] Jiao XG,Deng JY,Zhang RP,et al.Prognostic value of number of examined lymph nodes in patients with node-negative gastric cancer[J].World J Gastroenterol,2014,20(13):3640-3648.
[12] Montgomery LL,Thorne AC,Van Zee KJ,et al.Isosulfan blue dye reactions during sentinel lymph node mapping for breast cancer[J].Anesth Analg,2002,95(2):385-388.
[13] Fiorito S,Serafino A,Andreola F,et al.Toxicity and biocompatibility of carbon nanoparticles[J].J Nanosci Nanotechnol,2006,6(3):591-599.
[14] Yan J,Xue F,Chen H,et al.A multi-center study of using carbon nanoparticles to track lymph node metastasis in T1-2 colorectal cancer[J].Surg Endosc,2014,28(12):3315-3321.
[15] Wu X,Lin Q,Chen G,et al.Sentinel Lymph Node Detection Using Carbon Nanoparticles in Patients with Early Breast Cancer[J].PLoS One,2015,10(8):e0135714.
[16] Xu XF,Gu J.The application of carbon nanoparticles in the lymph node biopsy of cN0 papillary thyroid carcinoma:A randomized controlled clinical trial[J].Asian J Surg,2017,40(5):345-349.
[17] 葛現才,殷德英,辛群,等.納米碳示蹤聯合腹腔鏡技術在結腸癌中的應用價值[J].腹腔鏡外科雜志,2016,21(10):796-798.
[18] Bara T Jr,Gurzu S,Jung I,et al.Single skip metastasis in sentinel lymph node:In an early gastric cancer[J].World J Gastroenterol,2015,21(33):9803-9807.
[19] 陳鴻源,王亞楠,薛芳沁,等.腹腔鏡下靜脈輸液針注射法納米碳淋巴示蹤技術在胃癌根治術中的應用[J].中華胃腸外科雜志,2014,17(5):457-460.

