經頸靜脈肝內門體靜脈分流術治療肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發臨床效果
陳斯良, 胡 朋, 林志鵬, 趙劍波
門靜脈高壓癥主要由各種原因所致肝硬化引起,常見癥狀有胃底食管靜脈曲張、腹水、脾功能亢進等,以食管胃底曲張靜脈破裂上消化道出血最為兇險。脾切除加賁門周圍血管離斷術是治療肝硬化門靜脈高壓癥較廣泛術式之一[1],尤其針對食管胃底曲張靜脈破裂出血伴脾功能亢進患者。但仍有部分患者術后出現反復上消化道出血。經頸靜脈肝內門體靜脈分流術(TIPS)作為一種微創手段逐漸應用于門靜脈高壓及其并發癥治療[2-3],因此也應用于部分肝硬化門靜脈高壓癥經脾切除斷流術后癥狀復發患者。本研究對TIPS治療肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發患者進行遠期隨訪,分析探討TIPS治療臨床效果。
1 材料與方法
1.1 臨床資料
回顧性分析2010年1月至2015年12月在南方醫科大學南方醫院接受TIPS術治療的192例患者臨床資料。其中男147例,女45例;年齡18~79歲,平均(51.7±13.8)歲;術前主要癥狀為食管胃底靜脈曲張破裂出血(168例)及頑固性腹水(24例);術前肝功能Child-Pugh評分為5~12分,平均(7.13±1.52)分,A 級 81例,B 級 93例,C 級 18例;既往行脾切除斷流術48例(A組);既往未行脾切除斷流術144例(B組)。患者納入標準:①A組肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發,如食管胃底靜脈曲張破裂出血和/或頑固性腹水;②年齡≥18周歲;③無心、肺、腎功能重度不全;④無肝癌和其它惡性腫瘤性疾病;⑤無嚴重門靜脈血栓(門靜脈阻塞>50%)和海綿樣變;⑥術前無明顯肝性腦病(HE)等。
1.2 術前準備
術前完善相關實驗室檢查(血常規、肝功能、腎功能、心功能及凝血功能等),影像學檢查明確肝硬化門靜脈高壓診斷。對曲張靜脈破裂出血患者,均給予質子泵抑制劑、生長抑素等藥物抑酸、止血治療,門冬氨酸鳥氨酸預防HE,積極補液、輸血以糾正或預防休克。對頑固性腹水患者,補充人血白蛋白,使用利尿藥,若腹水量較多則腹腔穿刺引流。向患者及家屬交代病情和手術相關事宜,并簽署知情同意書。
1.3 手術過程
手術參照《經頸靜脈肝內門體靜脈分流術臨床技術指南》[4]。主要步驟如下:消毒右頸部并穿刺右頸內靜脈,引入導管測右心房壓力;將RUPS-100 TIPS穿刺系統(美國Cook公司)引入肝靜脈,透視導引下穿刺門靜脈,成功后作直接門靜脈造影并測壓;采用球囊導管(美國Cook公司)擴張肝實質穿刺道,透視下準確釋放Fluency Plus覆膜支架和/或E-luminexx裸支架(美國Bard公司),球囊擴張支架分流道;再次造影并復測右心房及門靜脈主干壓力,若造影顯示有明顯曲張靜脈,經導管予以彈簧鋼圈(美國Cook公司)栓塞處理,對門靜脈血栓則經導管抽栓,術后保留門靜脈導管予尿激酶溶栓,并可直接復查門靜脈造影明確療效。
1.4 術后處理及隨訪
術后3、7 d常規作實驗室檢查。A組患者重點防止支架分流道內血栓形成,術后1周內應用低分子肝素,后續堅持服用華法林6~9個月,將國際標準化比值(INR)控制在1.5~2.5,對凝血功能較差患者可改為口服阿司匹林;B組患者術后不常規應用抗凝藥物,對術前血小板>80×109/L患者行抗血小板治療(氯吡格雷75 mg/d,療程為6個月)。所有患者術后服用乳果糖(15 mL,2~3次/d)、控制蛋白質攝入量以預防HE,同時進行對癥保護肝功能治療。
術后第1、3、6、12個月隨訪,常規作實驗室檢查及彩色超聲檢查,了解患者門靜脈高壓癥狀、肝腎功能及分流道通暢情況等;此后每年隨訪1次,獲取中遠期療效情況;失訪患者以末次復查時間為隨訪終點。對出現支架分流道失功能患者進行介入修正,包括球囊擴張、局部溶栓、支架植入及平行TIPS;對出現HE患者予限制蛋白質攝入量、酸化液灌腸及補充支鏈氨基酸等處理。分流道失功能定義:①門靜脈高壓癥狀復發;②彩色超聲提示支架內血流速度<50 cm/s或無血流信號;③胃鏡提示食管胃底靜脈曲張程度加重;④門靜脈造影提示支架內徑較術前狹窄>50%和/或門靜脈壓力梯度>12 mmHg(1 mmHg=0.133 kPa)。HE 診斷依據第11屆世界胃腸病大會最終報道之定義[5]。本研究中HE患者均有臨床癥狀(West-Haven分級標準≥1級)。
1.5 統計學方法
采用SPSS 20.0軟件進行統計學分析。計量資料用配對及獨立樣本t檢驗,以均數±標準差(±s)表示;計數資料用χ2檢驗,以率和百分比表示;用Cox回歸模型分析影響TIPS術后療效及預后的相關因素,用Log-rank檢驗及Kaplan-Meier生存曲線分析TIPS術前脾切除斷流術對TIPS術后分流道通暢率、HE發生率及生存率的影響。以P<0.05為差異有統計學意義。
2 結果
2.1 TIPS術后患者情況
肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發患者基線資料見表1。TIPS術后192例均成功建立肝內門體分流道,平均門靜脈壓力由術前為(28.0±4.1) mmHg改善為術后(14.8±3.6) mmHg,差異有統計學意義(t=18.24,P<0.01)。 3 例患者術后1周內死亡,其中1例(B組)為急性肝衰竭,2例(A組1例,B組1例)為上消化道再出血;3例患者(A組1例,B組2例)上消化道再出血經內科治療(口服抑制胃酸和止血藥物)后停止;6例患者(A組2例,B組4例)術后1周內出現重度HE(Ⅲ~Ⅳ級),予限制蛋白質攝入、服用乳果糖、清潔灌腸等處理后癥狀減輕或消失;2例患者(B組)術后腹水無減少,補充白蛋白及用利尿劑后腹水明顯減少。

表1 兩組患者基線資料比較
2.2 術后血小板、肝功能變化
患者TIPS術前、術后1~2周、1~3個月、6~12個月、2~3年血小板計數及Child-Pugh評分顯示,術前與術后遠期(2~3年)血小板計數差異無統計學意義(P>0.05),A組與B組間差異有統計學意義(P<0.01);術前與術后近期Child-Pugh評分差異有統計學意義(P<0.05),術后評分較高;術前與術后遠期(2~3年)肝功能評分差異無統計學意義(P>0.05),A組與B組間差異有統計學意義(t=1.922,P=0.035),A 組均優于 B 組(表 2)。
2.3 術后支架分流道通暢情況
TIPS術后隨訪期間患者累積支架分流道狹窄率為 23.4%(45/192),其中 A 組為 27.1%(13/48),B組為22.2%(32/144)(表2)。壽命表法分析顯示,術后1~5年分流道累積通暢率分別為93%、78%、63%、50%、44%。Kaplan-Meier曲線分析顯示,術后A組與B組間累積分流道通暢率差異無統計學意義(χ2=0.985,P=0.317)(圖 1)。 45 例支架分流道狹窄發生于術后 4~62個月,平均(24.3±13.5)個月,原因為支架打褶成角、血栓形成、假性內膜增生;臨床表現為門靜脈高壓癥狀復發(嘔血25例,黑便11例,腹水3例),彩色超聲提示支架內無血流信號(6例);予以TIPS術原位復通27例,平行TIPS術4例,內科治療4例,癥狀緩解或消除;10例搶救無效死亡。27例復通患者中1例出現再次狹窄,次級分流道通暢率為96.3%。
2.4 術后HE發生情況
TIPS術后隨訪期間患者累積HE發生率為32.3%(62/192),其中 A 組為 25.0%(12/48),B 組為 34.7%(50/144)(表 2);輕度 HE(Ⅰ、Ⅱ期)53 例,重度(Ⅲ、Ⅳ期)9例。壽命表法分析顯示術后1~5年累積HE發生率分別為 21%、30%、36%、43%、52%,Kaplan-Meier分析顯示A組術后累積HE發生率顯著低于B 組(χ2=2.898,P=0.041)(圖 2)。 輕度 HE 經內科治療后均明顯緩解,但癥狀仍反復出現,需不定期內科處理;重度HE經內科處理后部分患者癥狀緩解,有2例治療無效死亡。
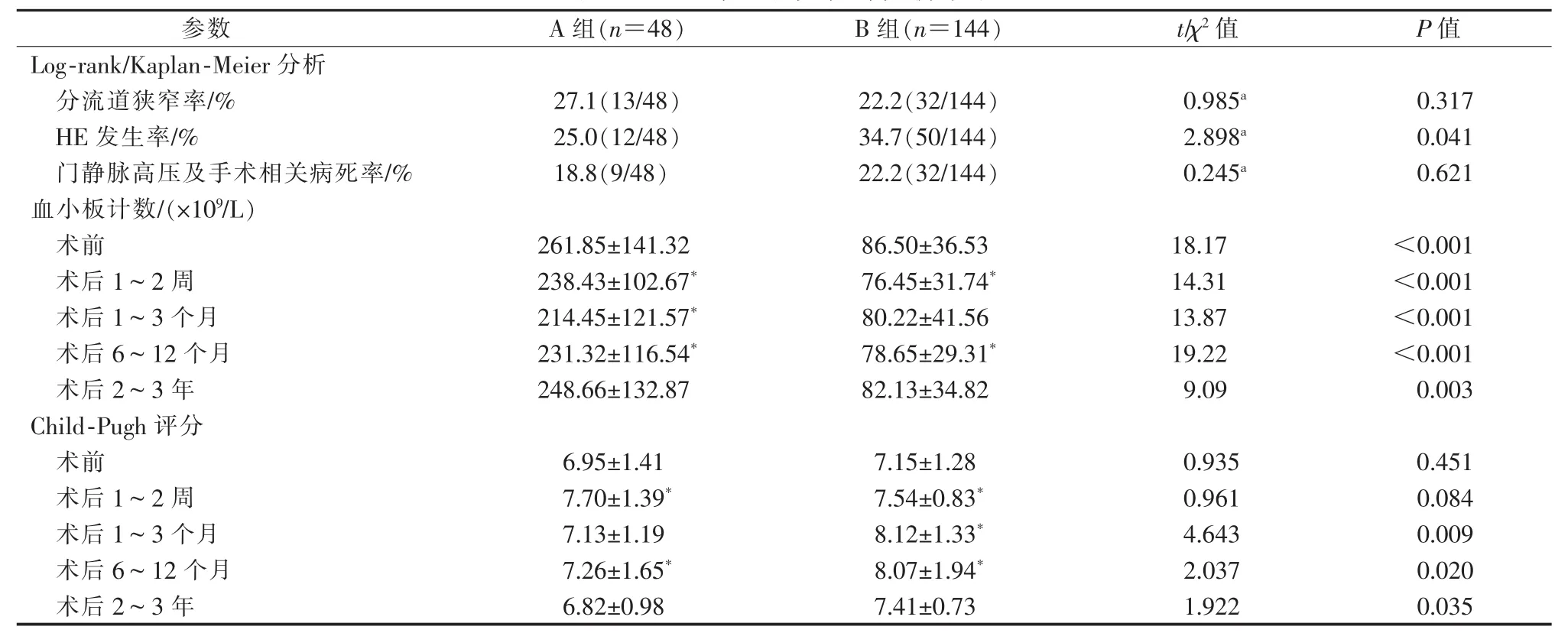
表2 TIPS術后相關統計分析結果
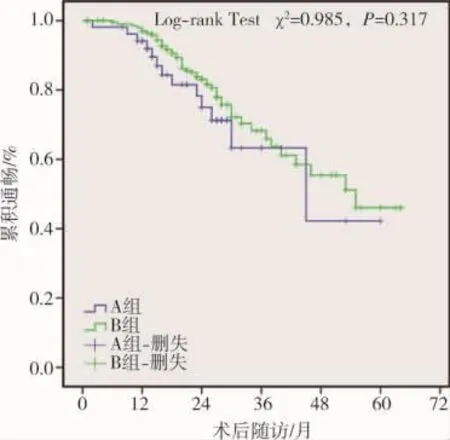
圖1 TIPS術后分流道通暢率
2.5 術后患者生存狀況
TIPS術后隨訪期間累積門靜脈高壓及手術相關病死率為21.4%(41/192),其中A組為18.8%(9/48),B 組為 22.2%(32/144)(表 2);29 例(A 組 4 例,B組25例)死于終末期肝病伴多臟器衰竭,10例(A組5例,B組5例)死于上消化道再出血,2例(B組)死于重度HE;未納入病死率中3例死于心腦血管疾病。壽命表法分析顯示TIPS術后1~5年累積生存率分別為 87%、81%、78%、78%、74%。Kaplan-Meier分析顯示術后A組與B組間總體生存率差異無統計學意義(χ2=0.245,P=0.621)(圖 3)。
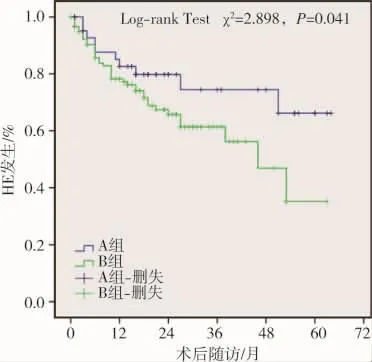
圖2 TIPS術后HE發生率
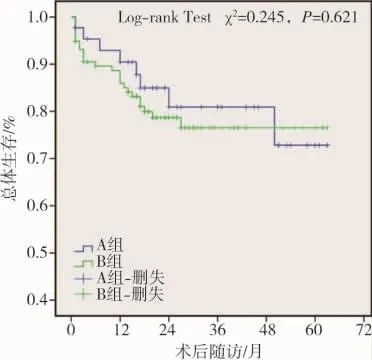
圖3 TIPS術后總體生存率
2.6 影響術后療效及預后的因素
可能影響TIPS術后患者療效和預后的因素見表3。Cox回歸模型分析顯示,門靜脈分流道位置及肝內支架分流道長度是與TIPS術后分流道通暢情況顯著相關因素,術前Child-Pugh評分、HE史及脾切除是術后HE獨立影響因素,術前Child-Pugh評分及血清總膽紅素是與術后生存率顯著相關因素(表 4)。

表3 可能影響TIPS術后患者療效和預后的因素
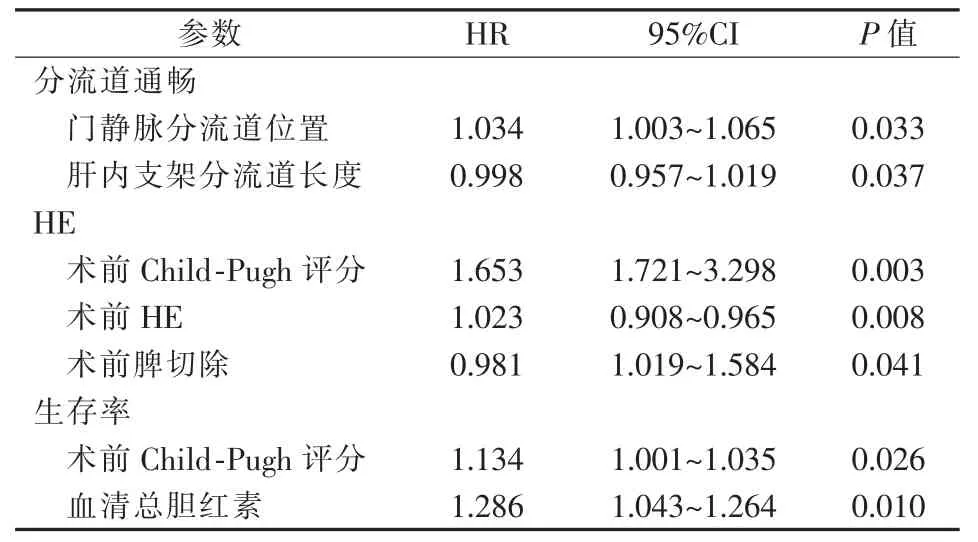
表4 Cox回歸模型分析結果
3 討論
TIPS術可有效控制門靜脈高壓及其并發癥,隨著自膨脹聚四氟乙烯(ePTFE)覆膜支架應用,術后分流道通暢率提高。脾切除斷流術通過減少門靜脈血流降低門靜脈壓力,但隨著肝硬化進展,門靜脈壓力升高,相關癥狀易復發,加上脾切除術后血小板數量增加及門靜脈血流緩慢,易形成門靜脈系統血栓[6],從而增加門靜脈高壓癥狀復發風險,尤其是上消化道大出血。TIPS術治療脾切除斷流術后門靜脈高壓癥狀復發,可降低患者尤其是門靜脈血栓形成患者門靜脈壓力,理論上可取得較好療效。本研究顯示TIPS術后30 d內,A組2例再次出現曲張靜脈破裂出血,其中1例經內科治療后出血停止,1例搶救無效死亡(術前門靜脈主干已有部分血栓形成,出血原因考慮為支架內血栓阻塞所致);頑固性腹水患者癥狀獲不同程度緩解。遠期隨訪中A組患者門靜脈高壓癥狀在分流道支架通暢情況下基本無復發。因此,TIPS術對肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發患者,尤其是曲張靜脈破裂出血患者療效良好[7]。
TIPS術可有效降低門靜脈壓力,但術后門靜脈血分流及術中機械性損傷可使患者肝功能受損,甚至誘發肝衰竭。與內科治療相比,TIPS術后再出血率顯著下降,但遠期生存率并未得到改善[8]。本研究隨訪分析顯示TIPS術后短期內肝功能受損,但隨著時間延長肝功能逐漸改善,相關指標與術前無明顯差異,但遠期肝功能變化仍需更多隨訪數據。本研究A組TIPS術前已脾切除斷流術患者術后遠期肝功能優于未予脾切除斷流術患者,分析原因:①Luca等[9]研究分析216例MELD評分<12分、接受TIPS術治療患者,發現血小板計數為術后早期發生肝衰竭的獨立影響因素之一。Bureau等[10]研究發現血小板計數為頑固性腹水患者生存率的獨立影響因素。因此,血小板計數與TIPS術后肝功能及生存率相關,血小板計數較高對肝功能有利。本研究A組TIPS術前、術后血小板計數均高于B組。②有研究表明脾臟可合成轉化生長因子(TGF)-β1及血小板源性生長因子(PDGF)[11],兩者能活化肝星狀細胞增殖,刺激膠原纖維生成,促進肝纖維化[12]。脾切除術后TGF-β1、PDGF合成減少,可能減輕肝纖維化。但門靜脈高壓患者TIPS治療時能否考慮通過同期部分脾栓塞改善術后肝功能,尚需前瞻性對照研究證實。
本研究顯示TIPS術前脾切除與否,對術后分流道通暢率無明顯影響。脾切除斷流術不能從根本上解除門靜脈高壓,且由于術后血小板減少及門靜脈血流緩慢,部分患者門靜脈易形成血栓或伴海綿樣變。TIPS術增加門靜脈血流速度,可起到沖刷作用,術中可經導管抽栓,術后還可保留門靜脈導管作溶栓,予抗血小板或抗凝藥物降低門靜脈和分流道支架形成血栓風險,提高術后分流道支架通暢率。但本研究A組支架分流道通暢率稍低于B組,且隨時間延長A組通暢率下降趨勢比B組明顯;隨訪發現部分TIPS術前有門靜脈血栓形成的A組患者,即使術后接受抗血小板或抗凝治療仍有新發血栓形成,從而影響支架分流道遠期通暢率。
HE是TIPS術后主要并發癥之一,由于分流道使部分含氨量高、未經肝臟代謝的門靜脈血直接進入體循環,患者術后出現神經、精神等相關癥狀。TIPS術后HE發生率較高,據相關報道為15%~45%[13],還有部分患者處于亞臨床HE狀態。本研究中A組患者術后HE發生率低于B組,分析原因:①脾切除術后門靜脈血流減少,TIPS術后經分流道分流的門靜脈血也相對減少,因此進入體循環的含氨類毒素相對較少;②A組TIPS術后肝功能優于B組,A組對進入肝臟部分的門靜脈血的代謝處理能力明顯占優;③脾切除術后TGF-β1、PDGF合成減少,可減緩肝纖維化進程[11],入肝血流則相對增多。
TIPS術后死亡原因主要為肝衰竭、曲張靜脈破裂出血、HE,以前兩者為著。本研究顯示TIPS術前是否接受脾切除斷流術對術后生存率無顯著影響;術后A組肝功能優于B組,A組出現肝衰竭概率低,但分流道遠期通暢率下降趨勢比B組明顯,相應術后曲張靜脈破裂出血風險更高;A、B組肝衰竭死亡率分別為 44.4%(4/9)、78.1%(25/32), 曲張靜脈破裂出血死亡率分別為 55.6%(5/9)、15.6%(5/32),符合兩組上述肝功能及支架分流道通暢率實際情況,同時一定程度上也予解釋兩組術后生存率無顯著差異,但不能排除受隨訪時間不足的影響。
本研究不足之處:①門靜脈高壓患者TIPS術后分流道通暢率、HE發生率及生存率受多種因素影響;②脾切除斷流術后患者數相對較少;③患者基線數據較少;④TIPS術后部分隨訪數據缺失;⑤隨訪時間相對較短。有待進一步開展更長隨訪時間的隨機對照試驗研究。
綜上所述,TIPS術治療肝硬化門靜脈高壓癥脾切除斷流術后癥狀復發患者臨床效果良好。TIPS術前是否接受脾切除斷流術對術后支架分流道通暢率及生存率無顯著影響,但隨著時間延長,分流道通暢率下降趨勢較明顯。TIPS術前已行脾切除斷流術患者術后HE發生率較低,且有可能獲得較好的遠期肝功能。
[參 考 文 獻]
[1]ZhouJ,WuZ,WuJ,etal.Transjugularintrahepatic portosystemic shunt(TIPS) versus laparoscopic splenectomy(LS)plus preoperati ve endoscopic varices ligation(EVL) in the treatment of recurrent variceal bleeding[J].Surg Endosc, 2013,27:2712-2720.
[2]de Franchis R.Expanding consensus in portal hypertension:report of the baveno vi consensus workshop:stratifying risk and individualizing care for portal hypertension[J].J Hepatol, 2015,63:743-752.
[3]Garcia-Tsao G,Abraldes JG, Berzigotti A, et al.Portal hypertensive bleedingincirrhosis:riskstratification,diagnosis,and management:2016 practice guidance by the American Association for the study of liver diseases[J].Hepatology, 2017, 65: 310-335.
[4]中華放射學雜志編委會介入組.經頸靜脈肝內門體靜脈分流術臨床技術指南[J].中華放射學雜志,2004,38:97-100.
[5]FerenciP,LockwoodA,MullenK,etal.Hepatic encephalopathy: definition, nomenclature, diagnosis,and quantification:final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998[J].Hepatology,2002,35:716-721.
[6]張文祥,謝強強,呂婷婷,等.肝硬化脾切除術后門靜脈系統血栓形成的研究進展[J].中國臨床新醫學,2017,10:90-93.
[7]王崇寶,劉亞民.TIPS在脾切除治療門靜脈高壓癥后反復出血病例中的臨床應用[J].中國普外基礎與臨床雜志,2013,20:37-38.
[8]Holster IL, Tjwa ET, Moelker A, et al.Covered transjugular intrahepatic portosystemic shunt versus endoscopic therapy+beta-blocker for prevention of variceal rebleeding[J].Hepatology,2016,63:581-589.
[9]Luca A,Miraglia R,Maruzzelli L,et al.Early liver failure after transjugular intrahepatic portosystemic shunt in patients with cirrhosis with Model for End-Stage Liver Disease score of 12 or less: incidence, outcome, and prognostic factors[J].Radiology,2016,280: 622-629.
[10]Bureau C, Metivier S, D'Amico M, et al.Serum bilirubin and platelet count:a simple predictive model for survival in patients with refractory ascites treated by TIPS[J].J Hepatol, 2011, 54:901-907.
[11]Akahoshi T,Hashizume M,Tanoue K,et al.Role of the spleen in liver fibrosis in rats may be mediated by transforming growth factor beta-1[J].J Gastroenterol Hepatol, 2002, 17: 59-65.
[12] Yoshida S, Ikenaga N, Liu SB, et al.Extrahepatic plateletderived growth factor-beta, delivered by platelets, promotes activation of hepatic stellate cells and biliary fibrosis in mice[J].Gastroenterology, 2014, 147: 1378-1392.
[13] Riggio O, Angeloni S, Salvatori FM, et al.Incidence, natural history,andriskfactorsofhepaticencephalopathyaftertransjugular intrahepatic portosystemic shunt with polytetrafluoroethylenecovered stent grafts[J].Am J Gastroenterol, 2008, 103: 2738-2746.

