骨碎補(bǔ)乙醇提取物對(duì)大鼠骨髓內(nèi)皮祖細(xì)胞增殖的影響及機(jī)制
劉國(guó)巖,郝延科,李國(guó)弼,徐展望,徐琬梨
(1山東中醫(yī)藥大學(xué)附屬醫(yī)院,濟(jì)南250014;2山東中醫(yī)藥大學(xué))
傳統(tǒng)中藥骨碎補(bǔ)在促進(jìn)骨折愈合及治療骨質(zhì)疏松癥的臨床應(yīng)用中取得了很好的療效。目前,骨碎補(bǔ)療效機(jī)制的實(shí)驗(yàn)研究多集中于促成骨方面。血液供應(yīng)是骨折愈合和成骨基礎(chǔ),內(nèi)皮祖細(xì)胞(EPCs)具有促進(jìn)血管修復(fù)及內(nèi)皮再生的功能;而基質(zhì)細(xì)胞衍生因子-1(SDF-1)是造血干細(xì)胞動(dòng)員和歸巢的關(guān)鍵因子,在細(xì)胞遷移、增殖、動(dòng)員及血管形成等過(guò)程中起重要的作用。2016年9月~2017年7月,我們采用不同濃度骨碎補(bǔ)乙醇提取液培養(yǎng)大鼠EPCs,觀(guān)察其對(duì)EPCs增殖及SDF-1表達(dá)的影響,從血管新生角度探討骨碎補(bǔ)促進(jìn)骨折愈合及治療骨質(zhì)疏松癥的作用機(jī)制。
1 材料與方法
1.1 材料
6周齡SD大鼠40只,雌雄不限,體質(zhì)量(180±20)g,購(gòu)于山東大學(xué)實(shí)驗(yàn)動(dòng)物中心。胎牛血清、DMEM培養(yǎng)基(美國(guó)Invitrogen公司),EGM-2 MV Bulletkit培養(yǎng)基(LONZA),小鼠單克隆抗體VEGFR-2、兔抗大鼠一抗CD34、CD133抗體(Abcam),F(xiàn)icoll淋巴細(xì)胞分離液(上海麥倉(cāng)生物科技有限公司),噻唑藍(lán)(MTT,美國(guó)Novus公司),中藥骨碎補(bǔ)(山東中醫(yī)藥大學(xué)附屬醫(yī)院中藥房提供),胰蛋白酶及L-谷氨酰胺(Sigma)。倒置相差顯微鏡(日本Olympus公司),熒光顯微鏡(美國(guó)Nikon公司),圖像分析系統(tǒng)(美國(guó)Image-Pro Plus),低溫高速離心機(jī)(Sigma,美國(guó)),CO2細(xì)胞培養(yǎng)孵箱(美國(guó)Forma公司)。
1.2 骨碎補(bǔ)乙醇提取物的制備
將中藥骨碎補(bǔ)600 g加入6 kg 75%乙醇中,回流提取2次,每次2 h。將2次提取液合并,減壓回收乙醇,提取液濃縮至300 mL,骨碎補(bǔ)含量相當(dāng)于2 g/mL,4 ℃保存。使用前在標(biāo)準(zhǔn)培養(yǎng)液中加入骨碎補(bǔ)乙醇提取物,分別配制成終濃度20、2、0.2 mg/mL的培養(yǎng)液。
1.3 大鼠EPCs的分離、培養(yǎng)與鑒定
向大鼠腹腔注射3%戊巴比妥鈉處死,用75%乙醇浸泡30 min。無(wú)菌條件下分離雙側(cè)股骨并剔凈肌肉及軟組織,剪去骺端,DMEM培養(yǎng)液沖洗骨髓腔,收集沖洗液。加入淋巴細(xì)胞分離液,離心,收集細(xì)胞。加入EGM-2 MV Bulletkit培養(yǎng)基,重懸后接種包被纖維連接蛋白的培養(yǎng)瓶中,放置于5% CO2、飽和濕度條件的37 ℃孵箱培養(yǎng)。將原代貼壁細(xì)胞經(jīng)體外誘導(dǎo)分化培養(yǎng)2周后的EPCs進(jìn)行雙熒光染色鑒定,以2.5 g/L胰酶+0.1 g/L EDTA消化傳代至24孔板中,待細(xì)胞貼壁完全后,先后與CD133及FLK-1進(jìn)行孵育1 h,在倒置熒光顯微鏡下觀(guān)察。雙熒光染色結(jié)果顯示,EPCs呈CD133及FLK-1雙陽(yáng)性表達(dá)。
1.4 細(xì)胞分組與處理
取傳代細(xì)胞,將細(xì)胞分為5組:①標(biāo)準(zhǔn)培養(yǎng)基組:加入標(biāo)準(zhǔn)培養(yǎng)液EGM-2 MV Bulletkit,含15%胎牛血清、VEGF 10 mg/L、青霉素100 μg/mL、鏈霉素100 μg/mL;②條件培養(yǎng)基組:標(biāo)準(zhǔn)培養(yǎng)液中加入地塞米松10-8mol/L、β-甘油磷酸鈉10 mmol/L、VitC 50 μg/mL;③骨碎補(bǔ)高劑量組:標(biāo)準(zhǔn)培養(yǎng)液中加入20 mg/mL骨碎補(bǔ)乙醇提取液;④骨碎補(bǔ)中劑量組:標(biāo)準(zhǔn)培養(yǎng)液中加入2 mg/mL骨碎補(bǔ)乙醇提取液;⑤骨碎補(bǔ)低劑量組:標(biāo)準(zhǔn)培養(yǎng)液中加入0.2 g/mL骨碎補(bǔ)乙醇提取液。置37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)。
1.5 細(xì)胞形態(tài)觀(guān)察
倒置相差顯微鏡下,每日觀(guān)察EPCs生長(zhǎng)、增殖及形態(tài)特征的變化并拍照。
1.6 細(xì)胞增殖能力觀(guān)察
采用MTT法。向細(xì)胞中加入0.25%胰酶消化,體外增殖EPCs并計(jì)數(shù),按200 μL/孔均勻接種到包被有明膠的96孔培養(yǎng)板,按1.4方法分組培養(yǎng),待細(xì)胞貼壁后,分別于第1、3、5、7天每孔加10 μL MTT(5 mg/mL),37 ℃、5% CO2培養(yǎng)箱繼續(xù)培養(yǎng)4 h。棄上清液,加入二甲基亞砜,于微量振蕩器充分振蕩10 min,待結(jié)晶物充分溶解后,置酶標(biāo)儀于波長(zhǎng)490 nm處測(cè)OD值。
1.7 細(xì)胞SDF-1 mRNA表達(dá)檢測(cè)
采用RT-PCR方法。將分組培養(yǎng)7 d后的細(xì)胞移去培養(yǎng)液,提取各組細(xì)胞總RNA,測(cè)定RNA濃度。根據(jù)Genbank檢索大鼠SDF-1基因編碼號(hào)NM_0010338277-96,347-370,片段長(zhǎng)度249 bp。SDF-1上游引物5-ACGCCATGGACGCCAAGGTC-3′,下游引物5′-ACACCTCTCACATCTTGAGCCTCT-3′,擴(kuò)增產(chǎn)物417 bp;β-actin上游引物5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物5′-TAAAGACCTCTATGCCAACACAGT-3′;擴(kuò)增產(chǎn)物838 bp。擴(kuò)增條件:94 ℃ 5 min,94 ℃ 45 s,56 ℃ 45 s,72 ℃ 45 s,35個(gè)循環(huán);72 ℃延伸5 min。用凝膠圖像分析系統(tǒng)分析結(jié)果,以SDF-1條帶與β-actin條帶灰度值的比值計(jì)算目的基因相對(duì)表達(dá)量。
1.8 統(tǒng)計(jì)學(xué)方法
2 結(jié)果
2.1 EPCs形態(tài)觀(guān)察
各組原代分離出的單個(gè)核細(xì)胞呈體積較小的圓形,加入EGM-2 Bulletkit培養(yǎng)基后第2天細(xì)胞開(kāi)始貼壁,呈類(lèi)似于梭狀形態(tài)的紡錘形,從第6天開(kāi)始呈放射狀向外周生長(zhǎng),第10天時(shí)呈微血管樣生長(zhǎng)。
2.2 各組細(xì)胞增殖能力比較
見(jiàn)表1。第1、3、5、7天標(biāo)準(zhǔn)培養(yǎng)基組、條件培養(yǎng)基組細(xì)胞OD值無(wú)統(tǒng)計(jì)學(xué)差異,骨碎補(bǔ)高、中、低劑量組OD值均高于標(biāo)準(zhǔn)培養(yǎng)基組和條件培養(yǎng)基組(P均<0.05),骨碎補(bǔ)高、中、低劑量組之間OD值無(wú)統(tǒng)計(jì)學(xué)差異。
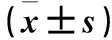
表1 各組細(xì)胞增殖能力比較
注:與標(biāo)準(zhǔn)培養(yǎng)基組、條件培養(yǎng)基組比較,*P<0.05,△P<0.01。
2.3 各組SDF-1 mRNA表達(dá)比較
標(biāo)準(zhǔn)培養(yǎng)基組、條件培養(yǎng)基組及骨碎補(bǔ)高、中、低劑量組SDF-1 mRNA相對(duì)表達(dá)量分別為1.010±0.029、1.088±0.028、1.154±0.021、1.389±0.019、1.125±0.031。標(biāo)準(zhǔn)培養(yǎng)基組、條件培養(yǎng)基組SDF-1 mRNA表達(dá)量低于骨碎補(bǔ)各劑量組(P均<0.01),骨碎補(bǔ)中劑量組高于高、低劑量組(P均<0.05)。
3 討論
中藥骨碎補(bǔ)為骨傷科常用藥物,具有補(bǔ)腎強(qiáng)骨、續(xù)傷止痛的作用。近年研究[1]顯示,骨碎補(bǔ)能夠通過(guò)促進(jìn)Ⅰ型膠原及核心結(jié)合因子α1(Cbfα1)的表達(dá),促進(jìn)骨折愈合及防治原發(fā)性骨質(zhì)疏松癥。局部微血管生成是骨愈合的基礎(chǔ),特別是組織再生能力較差時(shí)或存在大范圍骨缺損,通過(guò)促進(jìn)血管形成來(lái)提高骨組織的再生與修復(fù)能力是非常重要的。目前,對(duì)于單味中藥骨碎補(bǔ)的實(shí)驗(yàn)研究多聚集于促成骨方面,而關(guān)于調(diào)控相關(guān)促血管新生因子促進(jìn)新生血管生成的研究較少。
血管EPCs是血管內(nèi)皮細(xì)胞的前體細(xì)胞,具有游走性、自我更新及增殖分化的生物學(xué)特性,具有促進(jìn)血管修復(fù)及內(nèi)皮再生的功能,可以發(fā)育和分化為外周血細(xì)胞和血管壁細(xì)胞;同時(shí)具有特異性歸巢的能力,以及增殖、分化、促進(jìn)組織中新生血管形成的能力[2~4]。目前研究[5,6]已表明,激素、細(xì)胞因子、生長(zhǎng)因子、促炎因子均可以動(dòng)員調(diào)控血管EPCs增殖和遷移能力,增加新血管生成。當(dāng)組織缺血時(shí),血管EPCs和細(xì)胞因子均動(dòng)員至缺損區(qū)域,繼而分化成為成熟的血管內(nèi)皮細(xì)胞,參與新生血管的形成[7,8]。Matsumoto等[9]分離培養(yǎng)外周血中的EPCs進(jìn)行骨缺損修復(fù),發(fā)現(xiàn)其可促進(jìn)血管形成和骨形成,從而增強(qiáng)骨修復(fù)作用,使得EPCs在骨修復(fù)過(guò)程中的重要性得到證實(shí)。Yu等[10]研究發(fā)現(xiàn),復(fù)合了EPCs的組織工程骨可通過(guò)有效的血管化促進(jìn)成骨,同時(shí)防止骨壞死的發(fā)生。如何提高外周血循環(huán)中EPCs的數(shù)量及提高損傷處EPCs的濃度,成為最新研究熱點(diǎn)。
SDF-1是造血干細(xì)胞動(dòng)員和歸巢的關(guān)鍵因子,在細(xì)胞遷移、增殖、動(dòng)員及血管形成等過(guò)程中起重要作用[11~13]。SDF-1通過(guò)調(diào)節(jié)遲現(xiàn)抗原4表達(dá),介導(dǎo)CD34細(xì)胞的黏附,在CD34細(xì)胞歸巢至骨髓中發(fā)揮關(guān)鍵作用,并由此影響其在骨髓中的增殖和分化,使干細(xì)胞具有遷移歸巢的特性。研究表明,SDF-1呈濃度依賴(lài)性促進(jìn)EPCs增殖,并且顯著增強(qiáng)EPCs的成血管能力。尹揚(yáng)光等[14]利用密度梯度離心法獲取并誘導(dǎo)小鼠骨髓EPCs,加入不同濃度SDF-1共培養(yǎng)48 h后,采用血清饑餓法和紫杉醇誘導(dǎo)EPCs凋亡,流式細(xì)胞儀和TUNEL法檢測(cè)SDF-1對(duì)EPCs凋亡率的影響,發(fā)現(xiàn)SDF-1可以抑制EPCs凋亡。當(dāng)組織發(fā)生損傷后,SDF-1水平上調(diào)并立即從損傷組織中釋放,形成一定的SDF-1濃度梯度,使干細(xì)胞動(dòng)員并遷移到損傷的組織。De Falco等[15]證實(shí),在組織缺氧缺血早期,血漿SDF-1水平明顯升高,提示在組織損傷后局部SDF-1升高動(dòng)員及趨化EPCs開(kāi)始修復(fù)受損組織。康慶林等[16]在大鼠骨髓源性EPCs的培養(yǎng)中,加入不同濃度SDF-1刺激,發(fā)現(xiàn)EPCs的遷移能力呈濃度依賴(lài)性增加,濃度越高作用越明顯,由此提示SDF-1能促進(jìn)骨髓源性EPCs遷移。目前,大多數(shù)學(xué)者傾向于EPCs遷移主要是受趨化因子家族及其受體的操控。
目前,中藥調(diào)控對(duì)EPCs的作用研究主要圍繞其數(shù)量、增殖、遷移和黏附功能。本研究采用中藥骨碎補(bǔ)乙醇提取液培養(yǎng)大鼠EPCs,觀(guān)察其增殖情況及細(xì)胞內(nèi)SDF-1 mRNA表達(dá)水平的變化,探討骨碎補(bǔ)對(duì)SDF-1表達(dá)的影響,從而進(jìn)一步探討骨碎補(bǔ)在促進(jìn)骨愈合過(guò)程中是否具有促進(jìn)新生血管生成作用。結(jié)果發(fā)現(xiàn),不同濃度骨碎補(bǔ)乙醇提取液對(duì)EPCs均有促進(jìn)增殖和促進(jìn)SDF-1表達(dá)的作用,其中2 mg/mL骨碎補(bǔ)乙醇提取液促進(jìn)大鼠EPCs增殖及加強(qiáng)SDF-1表達(dá)作用最顯著。
綜上所述,骨碎補(bǔ)乙醇提取液可以促進(jìn)EPCs增殖,其機(jī)制可能與上調(diào)SDF-1表達(dá)有關(guān)。這為補(bǔ)腎強(qiáng)骨類(lèi)中藥在促進(jìn)骨愈合過(guò)程中具有促進(jìn)新生血管生成作用提供了理論依據(jù)。
參考文獻(xiàn):
[1] 劉國(guó)巖,徐展望,徐琬梨.骨碎補(bǔ)提取物對(duì)骨髓間充質(zhì)干細(xì)胞向成骨細(xì)胞分化及Cbfα1表達(dá)的影響[J].山東醫(yī)藥,2013,53(25):16-18.
[2] Li WD, Li XQ. Endothelial progenitor cells accelerate the resolution of deep vein thrombosis[J]. Vascul Pharmacol, 2015,83:10-16.
[3] Sukmawati D, Tanaka R. Introduction to next generation of endothelial progenitor cell therapy: a promise in vascular medicine[J]. Am J Transl Res, 2015,7(3):411-421.
[4] Lee PS, Poh KK. Endothelial progenitor cells in cardiovascular diseases[J]. World J Stem Cells, 2014,6(3):355-366.
[5] Wojakowski W, Tendera M. Mobilization of bone marrow- derived progenitor cells in acute coronary syndromes[J]. Folia Histochem Cytobiol, 2005,43(4):229-232.
[6] Cignarella A, Fadini GP. Enhancing endothelial progenitor cell function through selective estrogen receptor modulation: a potential approach to cardiovascular risk reduction[J]. Cardiovasc Hematol Agents Med Chem, 2010,8(3):147-155.
[7] Balistreri CR, Buffa S, Pisano C, et al. Are endothelial progenitor cells the real solution for cardiovascular diseases focus on controversies and perspectives[J]. Biomed Res Int, 2015,2015:835934.
[8] Goligorsky MS. Endothelial progenitor cells: from senescence to rejuvenation[J]. Semin Nephrol, 2014,34(4):365-373.
[9] Matsumoto T, Kuroda R, Mifune Y, et al. Circulating endothelial/skeletal progenitor cells for bone regeneration and healing[J]. Bone, 2008,43(3):434-439.
[10] Yu H, Vandevord PJ, Gong W, et al. Promotion of osteogenesis in tissue-engineered bone by pre-seeding endothelial progenitor cells-derived endothelial cells[J]. J Orthop Res, 2008,26(8):1147-1152.
[11] Yamaguchi J, Kusano KF, Masuo O, et al. Stromal cell-derived factor-1 effects on ex vivo expanded endothelial progenitor cell recruitment for ischemic neovascularization[J]. Circulation, 2003,107:1322-1328.
[12] Segal MS, Shah R, Afzal A, et al. Nitric oxide cytoskeletal-induced alterations reverse the endothelial progenitor cell migratory defect associated with diabetes[J]. Diabetes, 2006,55:102-109.
[13] Nakamura Y, Ishikawa H, Kawai K, et al. Enhanced wound healing by topical administration of mesenchymal stem cells transfected with stromal cell-derived factor-1[J]. Biomaterials, 2013,34(37):9393-9400.
[14] 尹揚(yáng)光,黃嵐,趙曉輝,等.SDF-1對(duì)小鼠骨髓源性?xún)?nèi)皮祖細(xì)胞數(shù)量及功能影響[J].心血管康復(fù)醫(yī)學(xué)雜志,2006,15(5):427-430.
[15] De Falco E, Porcelli D, Torella AR, et al. SDF-1 involvementin endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J]. Blood, 2004,104(12):3472-3482.
[16] 康慶林,陸聯(lián)松,陳佳.SDF-1/CXCR4生物軸活化誘導(dǎo)對(duì)鼠骨髓源性?xún)?nèi)皮祖細(xì)胞生物學(xué)性能的影響[J].解剖學(xué)研究,2012,33(6):413-416.

