急性缺血性卒中后肺炎與腦白質疏松癥相關性分析
叢 林 姜海濤 苑 新
阜新市第二人民醫院神經內科,遼寧 阜新 123000
腦卒中相關性肺炎(stroke-associated pneumo-nia,SAP)是腦卒中患者的常見并發癥,急性缺血性腦卒中后SAP發病率為5%~26%[1-2]。SAP是卒中患者不良預后和死亡的重要危險因素,不但導致致殘率和致死率升高[2-3],且顯著延長患者住院時間、增加醫療費用[4]。腦白質疏松癥(leukoaraiosis,LA)是一影像學概念,用于描述腦室周圍或皮質下區(半卵圓中心)CT上的彌漫性低密度帶或MRIT2加權像上的彌漫性高信號區。LA多見于60歲以上的老年人,即使在無癥狀人群中,LA的檢出率亦可分別高達7%~30%和8%~100%[5]。LA主要的病理表現為導致皮質下白質纖維疏松和膠質細胞增生[5],可導致皮質和皮質下白質連接中斷,是卒中后吞咽功能障礙的重要發病機制[6]。大量研究表明,SAP發生的原因可能與卒中期間吞咽困難、意識障礙及免疫功能抑制有關[7]。SAP的發生、發展、轉歸和卒中后機體的功能障礙有密切關系,因此在SAP的預防和治療中需要特別關注患者的危險因素,針對性制定臨床策略。本研究回顧性分析2015-01-01—2017-10-31在阜新市第二人民醫院神經內科發病24 h就診的338例急性缺血性卒中患者的臨床資料,探討急性缺血性卒中后SAP與LA之間的關系。
1 對象與方法
1.1研究對象本項研究共連續納入2015-01-01—2017-10-31在阜新市第二人民醫院神經內科發病24 h就診的338例急性缺血性腦卒中患者,死亡4例。所有患者均經頭部CT或MRI 檢查,確定責任病灶的位置。患者一般資料見表1。
納入標準:(1)患者年齡≥18歲;(2)符合1995 年全國第 4 次腦血管病學術會議急性缺血性腦卒中診斷標準,所有病例均經頭部CT和(或)MRI檢查確診;(3)卒中發生距入組時間24 h內。排除標準:(1)患者24 h內出院或死亡;(2)因大面積梗死致嚴重腦水腫行去骨瓣減壓的卒中患者;(3)近期有慢性細菌感染性基礎疾病(如支氣管擴張、膿腫、皮膚感染、尿路感染等);(4)近期有肺外器官或組織的感染;(5)發病前生活已不能自理。
1.2調查內容由2名醫師負責收集研究對象的人口統計學資料(性別、年齡),入、出院時NIHSS評分,意識水平,個人史(高血壓史、糖尿病、高脂血癥[8]、吸煙史和房顫史)。根據頭部CT或MRI確定責任病灶的位置及是否為腔隙性梗死,將病灶位置分為幕上、幕上,卒中Toast分型,A2DS2評分,是否接受溶栓治療及臨床結局。入院后24 h內行實驗室檢查,包括血白細胞計數和高敏C反應蛋白水平。
1.3評分方法由2名神經內科主治醫師或以上職稱的人員完成吞咽功能、SAP、LA的評估,根據洼田飲水試驗,將吞咽功能障礙分為輕、中、重度。SAP的診斷符合改良的CDC標準[7]:至少符合下列標準中任意1項:(1)無其他明確原因出現發熱 (體溫>38 ℃);(2)白細胞減少 (12 000 個/mm3);(3)年齡≥70歲老人,無其他明確原因出現意識狀態改變并且至少符合下列標準中任意 2 項:①新出現的膿痰,或 24 h 內出現痰液性狀改變或呼吸道分泌物增加或需吸痰次數增加。②新出現或加重的咳嗽或呼吸困難或呼吸急促 (呼吸頻率>25 次/min)。③肺部聽診發現啰音或爆裂音或支氣管呼吸音。④氣體交換障礙 [如低氧血癥 (PaO2/FiO2≤240),需氧量增加],并且≥2次連續胸片至少具有下列表現中任意 1 項:新出現或進展的持續性浸潤性病變、實變或空洞形成。既往無心肺基礎疾病患者,單次胸片具有上述表現中任意 1 項即可。根據患者頭CT或MRI結果采用Fazekas評分法[9]分別對腦室周圍及皮質下區域進行評分,側腦室 周圍及深部白質區LA:0分無病損(包括對稱性、清晰帶帽或條帶狀);1分局灶性病損;2分病損開始連接;3分彌漫累計整個區域,伴或不伴有U形纖維受累。基底節區LA:0分無病損;1分單個局灶性病灶,病灶直徑≥5 mm;2分2個或2個以上局灶性病損:3分病損已連接。評分后將兩部分評分相加,根據評分結果確定LA的嚴重程度,0~2分為輕度LA,3~6分為重度LA[10]。
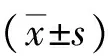
2 結果
338例患者均完成隨訪,無失訪病例,死亡4例。其中確診為SAP患者46例,LA295例。患者的一般情況具體見表1。以SAP為因變量,以表1中P<0.1的變量為自變量,校正年齡、性別及卒中病因學分型后多因素Logistic 回歸分析結果顯示,房顫、基線NIHSS、意識障礙、吞咽功能障礙、A2DS2評分(5~10)及重度LA是急性缺血性腦卒中發生SAP的危險因素。見表2。

表1 患者相關資料分析
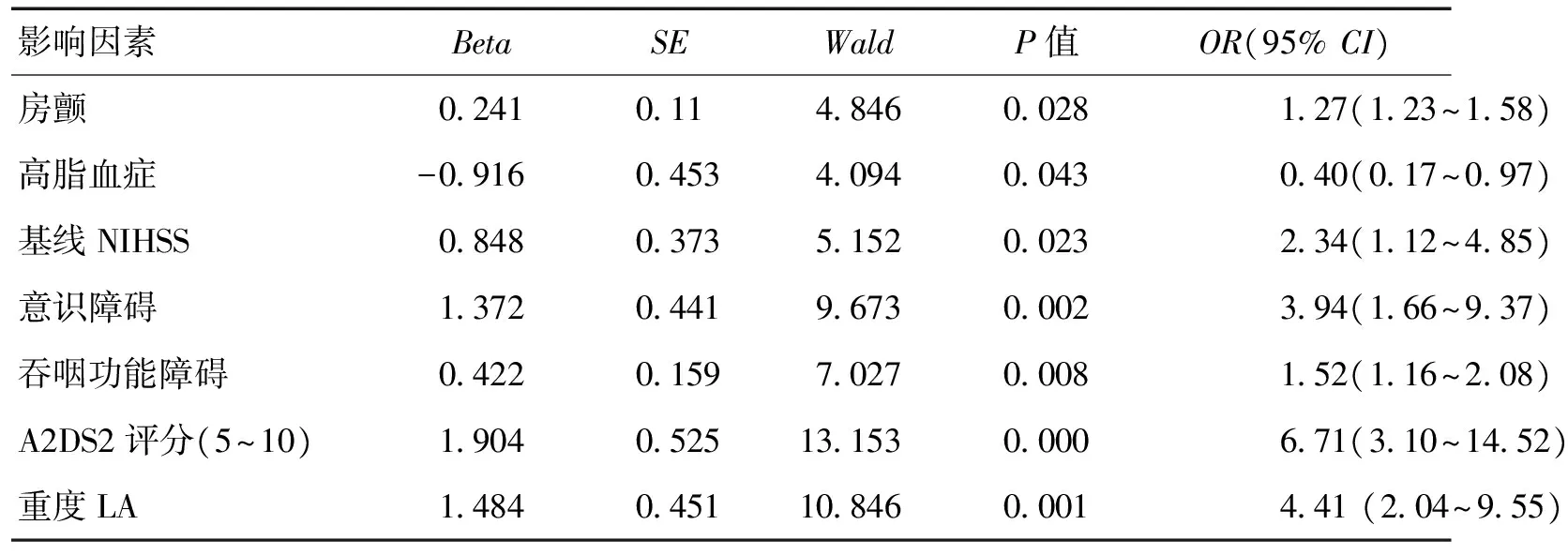
表2 LA與SAP多因素Logistic回歸分析結果
3 討論
腦卒中給全球帶來的沉重疾病負擔中,中國所占比重最高,我國每年新增2 400 000腦卒中患者[11],75%的存活者因腦卒中而遺留有不同程度的殘疾[12]。雖然中國腦卒中(年齡標化)病死率無論城市還是農村地區近年均呈下降趨勢,但腦卒中仍然是我國居民首位死亡原因[13]。卒中后感染是卒中患者最常見的內科并發癥,發生率高達21%,是卒中的主要死亡原因,而SAP占卒中后感染的首位[14]。SAP是指原無肺部感染的卒中患者在急性期所患的感染性肺實質(含肺泡壁即廣義上的肺間質)炎癥[15],多出現于卒中發病后1周之內,尤其是發病后3 d左右。卒中并發SAP的臨床常見危險因素[1-2,16-17]包括:老年、男性、吸煙史、糖尿病、高血壓、心房顫動、充血性心力衰竭、慢性阻塞性肺疾病、吞咽困難、喂養方式、機械通氣、應用抑酸藥物、預防性應用抗生素、卒中類型、部位和嚴重程度等。基于上述危險因素,國內外學者通過研究分析提出了多項SAP風險評估工具,但各個評估量表的敏感性和特異性均有待于臨床進一步驗證。A2DS2評分量表系由HOFFMANN等[18]于2012年基于德國15 335例缺血性卒中病例研究后制定以評估SAP風險,A2DS2評分量表總分為10分。SAP發生率隨著A2DS2評分增加顯著上升,A2DS2評分為0分時SAP的發生率為0.3%,而A2DS2評分為10分時SAP的發生率高達39.4%。李琳等[18-19]研究證實了A2DS2評分可為缺血性卒中SAP危險分層提供依據。最新的研究證實,A2DS2評分量表評估SAP風險敏感性最高[20-21],是我國急性缺血性腦卒中患者SAP和院內死亡的強有力預測因子[22-23]。本項研究中共納入33例急性缺血性腦卒中患者,發生SAP46例,發生率為13.6%,統計學分析結果顯示A2DS2評分(5~10分)是SAP的危險因素,這與以前類似的研究結果相一致[1-2,18]。
LA也稱腦白質改變或年齡相關性白質改變(ARWMC),是由加拿大神經病學家HAEHINSKI等在1987年提出的一個影像診斷學術語,可由皮質下動脈硬化性腦病、血管性癡呆等各種腦血管疾病、阿爾茨海默病、一氧化碳中毒等多種疾病引起,也可見于正常老年人。大量研究表明,LA 和腦血管病的危險因素相互重疊,年齡和高血壓是最重要的危險因素,年齡與LA 的相關性最為密切,幾乎所有研究均認為年齡是LA 的唯一獨立相關因素[24-25]。研究結果[26-27]顯示,LA的患病率隨著年齡的增長而增加,44~48歲占50.9%,60~90歲健康人群LA的患病率為95%。LA可增加癡呆、卒中、腦萎縮、步態異常、尿失禁的風險[28-29],導致殘疾,卒中的進展性加重,生活質量下降和醫療費用的增加[30]。LA 與卒中有關,并且獨立于其他卒中危險因素,LA最常見的卒中類型為腔隙性梗死,LA 患者的皮質梗死和血管性死亡風險也增高[31]。高血壓、血壓變異性與腦白質疏松癥是缺血性卒中后早期不良事件和預后不良的危險因素,但研究表明,血壓變異性不是LA患者急性缺血性腦卒中后的不良預后之間的潛在機制[32]。
本研究中,我們采用Fazekas評分法對患者腦室周圍和皮質下區(半卵圓中心)分別進行評分,本項研究結果顯示LA的嚴重程度與SAP密切相關,重度LA是SAP的獨立危險因素。其原因可能與以下因素有關:(1)卒中患者通常伴有不同程度的意識障礙和吞咽功能障礙,兩者是導致誤吸的重要因素[1-2,18]。流行病學資料[33]顯示,30%~65% 的卒中患者在入院時即出現吞咽功能障礙,43%~54% 有吞咽功能障礙的患者會出現誤吸,其中,37% 的患者進一步發展為肺炎,4%因肺炎而死亡。LA是急性卒中后吞咽功能障礙的獨立危險因素[5],重度LA患者更易罹患吞咽功能障礙[34],其原因可能與LA引起的白質區與腦干吞咽中樞聯系中斷導致假性球麻痹有關[35-36]。(2)LA可減少在舌咽神經節和頸副交感神經節血清P 物質的生成及多巴胺的產生,抑制咽、喉和氣管上皮的咳嗽反射,導致誤吸[37]。(3)重度LA可引起認知功能障礙及意識障礙,增加患者誤吸的風險,在SAP的發病機制中起著重要的作用。
本研究顯示,SAP與患者的不良結局相關,無卒中后肺炎組患者相比,有卒中后肺炎組患者臨床結局更差,住院時間更長、病死率更高、出院時神經功能損害程度更嚴重、氣管插管率更高。這一結果與之前的研究結果相一致[2-3]。
本研究的局限性:(1)本項研究是一項單中心研究,不同的醫療機構SAP的治療方式或預防策略不同。(2)我們沒有測量患者的梗死面積,如其他研究所示這可能對SAP很重要[2,18]。(3)在本項研究中未考慮患者卒中前的功能狀態(如改良Rankin評分,認知狀態)。(4)研究中未能根據影像學資料確定SAP的類型和性質。
4 結論
重癥LA是急性缺血性卒中SAP的獨立危險因素,在臨床工作中不僅需要特別關注患者的危險因素,針對性制定臨床策略,而且還需通過進一步的深入研究,改善卒中患者的結局和預后,提高患者的生活質量。
[1] CHUMBLER N R,WILLIAMS L S,WELLS C K,et al.Derivation and validation of a clinical system for predicting pneumonia in acute stroke[J].Neuroepidemiology,2010,4(4):1 993-1 992.
[2] FINLAYSON O,KAPRAL M,HALL R,et al.Risk factors,inpatient care,and outcomes of pneumonia after ischemic stroke[J].Neurology,2011,77 (14):1 338-1 345.
[3] SMITH C J,BRAY B D,HOFFMAN A,et al.Can a novel clinical risk score improve pneumonia prediction in acute stroke care? A UK multicenter cohort study[J].J Am Heart Assoc,2015,4(1):e001307.
[4] ALI A N,HOWE J,MAJID A,et al.The economic cost of stroke-associated pneumonia in a UK setting[J].Top Stroke Rehabil,2017,4:1-10.
[5] MERINO J G,HACHINSKI V.Leukoaraiosis:reifying rarefaction[J].Arch Neurol,2000,57(7):925-926.
[6] TOSCANO M,CECCONI E,CAPILUPPI E,et al.Neuroanatomi-cal,Clinical and Cognitive Correlates of Post-Stroke Dysphagia [J].Eur Neurol,2015,74(3-4):171-177.
[7] SMITH C J,KISHORE A K,VAIL A,et al.Diagnosis of Stroke-Associated Pneumonia:Recommendations From the Pneumonia in Stroke Consensus Group[J].Stroke,2015,46(8):2 335-2 340.
[8] JEONG H G,KIM B J,YANG M H,et al.Neuroimaging markers for early neurologic deterioration in single small subcortical infarction[J].Stroke,2015,46(3):687-691.
[9] FAZEKAS F,BARKHOF F,WAHLUND L,et al.CT and MRI rating of white matter lesions[J].Cerebrovasc Dis,2002,13(Suppl 2):31-36.
[10] HELENIUS J,GODDEAU Jr R P,MOONIS M,et al.Impact of leukoaraiosis burden on hemispheric lateralization of the National Institutes of Health Stroke Scale deficit in acute ischemic stroke[J].Stroke,2016,47(1):24-30.
[11] WANG W,JIANG B,SUN H,et al.Prevalence,incidence,and mortality of stroke in China:results from a nationwide population-based survey of 480 687 Adults[J].Circulation,2017,135(8):759-771.
[12] SUN J,GUO Y,WANG X,et al.mHealth for Aging China:opportunities and challenges[J].Aging Dis,2016,7(1):53-67.
[13] WANG W,WANG D,LIU H,et al.Trend of declin ing stroke mortality In China:reasons and analysis[J].Stroke Vasc Neurol,2017,2(3):132-139.
[14] URRA X,LAREDO C,ZHAO Y,et al.Neuroanato-mical correlates of stroke-associated infection and stroke-induced immunodepression[J].Brain Behav Immun,2017,60:142-150.
[15] 卒中相關性肺炎診治中國專家共識組.卒中相關性肺炎診治中國專家共識[J].中華內科雜志,2010,49:1 075-1 078.
[16] MASRUR S,SMITH E E,SAVER J L,et al.Dyspha-gia screening and hospital-acquired pneumonia in patients with acute ischemic stroke:findings from Get with the Guidelines-Stroke[J].J Stroke Cerebrovasc Dis,2013,22(8):e301-309.
[17] TITSWORTH W L,ABRAM J,FULLERTON A,et al.Prospective quality initiative to maximize dysphagia screening reduces hospital-acquired pneumonia prevalence in patients with stroke[J].Stroke,2013,44(11):3 154-3 460.
[18] HOFFMANN S,MALZAHN U,HARMS H,et al.Development of a clinical score (A2DS2) to predict pneumonia in acute ischemic stroke[J].Stroke,2012,43(10):2 617-2 623.
[19] 李琳,張臨洪,徐武平.缺血性卒中相關性肺炎風險評估[J].中華急診醫學雜志,2014,23:684-687.
[20] TU T M,PHUA S S,ACHARYYA S,et al.Predicting Pneumonia in Acute Ischaemic Stroke:Comparison of Five Prediction ScoringModels[J].Ann Acad Med Singapore,2017,46(6):237-244.
[21] ZAPATA-ARRIAZA E,MONICHE F,BLANCA P G,et al.External Validation of the ISAN,A2DS2,and AIS-APS Scores for Predicting Stroke-Associated Pneumonia[J].J Stroke Cerebrovasc Dis,2017,pii:S1052-3057 (17) 30544-X.
[22] LI Y,SONG B,FANG H,et al.External validation of the A2DS2 score to predict stroke-associated pneumonia in a Chinese population:a prospective cohort study[J].PLoS One,2014,9(10):e109 665
[23] ZHANG X,YU S,WEI L,et al.The A2DS2 Score as a Predictor of Pneumonia and In-Hospital Death after Acute Ischemic Stroke in Chinese Populations[J].PLoS One,2016,11(3):e0 150 298.
[24] LIN Q,HUANG W Q,MA Q L,et al.Incidence and risk factors of leukoaraiosis from 4683 hospitalized patie-nts:A cross-sectional study[J].Medicine (Baltimore),2017,96(39):e7 682.
[25] ONTEDDU S R,GODDEAU R P Jr,MINAEIAN A,et al.Clinical impact of leukoaraiosis burden and chronological age on neurological deficit recovery and 90-day outcome after minor ischemic stroke[J].J Neurol Sci,2015,359(1-2):418-423.
[26] XIONG Y Y,MOK V.Age-related white matter changes[J].J Aging Res,2011,2011:617 927.
[27] WEN W,SACHDEV P S,LI J J,et al.White matter hyperintensities in the forties:their prevalence and topography in an epidemiological sample aged 44-48[J].Human Brain Mapp,2009,30:1 155-1 167.
[28] LAMBERT C,BENJAMIN P,ZEESTRATEN E,et al.Longitudi-nal patterns of leukoaraiosis and brain atrophy in sym-ptomatic small vessel disease[J].Brain 2016,139(pt 4):1 136-1 151.
[29] BAEZNER H,BLAHAK C,POGGESI A,et al.Association of gait and balance disorders with age-related white matter changes:the LADIS study[J].Neurology,2008,70:935-942.
[30] RYU W S,WOO S H,SCHELLINGERHOUT D,et al.Stroke outcomes are worse with larger leukoaraiosis volumes[J].Brain,2017,140(pt 1):158-170.
[31] BAIK M,KIM K,YOO J,et al.Differential impact of white matter hyper intensities on long-term outcomes in ischemic strokepatients with large artery atherosclerosis[J].PLoS One,2017,12(12):e0 189 611.
[32] DICKIE D A,ARIBISALA B,MAIR G,et al.Blood pressure variability and leukoaraiosis in acute ischemic stroke[J].Int J Stroke,2017,1747493017729267.
[33] 衛生部疾病預防控制局,中華醫學會神經病學分會. 中國腦血管病防治指南[M]. 北京:人民衛生出版社,2007:98.
[34] LEVINE R,ROBBINS J A,MASER A.Periventricular white matter changes and oropharyngeal swallowing in normal individuals[J].Dysphagia,1992,7(3):142-147.
[35] PROSIEGEL M.Neurology of Swallowing and Dysphagia.In:Ekberg O,editor.Dysphagia:Diagnosis and Treatment[J].Berlin Heidelberg:Springer-Verlag,2012:83-106.
[36] NAM K W,KWON H M,LIM J S,et al.Leukoaraiosis is associated with pne umoni a after acute ischemic stroke[J].BMC Neurol,2017,17(1):51.
[37] TERAMOTO S.Novel preventive and therapeutic strategy for post-stroke pneumonia[J].Expert Rev Neurother,2009,9(8):1 187-1 200.

