阿托伐他汀對局灶性腦缺血大鼠MMP-2 occludin mRNA的影響
楊會杰 張 娟 夏 昱 孫 環 孟祥光
1)鄭州市第七人民醫院,河南 鄭州 450000 2)河南省人民醫院,河南 鄭州 450000
急性缺血性腦卒中(acute ischemic stroke,AIS)是神經科常見病,占腦卒中總發病率80%左右,常常導致患者偏癱、失語、認知功能障礙、精神障礙等嚴重不良事件,因此盡早開通閉塞血管、恢復血流是治療的關鍵。溶栓是首選治療,但臨床中真正受益者不足3%[1]。絕大多數患者發展成局灶性腦缺血,不僅造成神經細胞壞死、凋亡、自噬,而且使血腦屏障(blood-brain barrier,BBB)破壞,進而導致腦水腫、顱內壓增高、炎癥介質滲出,甚至腦出血,加重腦組織損傷。IgG是血清中一種免疫球蛋白,腦脊液中含量極微,因分子量大無法通過正常BBB,一旦BBB破壞,IgG等一些大分子物質可順利通過,故通過測IgG滲出量可反應BBB破壞程度[2]。目前研究證實,BBB破壞與MMP-2、occludin等分子變化密切相關,但尚不清楚阿托伐他汀在AIS中是否可通過影響MMP-2、occludin mRNA等分子結構保護BBB。鑒于此,本實驗通過建立局灶性腦缺血模型,觀察IgG、MMP-2、occludin mRNA的動態變化,并探討阿托伐他汀對其的影響。
1 材料與方法
1.1主要材料與試劑雄性SD大鼠108只,體質量(300±20)g,購自河南省實驗動物中心(合格證:SCXK(豫)2010-0002);阿托伐他汀鈣片(輝瑞制藥有限公司,許可證號:H20051407);OD 值測量儀器(Merinton SMA4000);羊抗兔IgG抗體(美國Santacruz公司);RT-PCR試劑盒(北京Transgene公司)等。
1.2方法
1.2.1 分組:將大鼠隨機分為3組,即假手術組、模型組、治療組,每組36只,各組設3個觀察時間點:1 d、3 d、7 d,各個時間點12只。
1.2.2 大腦中動脈閉塞模型制備:實驗前6 h禁食、2 h禁水。參照樂婷等[3]的線栓法制備左側大腦中動脈閉塞法(middle cerebral artery occlusion,MCAO)模型,清醒后按Longa 5分[4]進行評分,1~3分為成功模型。假手術組只分離,不結扎,不插線。
1.2.3 給藥:術后3 h,治療組給予阿托伐他汀4 mg/(kg·d)灌胃(阿托伐他汀用5 mL生理鹽水溶解),持續給藥到相應觀察時間點;假手術組和模型組在相應時間點給予等量生理鹽水灌胃。
1.2.4 標本采集及保存:每組大鼠在相應時間點處死。隨機取6只經心臟灌注40 g/L多聚甲醛后取腦,固定24 h后石蠟包埋保存,用于免疫組化檢測;其余6只斷頭取腦,液氮迅速冷凍后移于-80 ℃冰箱保存,用于RT-PCR法檢測。
1.3檢測指標
1.3.1 免疫組織化染色方法測IgG、MMP-2的表達:大鼠腦組織石蠟切片5 μm,二甲苯脫蠟,梯度乙醇水化,PBS沖洗3次,高壓抗原修復5 min,自然冷卻,PBS沖洗3次,滴加一抗50 μL,室溫下孵育1 h;PBS沖洗3次,滴加二抗50 μL室溫孵育15 min,用PBS沖洗3次,加DBA顯色,蘇木素復染,脫水,透明及封片。100倍鏡下觀察,400倍鏡下計數陽性細胞數,采用Image Pro Plus 6.0(IPP)圖像處理系統進行分析,測定平均光密度值(IOD)。
1.3.2 RT-PCR檢測occludin mRNA的表達:按Trizol試劑說明提取腦組織總RNA,先用RNase H處理后,按照RT-PCR試劑盒說明合成cDNA以及PCR 擴增。Occludin引物序列上游為5' ATCTTTGTTACCAGCGTCAT 3',下游為5' CCTTTAATTCCTGCACCC 3'。以GAPDH作為內參照進行PCR 擴增,引物序列上游為5' TATCGGACGCCTGGTTAC 3',下游為5'ATGGGAGTTGCTGTTGA-AGT 3'。PCR 擴增條件為:94 ℃預變性2 min,1個循環;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35個循環;72 ℃總延伸6 min終止反應。PCR產物經20 g/L瓊脂糖凝膠電泳鑒定,紫外線投射儀下拍照,用D-140圖像記錄分析系統進行分析,目的基因occludin mRNA的表達量以occludin的DNA條帶和GAPDH的DNA條帶灰度值的比值表示。
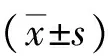
2 結果
2.1 IgG免疫組化檢測結果根據析因方差分析結果顯示,不同處理組間IgG免疫組化染色的IOD值差異有統計學意義(F=32 175.048,P<0.001);不同觀察時間點間IgG免疫組化染色的IOD值差異有統計學意義(F=4 356.426,P<0.001);處理方法與作用時間之間存在交互作用(F=1 300.979,P<0.001)。進一步兩兩比較發現,在相同觀察時間點,與假手術組相比,模型組和治療組IgG免疫組化染色的IOD值均升高(P<0.001);與模型組相比,治療組IgG免疫組化染色的IOD值均降低(P<0.001)。見表1。
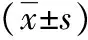
表1 各時間點3組間IgG免疫組化染色的IOD值測定結果比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05
2.2 MMP-2免疫組化測定結果根據析因方差分析結果顯示,不同處理組間MMP-2的差異有統計學意(F=20 892.815,P<0.001);不同觀察時間點間MMP-2的差異有統計學意義(F=4 294.997,P<0.001);處理方法與作用時間之間存在交互作用(F=1 182.892,P<0.001)。進一步兩兩比較發現,在相同觀察時間點,與假手術組相比,模型組和治療組MMP-2均升高(P<0.001);與模型組相比,治療組MMP-2均降低(P<0.001)。見表2。
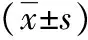
表2 各時間點3組間MMP-2測定結果比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05
2.3 occludin mRNA的表達情況根據析因方差分析結果顯示,不同處理組間occludin mRNA表達的差異有統計學意義(F=8 330.538,P<0.001);不同觀察時間點間occludin mRNA表達的差異有統計學意義(F=2 374.073,P<0.001);處理方法與作用時間之間存在交互作用(F=557.966,P<0.001)。進一步兩兩比較發現,在相同觀察時間點,與假手術組相比,模型組和治療組occludin mRNA表達均降低(P<0.001);與模型組相比,治療組MMP-2均升高(P<0.001)。見表3、圖1。
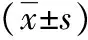
表3 各時間點3組間occludin mRNA表達比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05

A:假手術組 B:模型組 C:治療組圖1 不同時間點occludinmRNA表達結果 A:給藥后1 d;B:給藥后3 d;C:給藥后7 d
3 討論
AIS是一個多因素、多層次的復雜病理損傷過程,涉及氧自由基、鈣超載、細胞因子、細胞凋亡、炎癥反應、基質金屬蛋白酶激活、線粒體損傷、BBB破壞等多重因素,造成腦組織損傷、神經功能障礙。在AIS中,BBB破壞出現早,持續時間長。研究發現[5],腦缺血60 min后BBB通透性增加,可持續4~5周[6],不僅造成病灶側BBB破壞,還造成對側BBB破壞[7]。BBB破壞常造成腦水腫、顱內壓升高、炎癥介質滲出,甚至腦出血,在疾病的發生、發展過程中,扮演著重要角色。因此,保護BBB是治療AIS重要一環。
BBB是一道維持腦組織內環境穩定的高選擇性、低滲性屏障。由兩道屏障構成,第一道屏障是內皮細胞和內皮細胞連接,第二道屏障是基底膜;內皮細胞連接包括緊密連接和黏附連接,緊密連接位于細胞連接的上面,主要有跨膜蛋白、胞漿附著蛋白及細胞骨架蛋白共同組成,跨膜蛋白包括claudin、 occludin、JAM,跨膜蛋白的細胞內部分與胞漿附著蛋白相連,細胞外部分與相鄰細胞的跨膜連接蛋白相互作用,而黏附連接位于細胞連結的基底面,對緊密連接的穩定起著重要的作用[8],內皮細胞及其間緊密連接是BBB的核心結構。Occludin、claudin-5是緊密連接的主要組成部分[9],occludin的分布和表達變化直接影響緊密連接功能及BBB通透性,是評價BBB功能的一項敏感指標[10]。在正常腦組織中,基質金屬蛋白酶( matrix metallo proteinases,MMPs)以低表達量無活性的酶原形式存在,MMPs的活性與其轉錄、翻譯、酶原激活、金屬蛋白酶組織抑制因子(tissue inhibitors of metalloproteinases,TIMP)密切相關,并且MMPs與TIMPs維持著動態平衡。AIS可促進MMPs激活,特別是MMP-2和MMP-9激活,可降解BBB的內皮細胞連接和基底膜,加重腦組織損傷[11],MMP-2可直接降解occludin使BBB破壞。
本研究發現,與假手術組相比,模型組和治療組的IgG滲出量隨時間延長先升高后降低,在第3天達到高峰,且差異有統計學意義(P<0.05),提示腦缺血后BBB通透性增加且在第3天最嚴重;MMP-2隨缺血時間延長先升高后降低,而occludin mRNA表達隨缺血時間延長先減低后升高,均在第3天達峰,且差異有統計學意義(P<0.05)。MMP-2活性增加可直接破壞內皮細胞連接蛋白和基底膜,occludin mRNA表達減少是內皮細胞緊密連接進一步受損,故BBB損傷與MMP-2活性增加和occludin mRNA表達減少密切相關。
阿托伐他汀安全性高、耐受性好,是AIS的一線用藥,除了調脂、穩定斑塊外,還具有抗炎、促進血管再生、促進神經元再生、抗凋亡、抗自噬、抗自由基等多種腦保護作用。在腦缺血模型中,研究發現阿托伐他汀可抑制claudin-5蛋白降解保護BBB[12]。Lischper等[13]研究發現,MMP-2抑制劑可通過抑制MMP-2活性,阻止occludin蛋白降解保護BBB。但是,目前尚不清楚然阿托伐他汀是否通過影響MMP-2、occludin mRNA等分子結構保護BBB,鑒于此,本實驗通過建立MCAO大鼠模型,觀察阿托伐他汀對缺血后大鼠腦組織MMP-2、occludin mRNA的影響。結果顯示,與模型組相比,治療組IgG滲出量減少,且差異有統計學意義(P<0.05),提示阿托伐他汀具有保護BBB作用;MMP-2在腦缺血后各個時間點均減少,而occludin mRNA表達在各時間點均增多,且差異有統計學意義(P<0.05),提示阿托伐他汀可抑制MMP-2活性減少內皮細胞連接蛋白和基底膜破壞,促進occludin mRNA表達使內皮細胞緊密連接更加穩固。由此我們可認為阿托伐他汀可能通過抑制MMP-2活性,提高occludin mRNA表達減輕BBB破壞,減少水分子、炎癥介質滲出,起到保護腦組織作用。
總之,本實驗表明局灶性腦缺血可造成BBB破壞,并呈動態變化,表現在第3天最嚴重,與MMP-2活性增加、occludin mRNA表達減少密切相關。阿托伐他汀可通過抑制MMP-2活性,增加occludin mRNA表達,影響BBB的超微分子結構,起到腦保護作用,進一步闡明了阿托伐他汀保護BBB的相關分子機制。
[1] 高峰.急性缺血性腦卒中血管內治療中國專家共識[J].中國腦血管病雜志,2014,11(10):556-560.
[2] 崔云,張琳,袁芳.自由落體致大鼠腦損傷后血腦屏障變化的研究[J].中國康復理論與實踐,2006,12(8):649-650.
[3] 樂婷,王金蘭,劉宗文,等.阿托伐他汀對局灶性腦缺血大鼠腦組織血管新生的影響[J].中華神經醫學雜志,2015,14(4):473-477.
[4] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5] LIU X B,WANG Z H,WANG P,et al.Green tea polyphenols alleviate early BBB damage during experimental focal cerebral ischemia through regulating tight junctions and PKCalpha signaling[J].BMC Complement Altern Med,2013,13(1):187-197.
[6] STRBIAN D,DURUKAN A,PITKONEN M,et al.The blood-brain barrier is continuously open for several weeks following transient focal cerebral ischemia[J].Neurosci-ence,2008,153(1):175-181.
[7] GARBUZOVA-DAVIS S,HALLER E,WILLIAMS S N,et al.Compromised blood-brain barrier competence in remote brain areas in ischemic stroke rats at the chronic stage[J].J Comp Neurol,2014,522(13):3 120-3 137.
[8] ABBOTT N J,PATABENDIGE A A,DOLMAN D E,et al.Structure and function of the blood-brain barrier[J].Neurobiol Dis,2010,37(1):13-25.
[9] COISNE C,ENGELHARDT B.Tight junctions in brain barriers during central nervous system inflammation[J].Antioxid Redox Signal,2011,15(5):1 285-1 303.
[10] JIAO H X,WANG Z H,LIU Y H,et al.Specific role of tight junction proteins claudin-5,occludin,and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J].J Mol Neurosci,2011,44(2):130-139.
[11] LAKHAN S E,KIRCHGESSNER A,TEPPER D,et al.Matrix metalloproteinases and blood-brain barrier disruption in acute ischemic stroke[J].Front Neurol,2013,4:32.
[12] CUI L L,ZHANG X J,YANG R,et al.Neuroprotec-tion of early and short-time applying atorvastatin in the acute phase of cerebral ischemia:Down-regulated 12/15-LOX,p38MAPK and cPLA2 expression,ameliorated BBB permeability[J].Brain Reseach,2010,1 325(1 325):164-173.
[13] LISCHPER M,BEUCK S,THANABALASUNDARAM G,et al.Metalloproteinase mediated occludin cleavage in the cerebral microcapillary endothelium under pathological conditions[J].Brain Res,2010,1 326(2):114-127.

