靶向抑制Livin表達對子宮內膜癌細胞增殖、侵襲及遷移能力的影響
王曉華,張玉娟
(承德醫學院附屬醫院,河北承德067000)
子宮內膜癌是婦科常見的惡性腫瘤之一,近年來其發病率及病死率呈上升趨勢[1]。子宮內膜癌患者早期多表現為陰道異常出血,手術治療預后較好[2]。但晚期或復發性內膜癌患者的預后仍較差,中位生存期不超過1年[3]。目前,針對腫瘤基因通路的分子靶向治療是研究的熱點[4]。Livin是凋亡抑制蛋白(IAP)家族的新成員,在人類胎盤組織以及大多數實體腫瘤細胞中特異性高表達,并與腫瘤的發生、發展關系密切[5]。研究[6]發現,Livin在子宮內膜癌組織中同樣異常高表達,并且與組織學分級和肌層浸潤有關。但是,關于Livin對子宮內膜癌細胞增殖、侵襲及遷移能力的影響鮮有報道。2015年12月~2017年2月,我們通過靶向抑制Livin在子宮內膜癌細胞中的表達,觀察Livin對細胞增殖、侵襲及遷移能力的影響,旨在為子宮內膜癌的分子靶向治療提供理論依據。
1 材料與方法
1.1 材料
人子宮內膜癌Ishikawa細胞購自南京凱基生物有限公司;胎牛血清(FBS)、RPMI1640培養基、PBS、胰酶購自美國Gibco公司;Lipofectamine 2000購自美國Invitrogen公司;TRIzol購自美國Ambion公司;Takara RNA PCRTM逆轉錄試劑盒購自日本TaKaRa公司;SYBR Green qPCR SuperMIX-UDG熒光定量試劑盒購自美國Invitrogen公司;細胞毒性-增殖檢測試劑盒(CCK-8試劑盒)購自中國北京莊盟生物公司;Transwell小室購自美國Corning公司;Matrigel基質膠購自美國BD公司;特異性小分子干擾RNA(Livin-siRNA)及陰性對照序列(Livin-NC)由廣州銳博公司設計合成。
1.2 細胞培養與分組處理
將Ishikawa細胞置于含10% FBS的RPMI1640培養基中常規培養。轉染前24 h將細胞均勻接種于6孔板,調整細胞密度為4×105/mL。按Lipofectamine 2000說明書配制轉染試劑。將細胞分為Livin-Si組、Livin-NC組和空白對照組,Livin-Si組轉染Livin-siRNA干擾序列,Livin-NC組轉染Livin-NC陰性對照序列,空白對照組加入10% FBS。轉染6 h后棄去原培養基,更換為含10% FBS的完全培養基繼續培養。
1.3 細胞中Livin mRNA表達檢測
采用實時熒光定量PCR法。轉染后48 h取各組細胞,加入TRIzol試劑提取RNA。逆轉錄合成cDNA。使用SYBR Green qPCR SuperMIX-UDG熒光定量試劑盒進行目的基因Livin和內參基因GAPDH的RT-PCR擴增反應,目的基因Livin和內參基因GAPDH的引物均由大連寶生物公司設計合成。Livin上游引物5′-ACGGAGCATGCCAAGTGGT-3′,下游引物5′-CTGCACACTGTGGACAAAGTCTCT-3′,擴增產物78 bp;GAPDH上游引物5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物5′-TGGTGAAGACGCCAGTGGA-3′,擴增產物138 bp。反應條件:95 ℃ 3 min,95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,共40個循環,95 ℃ 1 min、60 ℃ 30 s、95 ℃ 30 s進行熔解曲線分析。采用2-ΔΔCt法計算目的基因的相對表達量。
1.4 細胞增殖能力觀察
采用CCK-8法。取對數生長期細胞,調整細胞密度至4×104/mL,接種于96孔板。培養24 h后進行細胞轉染,每組設5個復孔,同時設置調零孔,只加培養基不加細胞。于轉染24、48、72、96 h分別加入CCK-8稀釋液20 μL(CCK∶無血清培養基=1∶1),混勻,置于37 ℃、5% CO2培養箱中孵育2 h。使用酶標儀測定450 nm處吸光度OD值。
1.5 細胞侵襲能力觀察
采用Transwell小室實驗。應用Corning的小室模型,將Matrigel基質膠與無血清培養基按1∶5比例混勻,每個小室100 μL均勻包被小室基底膜。Matrigel基質膠凝固后,上室加入無血清培養基水化基底膜30 min。收集轉染48 h的Livin-Si組、Livin-NC組和空白對照組細胞,PBS洗2次后,0.25%胰酶消化,用無血清培養基重懸,調整細胞密度至4×105/mL。每孔上室加入100 μL單細胞懸液,下室加入600 μL含20% FBS培養基,將小室放入37 ℃、5% CO2培養箱中培養43 h。擦凈Matrigel基質膠和上室的細胞,4 ℃預冷的甲醇固定30 min。用0.1%結晶紫染色20 min,PBS洗3遍;取下微孔濾膜,放到載玻片上,用二甲苯稀釋過的樹膠封片。顯微鏡下隨機觀察5個視野細胞數量計數,取平均值,實驗重復5次。
1.6 細胞遷移能力觀察
采用Transwell小室實驗。不用鋪Matrigel基質膠,CO2培養箱中培養時間為30 h,其余同Transwell小室侵襲實驗。
1.7 統計學方法
2 結果
2.1 三組Livin mRNA表達比較
Livin-Si組、Livin-NC組和空白對照組Livin mRNA相對表達量分別為0.462±0.086、0.925±0.023、1.000±0.000。Livin-Si組Livin mRNA相對表達量較Livin-NC組和空白對照組降低(P均<0.01)。
2.2 三組細胞增殖能力比較
轉染后24 h各組細胞OD值比較無統計學差異(P均>0.05)。轉染后48、72、96 h,Livin-Si組細胞OD值低于Livin-NC組和空白對照組(P均<0.01)。見表1。
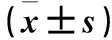
表1 三組細胞增殖能力比較
注:與Livin-Si組同時點比較,*P<0.01。
2.3 三組細胞侵襲能力比較
Livin-Si組、Livin-NC組和空白對照組穿膜細胞數分別為(22.4±3.6)、(52.6±4.2)和(54.8±2.8)個,Livin-Si組穿膜細胞數較Livin-NC組、空白對照組減少(P均<0.01)。
終于那個人不走,她的手擺在金枝眼下。女人們也越集越多,把金枝圍起來。她好像在耍把戲一般招來這許多觀眾,其中有一個三十多歲的胖子,頭發完全脫掉,粉紅色閃光的頭皮,獨超出人前,她的脖子裝好顫絲一般,使閃光的頭顱輕便而隨意地在轉,在顫,她就向金枝說:
2.4 三組細胞遷移能力比較
Livin-Si組、Livin-NC組和空白對照組穿膜細胞數分別為(34.8±3.8)、(60.8±5.2)和(62.4±4.4)個,Livin-Si組穿膜細胞數較Livin-NC組、空白對照組減少(P均<0.01)。
3 討論
細胞增殖與凋亡失衡是惡性腫瘤形成的重要機制之一。Livin位于20號染色體q13.3,全長4.6 kB,包含7個外顯子和6個內含子。Livin的高級結構由4個α螺旋和一個反平行β折疊的氨基酸重復序列組成,此氨基酸重復序列稱為高度保守桿狀病毒IAP氨基酸重復序列,C端含有RING環指結構域。Lopes等[7]研究證實,Livin在正常成人的大多數組織中不表達或較少表達,在人的胎盤組織、胚胎組織以及大多數實體腫瘤中特異性高表達。Ye等[8]研究發現,Livin在前列腺癌組織中高表達,并通過調節細胞G1/S期促進細胞增殖,推測Livin可能在前列腺癌的發生及細胞增殖方面起重要作用。莊莉等[9]研究表明,抑制Livin基因可明顯抑制肺腺癌SPC-A1細胞的增殖能力并增加細胞對順鉑化療的敏感性。Vucic等[10]研究表明,Livin可明顯促進Jurkat T淋巴細胞增殖,抑制其凋亡,其抗凋亡作用明顯強于B細胞淋巴瘤/白血病-2基因(Bcl-2)。Crnkovic-Mertens等[11]在宮頸癌Hela細胞中利用小分子RNA特異性干擾Livin的表達,Hela細胞的生長明顯受到抑制。Temkin等[12]研究發現,Livin在良性子宮內膜組織中少量表達,在子宮內膜癌組織中特異性高表達,并與組織學分級有關,與臨床分期和淋巴結轉移無明顯相關性。本研究首先將Livin的小分子干擾RNA轉染人子宮內膜癌Ishikawa細胞,實時熒光定量PCR檢測轉染后Livin mRNA表達量降低,說明成功抑制Livin在Ishikawa細胞中的表達。CCK-8實驗結果顯示,干擾Livin表達后,Livin-Si組細胞缺乏指數生長特征,增殖能力明顯受到抑制。
Chung等[13]應用RNA干擾技術,通過免疫組織化學、RT-PCR、Western blotting技術檢測胃癌AGS和SNU638細胞中Livin的表達,發現干擾Livin后能顯著抑制胃癌細胞的遷移和侵襲能力。Myung等[14]研究Livin對大腸癌SW480和DK01兩種細胞生物學行為的影響時發現,應用RNA干擾技術抑制Livin基因的表達,可顯著抑制兩種大腸癌細胞的浸潤和轉移能力,而過表達Livin則可促進細胞的侵襲和轉移能力。Wang等[15]應用小分子RNA干擾技術觀察肝癌HepG2細胞的增殖、遷移和侵襲能力,結果顯示敲除Livin后肝癌細胞的增殖、遷移和侵襲能力均明顯受到抑制。本研究侵襲及遷移實驗結果顯示,干擾Livin表達后,與Livin-NC組、空白對照組比較,Livin-Si組穿膜細胞數減少,說明Livin在子宮內膜癌的侵襲轉移中發揮了重要作用,干擾Livin表達可抑制子宮內膜癌細胞的侵襲及轉移能力。
綜上所述,抑制Livin在子宮內膜癌Ishikawa細胞中的表達,可明顯抑制細胞的增殖能力,減弱細胞的侵襲及遷移能力。Livin基因作為IAP家族中的一員,在子宮內膜癌的發生和侵襲轉移過程中發揮了重要作用,相信隨著研究的不斷深入,一定能為子宮內膜癌的靶向治療開拓新的方向。
參考文獻:
[1] Makker A, Gole M. Tumor progression, metastasis, and modulators of epithelial-mesenchymal transition in endometrioid endometrial carcinoma: an update[J]. Endocr Relat Cancer, 2016,23(2):85-111.
[2] Morice P, Leary A, Creulzberg C, et al. Livin and Bcl-2 expression in high-grade osteosarcoma[J]. Lancel, 2016,387(23):1094-1108.
[3] Kitchnener H. Management of endometrial cancer[J]. Eur J Surg Oncol, 2013,32:838-843.
[4] 馮鳳芝,范辰辰,林仲秋.子宮內膜癌的靶向治療[J].中國實用婦科與產科雜志,2017,33(5):472-476.
[5] Gazzanigal P, Gradilone A, Giliani D, et al. Expression and Prognostic significance of Livin and Survivin and other apoptosis-related genes in the progression of superficial bladder cancer[J]. Aun Oncol, 2013,14(1):85-90.
[6] 孫炯,楊留才,李仕紅,等.Livin與caspase-3在子宮內膜癌組織中的表達水平及相關性研究[J].醫學綜述,2014,20(9):1708-1710.
[7] Lopes RB, Gangeswaran R, McNeish IA, et al. Expression of the IAP protein family isdysregulated in pancreatic cancer cells and is important for resistance to chemotherapy[J]. Int J Cancer, 2015,120(11):2344-2352.
[8] Ye L, Song X, Li S, et al. Livin-α promotes cell proliferation by regulating G1-S cell cycle transition in prostate cancer[J]. Prostate, 2014,71(1):42-51.
[9] 莊莉,董超,楊潤祥,等.抑制Livin基因對肺腺癌SPC-A1細胞增殖及順鉑敏感性的影響[J].現代生物醫學進展,2015,15(6):1036-1040.
[10] Vucic D, Franklin MC, Wallweber HJ, et al. Engineering ML-IAP to produce an extraordinarily potent caspase 9 inhibitor: implications for Smac-dependent anti-apoptosis activity of ML-IAP[J]. Cancer Res, 2012,385(1):11-20.
[11] Crnkovic-Mertens I, Semzow J, Hoppe-Seyler F, et al. Isoformspecific silencing of the Livin gene by RNA interference defines Livin beta as a key mediator of apoptosis inhibition in Hela cells[J]. J Mol Med(Berl), 2013,84(3):232-240.
[12] Temkin SM, Fleming G. Current treatment of metastatic endometrial cancer[J]. Cancer Control, 2009,42(16):38-45.
[13] Chung CY, Kim N. Experession and prognostic significance of Livin in gastric cancer[J]. Oncol Rep, 2013,30(5):2520-2528.
[14] Myung DS, Park YL, Chung CY, et al. Expression of Livin in colorectal cancer and its relationship to tumor cell behavior and prognosis[J]. PLoS One, 2013,8(9):73262-73271.
[15] Wang Y, Li Y, Zhou B, et al. Expression of the apoptosis inhibitor Livin in colorectal adenoma-carcinoma sequence: correlations with pathology and outcome[J]. Tumour Biol, 2014,35(12):11791-11798.

