流式細(xì)胞術(shù)及PCR技術(shù)在兒童急性B淋巴細(xì)胞白血病微小殘留病監(jiān)測中的價值*
唐 雪 ,憲 瑩 ,溫賢浩 ,郭玉霞 ,管賢敏 ,王世一 ,肖劍文 △(1.重慶醫(yī)科大學(xué)附屬兒童醫(yī)院血液腫瘤中心;2.兒童發(fā)育疾病研究教育部重點實驗室;3.兒科學(xué)重慶市重點實驗室;4.重慶醫(yī)科大學(xué)附屬兒童醫(yī)院臨檢中心,重慶400014)
急性淋巴細(xì)胞白血病(ALL)是兒童白血病最常見的亞型,其中 B 細(xì)胞性 ALL(B?ALL)占 70%~75%,兒童B?ALL最常見的白血病基因有ETV6/RUNX1、E2A/PBX1或MLL相關(guān)基因等[1],不同基因型預(yù)后有所不同。微小殘留病(MRD)是白血病治療后體內(nèi)殘留白血病細(xì)胞的狀態(tài),是白血病獨立的預(yù)后因素[2]。目前主要的 MRD 檢測方法有 2種[2?3]:流式細(xì)胞術(shù)(FCM)檢測殘留白血病細(xì)胞表面抗原,即FCM?MRD;聚合酶鏈?zhǔn)椒磻?yīng)(PCR)技術(shù)檢測初診時存在的白血病基因表達(dá),即PCR?MRD。本研究針對初診時 ETV6/RUNX1、E2A/PBX1或MLL基因陽性B?ALL患兒采用FCM及PCR技術(shù)監(jiān)測MRD,分析2種方法的靈敏度及特異性是否存在差異,并分析MRD與B?ALL預(yù)后之間的關(guān)系。
1 資料與方法
1.1 一般資料 研究對象為2012年9月至2015年1月重慶醫(yī)科大學(xué)兒童醫(yī)院收治并接受CCLG?ALL?2008方案[4](簡稱08方案)化療初診為B?ALL的患兒。本研究得到重慶醫(yī)科大學(xué)兒童醫(yī)院倫理委員會批準(zhǔn),患兒家屬均簽訂知情同意書。納入標(biāo)準(zhǔn):(1)診斷年齡小于18歲;(2)初診時按WHO?2008淋巴及造血組織腫瘤分型標(biāo)準(zhǔn)[5]完善骨髓細(xì)胞學(xué)、免疫分型、染色體核型分析及融合基因檢查;(3)ETV6/RUNX1、E2A/PBX1 或 MLL基因陽性。排除標(biāo)準(zhǔn):(1)入院前接受過抗白血病治療;(2)成熟B?ALL及混合細(xì)胞白血病;(3)繼發(fā)性ALL或合并其他腫瘤;(4)初診時合并中樞神經(jīng)系統(tǒng)白血病和(或)睪丸白血病;(5)確診前死亡,或確診后放棄治療,或非疾病因素未完成1個療程化療。
1.2 方法
1.2.1 檢測方法 按照08方案,所有患兒在不同時間點(TP),即TP1(誘導(dǎo)緩解療程第15天)、TP2(誘導(dǎo)緩解第33天)、TP3(鞏固治療第1天)時采集骨髓進(jìn)行檢測。
1.2.1.1 骨髓細(xì)胞學(xué) TP1、TP2及TP3均進(jìn)行骨髓細(xì)胞學(xué)檢測。骨髓液涂片5~8張并分類計數(shù)至少200個有核細(xì)胞,幼稚細(xì)胞比例小于5%為M1型,幼稚細(xì)胞比例5%~25%為M2型,幼稚細(xì)胞比例大于25%為M3型。
1.2.1.2 FCM?MRD 在TP2及TP3采用FCM技術(shù)檢測MRD。采集EDTA抗凝骨髓液2 mL并分離單個核細(xì)胞(MNC),每管加入1×106個細(xì)胞,根據(jù)初治時免疫表型選擇個體化檢測抗體組合,每種單抗20μL,混勻后室溫避光15 min,加入1倍溶血素裂解紅細(xì)胞,離心,棄上清。PBS洗滌1次,加入500μL PBS使用四色流式細(xì)胞儀檢測。出現(xiàn)下述情況則定義為MRD陽性[2]:正常表達(dá)抗原強(qiáng)度改變(增強(qiáng)或減弱)和(或)丟失、異常表達(dá)其他系別標(biāo)志、早期和晚期抗原同時表達(dá)、幼稚細(xì)胞比例明顯增多且均質(zhì)性表達(dá)等。以這些殘存細(xì)胞占骨髓MNC 總數(shù)的比例作為 MRD 的數(shù)值,F(xiàn)CM?MRD<10?4為陰性。
1.2.1.3 PCR?MRD 在TP2、TP3時采用PCR技術(shù)檢測MRD。EDTA抗凝骨髓液分離MNC并提取細(xì)胞總RNA,逆轉(zhuǎn)錄為cDNA。初診MLL陽性者經(jīng)逆轉(zhuǎn)錄PCR(RT?PCR)技術(shù)擴(kuò)增后聚丙烯酰胺凝膠電泳及染色分析,出現(xiàn)陽性條帶為 PCR?MRD陽性[6]。初診ETV6/RUNX1或E2A/PBX1陽性者實時熒光定量PCR(qRT?PCR)檢測標(biāo)本基因拷貝數(shù),用已知濃度的標(biāo)準(zhǔn)品和待測標(biāo)本中ABL濃度作為對照,得出待測標(biāo)本基因拷貝數(shù)、基因拷貝數(shù)與ABL濃度比值,基因拷貝數(shù)小于10-5為 PCR?MRD 陰性[7?8]。
1.2.2 治療方案及危險度分組 患兒按照08方案進(jìn)行危險度分組[4]并接受治療。(1)標(biāo)危(SR)組必須同時滿足以下條件。①初診年齡1~<10歲;②初診WBC≤50×109L-1;③無以下染色體改變和(或)基因檢出:t(9;22)或BCR/ABL基因、11q23相關(guān)異常或MLL基因重排、t(1;19)或 E2A/PBX1 基因;④潑尼松試驗[4]敏感(PGR);⑤TP1骨髓細(xì)胞學(xué)結(jié)果為非M3型、TP2時骨髓細(xì)胞學(xué)結(jié)果完全緩解且 FCM?MRD<10-4。(2)高危(HR)組滿足以下條件之一。①t(9;22)或BCR/ABL基因陽性;②11q23相關(guān)異常或MLL基因重排陽性;③潑尼松試驗不敏感(PPR);④初診IR患兒TP1骨髓細(xì)胞學(xué)為M3 型;⑤FCM?MRD:TP2時 FCM?MRD≥10-2或 TP3時FCM?MRD≥10-4。(3)中危(IR)組:既不符合 SR 又不符合HR標(biāo)準(zhǔn)的患兒。
1.2.3 療效評估標(biāo)準(zhǔn) 患兒隨訪至2017年2月,療效以完全緩解(CR)率、無事件生存率(EFS)描述。CR 定義為化療后無明顯白血病癥狀體征、血常規(guī)大致正常且骨髓細(xì)胞學(xué)為M1[9]。EFS定義為自診斷之日起到第1次事件或末次隨訪日期,事件包括治療失敗(早期死亡或未達(dá)CR)、骨髓和(或)髓外復(fù)發(fā)、CR期內(nèi)死亡、發(fā)生第二腫瘤及放棄治療等[9]。
1.3 統(tǒng)計學(xué)處理 應(yīng)用SPSS21.0統(tǒng)計軟件進(jìn)行數(shù)據(jù)分析,計量資料以中位數(shù)、±s表示,采用t檢驗或單因素方差分析;計數(shù)資料以率表示,采用χ2檢驗分析,標(biāo)準(zhǔn)值小于1采用Fisher確切概率法分析;采用Kaplan?Meier生存分析法計算生存率。P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié) 果
2.1 臨床資料 共61例患兒納入本研究,包括ETV6/RUNX1陽性組(A組)34例,E2A/PBX1陽性組(B組)15例及MLL陽性組(C組)12例。A組因診斷時,WBC≥50×109L-1且PPR列入HR組1例,診斷年齡大于或等于10歲列入IR組1例,F(xiàn)CM?MRD異常列入IR組3例;B組因PPR及FCM?MRD異常列入HR組各1例。基因型分組與危險度分組情況見表1。

表1 患兒危險度分布情況(n)
2.2 不同時間點FCM及PCR檢測MRD結(jié)果 A組TP2時FCM?MRD陽性5例,其中PCR?MRD陰性3例。B組TP2時 PCR?MRD陽性4例,僅1例 FCM?MRD陽性。C組TP2時4例FCM?MRD陽性,PCR?MRD陽性僅1例。表明治療早期FCM?MRD與PCR?MRD并不完全相符。A組TP3時FCM?MRD均轉(zhuǎn)陰但仍有1例PCR?MRD陽性。B組TP2后復(fù)發(fā)放棄1例,完成TP3評估14例,F(xiàn)CM?MRD均轉(zhuǎn)陰但仍有3例PCR?MRD陽性。C組TP2后放棄治療或失訪5例,完成TP3評價7例,F(xiàn)CM?MRD及PCR?MRD均轉(zhuǎn)陰。雖樣本量太少無法進(jìn)行統(tǒng)計分析,但仍提示PCR?MRD治療后期可能靈敏度高于FCM?MRD。見表 2。
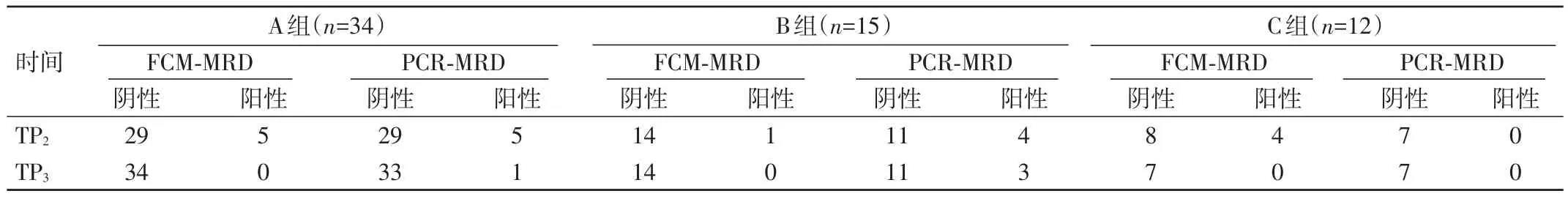
表2 不同時間點FCM及PCR檢測MRD結(jié)果(n)
TP2、TP3時三組患兒共做FCM及PCR監(jiān)測116例次,F(xiàn)CM?MRD陽性 10例次(陽性率為 8.62%),PCR?MRD陽性17例次(陽性率為14.66%),PCR?MRD陽性率高于 FCM?MRD,但差異無統(tǒng)計學(xué)意義(P>0.05)。TP2時FCM?MRD陽性率及PCR?MRD檢查陽性率分別為16.39%和 27.88%,PCR?MRD陽性率也高于 FCM?MRD,但差異無統(tǒng)計學(xué)意義(P>0.05)。
2.3 療效評估 61例患兒總CR率為98.36%(60/61),三組 CR率(A、B、C組分別為 100.00%、100.00% 和91.67%)比較,差異無統(tǒng)計學(xué)意義(P>0.05)。A 組均CR,睪丸及中樞復(fù)發(fā)各 1例,3年EFS為(93.1±4.7)%。B組均CR,TP2時FCM?MRD陰性而PCR?MRD陽性4例均骨髓復(fù)發(fā),F(xiàn)CM?MRD及PCR?MRD均陰性11例中感染死亡2例,其余9例生存,3年EFS為(60.0±12.6)%。C組1例未CR,11例CR患兒放棄治療4例,其余7例(FCM?MRD及PCR?MRD均陰性)中感染及異基因造血干細(xì)胞移植死亡各1例,3年EFS為(62.9±17.9)%。隨訪至2017年2月,所有患兒3年總EFS為(80.0±5.4)%,A 組 EFS均高于 B、C 組,差異均有統(tǒng)計學(xué)意義(P<0.05),見圖 1。B 組 PCR?MRD 陽性患兒全部復(fù)發(fā),而PCR?MRD陰性患兒無復(fù)發(fā),見圖2。
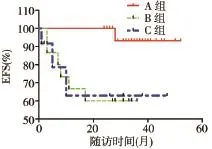
圖1 三組患兒EFS比較
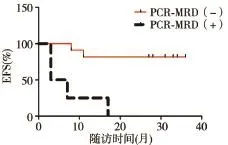
圖2 B組患兒EFS比較
3 討 論
白血病是兒童時期發(fā)病率最高的惡性腫瘤,B?ALL最為常見[1]。隨著診治技術(shù)的改進(jìn)和社會經(jīng)濟(jì)發(fā)展,兒童B?ALL療效不斷提高,治療達(dá)到CR后患兒體內(nèi)仍剩余的微量殘留白血病細(xì)胞是導(dǎo)致疾病復(fù)發(fā)的重要因素[2],因此,尋找可靠的指標(biāo)用于檢測MRD對于指導(dǎo)白血病治療非常重要。
初診時,白血病細(xì)胞具有與正常血細(xì)胞表達(dá)水平、表達(dá)時機(jī)或組合不同的抗原表達(dá),即白血病相關(guān)免疫表型(LAIP)[10],治療達(dá)到CR后殘留白血病細(xì)胞一般仍保留其初診時LAIP。因此,可利用FCM確定初診時LAIP,定期隨訪其水平變化可動態(tài)監(jiān)測MRD。FCM?MRD 簡便快速,但該方法存在若干缺陷[11]:(1)目前尚未發(fā)現(xiàn)真正意義上的白血病特異性抗原,LAIP只是基于正常白細(xì)胞表面分化抗原的多參數(shù)分析,治療后可能抗原漂移導(dǎo)致假陰性;(2)不同實驗室及人員個體化差異大,導(dǎo)致不同中心檢測的穩(wěn)定性較差;(3)FCM需使用新鮮標(biāo)本,故對檢測結(jié)果有疑問時試驗難以重復(fù)。
ETV6/RUNX1、E2A/PBX1及MLL相關(guān)基因是兒童B?ALL最常見的白血病基因,分別占兒童B?ALL的20%~35%、5%~10% 和 5%[12]。融合基因是白血病特異性的分子遺傳學(xué)標(biāo)記且是獨立的預(yù)后因素。因此,初診時利用PCR技術(shù)檢測患者存在的融合基因、定期隨訪該基因表達(dá)情況也可以監(jiān)測MRD[13],且可以克服FCM技術(shù)存在的缺點。
本研究結(jié)果顯示,治療早期PCR?MRD陽性率雖高于 FCM?MRD,但差異無統(tǒng)計學(xué)意義(P>0.05),說明治療早期根據(jù)醫(yī)院自身條件選擇其中一種檢測方法均可有效監(jiān)測MRD并指導(dǎo)治療。但MLL陽性患兒復(fù)發(fā)率高和治療后LIAP容易發(fā)生抗原漂移并導(dǎo)致FCM?MRD誤差,故長期隨訪時PCR?MRD效果可能會優(yōu)于FCM?MRD。本研究結(jié)果發(fā)現(xiàn),E2A/PBX1陽性B?ALL患兒治療后FCM?MRD早期轉(zhuǎn)陰而PCR?MRD陽性者全部復(fù)發(fā),提示該基因陽性患兒治療后選擇PCR技術(shù)監(jiān)測MRD可能優(yōu)于FCM。但PCR技術(shù)僅能針對初診時有特異性白血病基因患兒進(jìn)行,對于基因檢測陰性患兒仍只能采用FCM檢測MRD。
總之,使用FCM或PCR技術(shù)均可以有效檢測兒童B?ALL的MRD水平,并指導(dǎo)其分層治療。但FCM存在的缺陷均可以被PCR技術(shù)彌補(bǔ),而PCR檢測為白血病特有標(biāo)記,因此,對于有特異性白血病基因的患兒,采用PCR技術(shù)監(jiān)測MRD尤其是長期隨訪時可能優(yōu)于FCM。
[1]IIDA S.Overview:a new era of cancer genomics in lymphoid malignan?cies[J].Oncology,2015,89(Suppl1):S4?6.
[2]BASSAN R,SPINELLI O.Minimal residual disease monitoring in adult ALLtodeterminetherapy[J].CurrHematolMaligRep,2015,10(2):86?95.
[3]BASSAN R,SPINELLI O,OLDANI E,et al.Improved risk classifica?tion for risk?specific therapy based on the molecular study of minimal re?sidual disease(MRD)in adult acute lymphoblastic leukemia(ALL)[J].Blood,2009,113(18):4153?4162.
[4]陳波,憲瑩,蘇庸春,等.CCLG?ALL 08方案治療兒童急性淋巴細(xì)胞白血病毒副作用的臨床研究[J].中國當(dāng)代兒科雜志,2013,15(9):737?742.
[5]邱錄貴.2008年版WHO淋巴組織腫瘤分類的新變化[J].中華血液學(xué)雜志,2009,30(7):433?434.
[6]LOH ML,RAETZ EA,MALONEY KW,et al.Outcome of acute lympho?blastic leukemia(all)patients with mll gene rearrangements(mllr)treat?ed on contemporary children′s oncology group(cog)protocols[J].Pediatr Blood Cancer,2012,59(6):1005.
[7]ALJAMAAN K,ALJUMAH TK,ALORAIBI S,et al.Low frequency of ETV6?RUNX1(t12;21)in saudi Arabian pediatric acute lymphoblastic leukemia patients:association with clinical parameters and early remis?sion[J].Asian Pac J Cancer Prev,2015,16(17):7523?7527.
[8]ASAI D,IMAMURA T,YAMASHITA Y,et al.Outcome of TCF3?PBX1 positive pediatric acute lymphoblastic leukemia patients in Japan:a col?laborative study of Japan Association of Childhood Leukemia Study(JA?CLS)and Children′s Cancer and Leukemia Study Group(CCLSG)[J].Cancer Med,2014,3(3):623?631.
[9]GUPTA V,RICHARDS S,ROWE J,et al.Allogeneic,but not autolo?gous,hematopoietic cell transplantation improves survival only among younger adults with acute lymphoblastic leukemia in first remission:an individual patient data meta?analysis[J].Blood,2013,121(2):339?350.
[10]LIU YR,CHEN SS,CHANG Y,et al.Leukemia?associated immunophe?notypes in 415 childhood and adult patients with B lineage acute lym?phoblastic leukemia by multiparametric flow cytometry analysis[J].Zhongguo Shi Yan Xue Ye XueZaZhi,2006,14(5):853?857.
[11]BURNUSUZOV HA,SPASOVA MI,MURDJEVA MA,et al.Immuno?phenotypic modulation of the blast cells in childhood acute lymphoblas?tic leukemia minimal residual disease detection[J].Folia Med(Plovdiv),2016,58(1):28?35.
[12]MELéNDEZ CLC,ROSALES L,HERRERA M,et al.Frequency of the ETV6?RUNX1,BCR?ABL1,TCF3?PBX1 and MLL?AFF1 fusion genes in Guatemalan Pediatric Acute Lymphoblastic Leukemia Patients and Its Ethnic Associations[J].Clin Lymphoma Myeloma Leuk,2015,15:S170.
[13]SUDHAKAR N,RAJALEKSHMY KR,RAJKUMAR T,et al.RT?PCR and real?time PCR analysis of E2A?PBX1,TEL?AML1,mBCR?ABL and MLL?AF4 fusion gene transcripts in de novo B?lineage acute lymphoblas?tic leukaemia patients in South India[J].J Genet,2011,90(2):349?353.

