大豆異黃酮對褐牙鲆免疫細胞功能的體外研究
袁 瑞,楊 寧,姜 秦,王正麗
( 青島農業大學,海洋科學與工程學院,山東 青島 266109 )
魚粉是水產飼料的優質蛋白源,然而,近年來過度捕撈和不良氣候使魚粉產量降低,魚粉價格逐年增長[1]。尋找優質廉價的替代蛋白源成為水產飼料研究的主要問題之一。大豆蛋白消化吸收率高、價格低、資源豐富,可作為替代蛋白源成為研究熱點[2]。
但是,大豆蛋白中所含有的抗營養因子限制了其利用[3]。其中大豆異黃酮屬于黃酮類化合物,是大豆中較為常見的抗營養因子,在飼料中超過一定劑量對動物的生長、健康及對飼料中營養物質的利用率均有負面作用[4-6]。研究發現,飼料中豆粕對魚粉的替代水平超過75%時,影響羅非魚(Oreochromissp.)的生長、消化酶和轉氨酶活性,而這與豆粕中所含的抗營養因子大豆異黃酮的含量相關[4];在飼料中添加1~3 g/kg大豆異黃酮對褐牙鲆(Paralichthysolivaceus)生長無顯著影響,但添加量達到4 g/kg時,顯著抑制褐牙鲆生長[5]。也有研究表明,飼料中適量的大豆異黃酮對動物生長有一定促進作用[6-8]。Zhou等[6]發現,隨著飼料中大豆異黃酮含量的增加,卵形鯧鲹(Trachinotusovatus)的生長性能顯著提高,40 mg/kg為最適添加量,添加量達60~80 mg/kg時則表現出抑制作用。而對陸生動物中的研究則表明,除了影響生長,大豆異黃酮無論在體內或體外還具有免疫調節作用[9-10],能夠提高小鼠的殺傷細胞反應[11]、調節人類的細胞免疫[12]等。但目前有關大豆異黃酮對魚類影響的研究多集中在豆粉替代魚粉后對魚類生長產生的影響上,研究結果也存在較大的差異。大豆異黃酮是否具有增強魚類免疫的作用及其相關機理仍不明確。因此,為進一步研究大豆異黃酮對魚類的免疫效應,筆者建立了離體細胞模型,研究了離體條件下大豆異黃酮對褐牙鲆相關免疫細胞的免疫效應。
褐牙鲆是我國北方沿海地區廣泛養殖的重要海水魚類之一[13]。頭腎巨噬細胞[14]和外周血白細胞[15]是褐牙鲆重要的免疫細胞,在褐牙鲆免疫過程中起重要作用。本試驗旨在研究大豆異黃酮對體外培養的褐牙鲆頭腎巨噬細胞和外周血白細胞免疫力的影響,明確大豆異黃酮對褐牙鲆的免疫細胞是否具有免疫促進抑或抑制作用,為大豆異黃酮在水產養殖飼料中的添加以及植物蛋白源的合理開發和利用提供試驗依據。為尋求新的水產養殖飼料原料替代品提供參考。
1 材料與方法
1.1 材料
試驗用褐牙鲆購自日照某養殖場,體質量(250±12) g,健康無傷,暫養于海水循環系統中。水溫17~19 ℃,鹽度32~40,溶氧8.0 mg/L以上,每日投喂商品飼料兩次。
1.2 細胞的分離培養
1.2.1 褐牙鲆頭腎巨噬細胞的分離培養
在超凈臺內剖取褐牙鲆頭腎,研磨備用。采用Ortuńo的方法分離褐牙鲆頭腎巨噬細胞[16],將頭腎研磨液過100目篩絹,加入到34%/51% percoll(Solarbio公司)分離液的液面,4 ℃,2200 r/min離心25 min,吸取中間層巨噬細胞;然后加入3 mL 0.15 mol/L磷酸鹽緩沖液,1200 r/min離心5 min后洗滌兩次,加入2% FBS-L-15(添加1%雙抗、4%抗凝劑、2%胎牛血清)重懸得巨噬細胞。
1.2.2 外周白細胞的分離
在無菌條件下,用含有抗凝劑的注射器尾靜脈抽血,分離外周血白細胞[17]。取稀釋血液加入到60% Percoll分離液液面上,4 ℃,2200 r/min離心25 min后,從上到下依次為血漿層、白細胞層、粒細胞層、紅細胞層,于白細胞層輕輕吸取白細胞;加入3 mL 0.15 mol/L磷酸鹽緩沖液,1200 r/min離心5 min后洗滌兩次,用2% FBS-L-15重懸得白細胞。
1.2.3 細胞計數及培養
用臺盼藍法檢測分離頭腎細胞和白細胞活性[16],用2% FBS-L-15培養基調整這兩種細胞的密度為107個/mL,分別接種到96孔板中,每孔100 μL細胞液,放置于19 ℃恒溫培養箱培養2 h后,棄上清液以去除未貼壁細胞,然后分別加入100 μL含有0、0.1、0.5、1.0、1.5 mg/mL和2.0 mg/mL大豆異黃酮的細胞培養液(添加不同質量濃度大豆異黃酮的2% FBS-L-15培養基),放于19 ℃恒溫培養箱中繼續培養24 h,每個梯度設置4個重復。
1.3 免疫指標測定
1.3.1 氧呼吸爆發活力測定
采用Dolmatova[18]的方法稍作修改。吸棄細胞培養液上清,每孔中加入100 μL氯化硝基四氮唑藍溶液[質量濃度為1 mg/mL,含有10 μL 1 mg/mL的乙酸肉豆蔻佛波醇],在19 ℃恒溫培養箱避光孵育40 min后吸棄上清液,加入200 μL 100%甲醇固定10 min,用200 μL 70%甲醇洗滌細胞兩次后每孔加入120 μL KOH(2 mol/L)和140 μL二甲基亞砜(100%),用酶標儀在620 nm測定吸光值。
1.3.2 增殖活力測定
采用MTT法[19]稍作修改。不同細胞中加入10 μL噻唑藍(5 mg/mL MTT),19 ℃恒溫培養箱避光孵育4 h,吸棄上清液,每孔加入150 μL二甲基亞砜(100%),用酶標儀在490 nm測定吸光值。
1.3.3 吞噬活力的測定[19-20]
1.3.3.1 頭腎巨噬細胞吞噬活力
在每孔細胞中加入20 μL密度為5×108cfu/mL的自制鰻弧菌懸液,19 ℃恒溫培養箱中培養5 h;吸棄上清液后再每孔加100 μL 0.2%的吐溫-20,反應10 min后加10 μL噻唑藍(MTT 5 mg/mL),19 ℃恒溫培養箱中培養4 h;吸棄上清液后,每孔再加150 μL二甲基亞砜(100%)10 min后,用酶標儀在490 nm下測定吸光值。
1.3.3.2 外周血白細胞吞噬活力
將培養后的外周血白細胞96孔板1000 r/min離心,吸棄上清液。每孔加入0.075%的中性紅溶液100 μL,19 ℃恒溫培養箱中培養1 h;離心棄上清液,用200 μL 0.15 mol/L 磷酸鹽緩沖液洗凈未被吞噬的中性紅;每孔加150 μL細胞裂解液(乙酸∶無水乙醇=1∶1),19 ℃恒溫培養過夜反應后,用酶標儀測定510 nm下的吸光值。
1.4 統計分析
試驗數據用SPSS 19.0軟件進行單因素方差分析,當P<0.05時認為差異顯著,進行Duncan多重比較。
2 結 果
在體外培養條件下,大豆異黃酮對褐牙鲆頭腎巨噬細胞和外周血白細胞免疫力有顯著影響(P<0.05),且隨著培養液中大豆異黃酮質量濃度的增加,細胞免疫力呈先增加后降低的趨勢。
2.1 不同質量濃度大豆異黃酮在體外對褐牙鲆頭腎巨噬細胞免疫力的影響
2.1.1 對褐牙鲆頭腎巨噬細胞氧呼吸爆發活力的影響
體外培養條件下,細胞培養中不同質量濃度大豆異黃酮顯著影響褐牙鲆頭腎巨噬細胞的氧呼吸爆發活力(P<0.05)(圖1)。當大豆異黃酮質量濃度為0.5 mg/mL時,褐牙鲆巨噬細胞氧呼吸爆發活力顯著高于對照組和其他處理組(P<0.05),而最高質量濃度組(2 mg/mL)的氧呼吸爆發活力顯著低于最低質量濃度組(0.1 mg/mL)(P<0.05),其他處理組之間差異不顯著(P>0.05)。
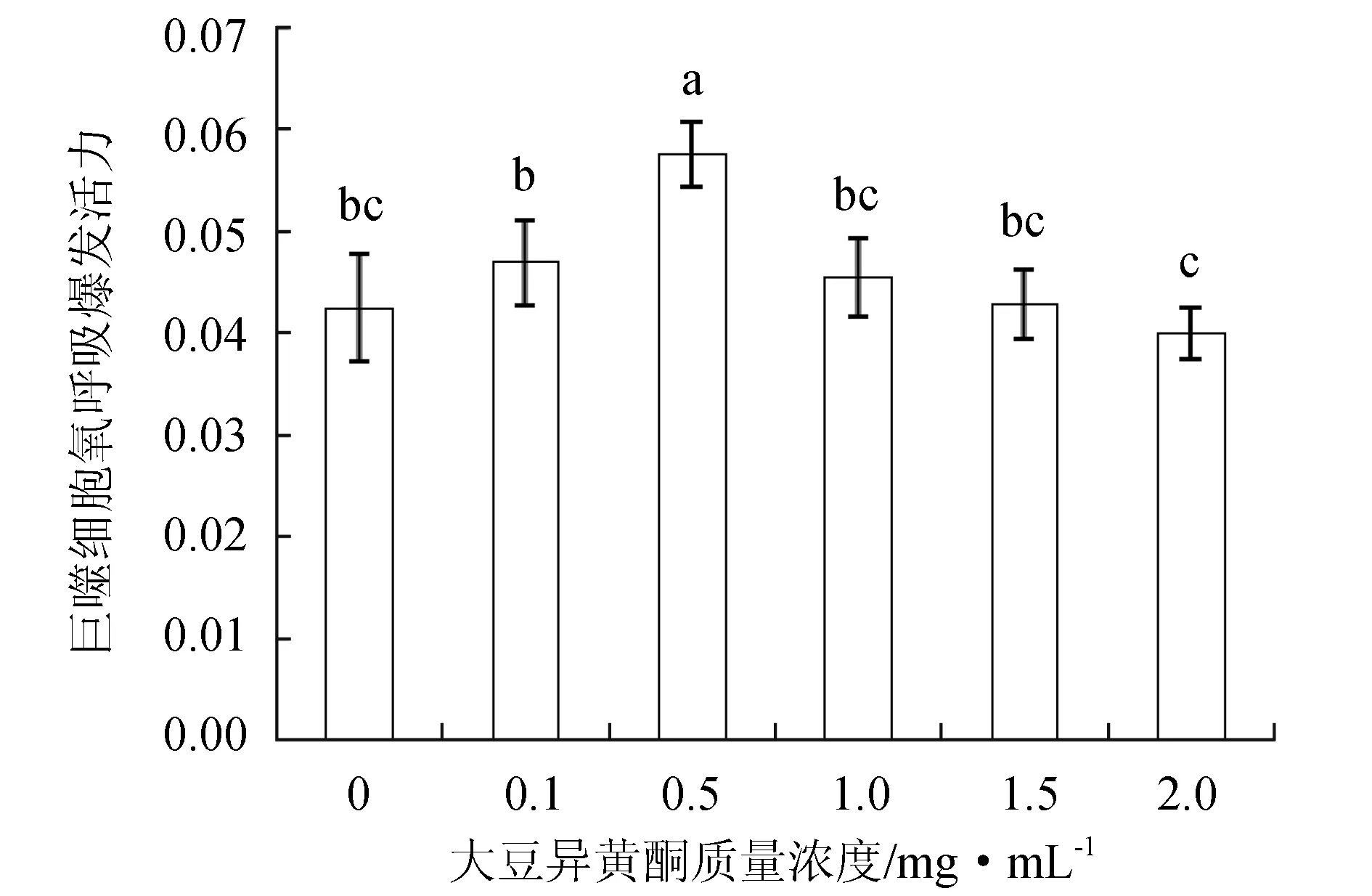
圖1 不同質量濃度大豆異黃酮在體外對褐牙鲆頭腎巨噬細胞氧呼吸爆發活力的影響
2.1.2 對褐牙鲆頭腎巨噬細胞增殖活力的影響
細胞培養液中大豆異黃酮質量濃度為0.1、0.5、1.0 mg/mL時,褐牙鲆頭腎巨噬細胞增殖活力顯著增加(P<0.05),在質量濃度為0.5 mg/mL時活力最高;隨著大豆異黃酮質量濃度的增加,褐牙鲆頭腎巨噬細胞增殖活力顯著降低,當大豆異黃酮質量濃度為2 mg/mL時,頭腎巨噬細胞增殖活力最低,顯著低于對照組和其他處理組(P<0.05)(圖2)。
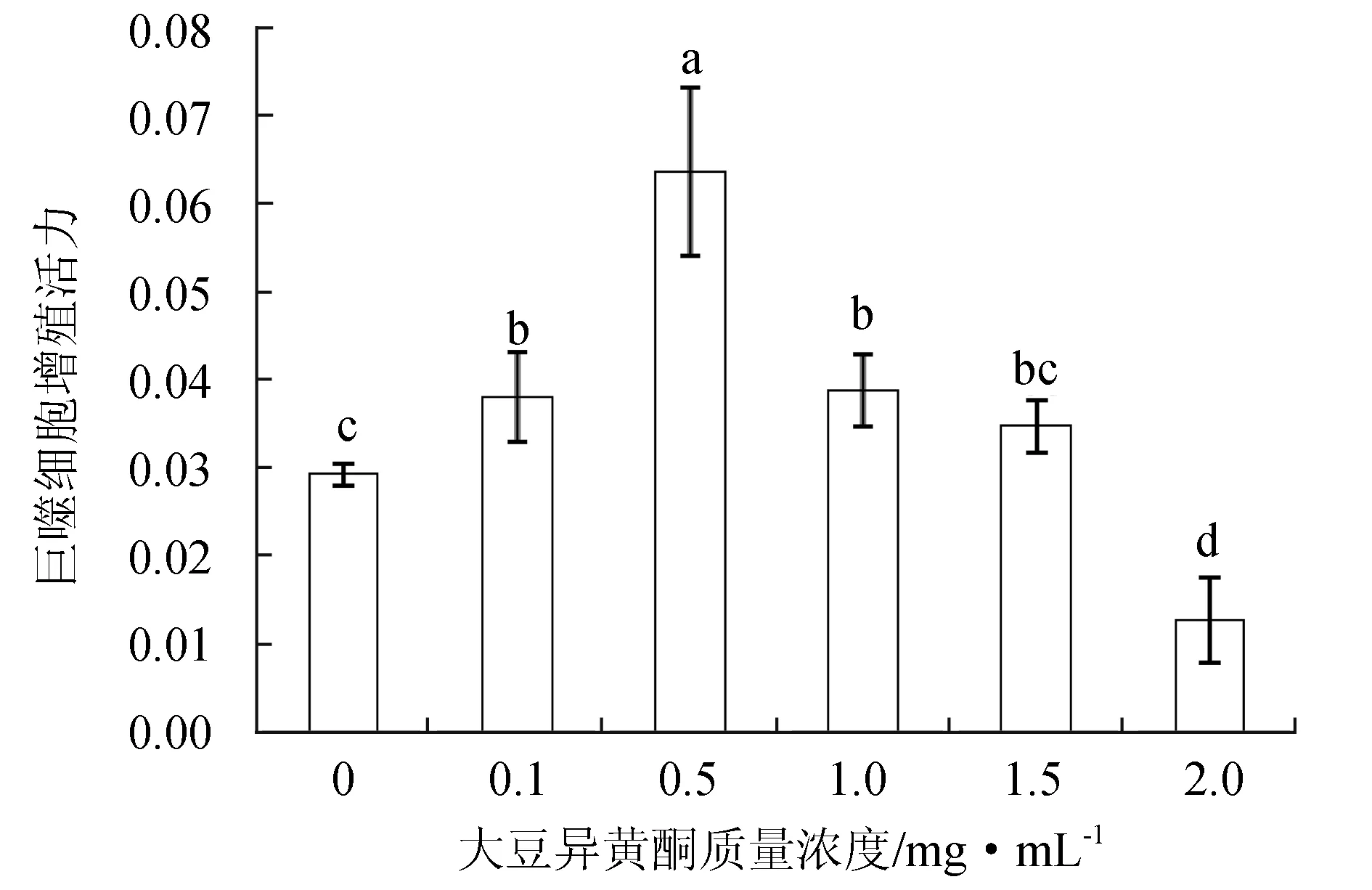
圖2 不同質量濃度大豆異黃酮在體外對褐牙鲆頭腎巨噬細胞增殖活力的影響
2.1.3 對褐牙鲆頭腎巨噬細胞吞噬活力的影響
當細胞培養液中大豆異黃酮質量濃度為0.5 mg/mL和1.0 mg/mL時,褐牙鲆頭腎巨噬細胞吞噬活力顯著高于對照組和其他處理組(P<0.05),質量濃度在0.5 mg/mL時值最高;而當細胞培養液中大豆異黃酮質量濃度為2.0 mg/mL時,褐牙鲆巨噬細胞的吞噬活力值最低(P<0.05)(圖3)。
2.2 不同質量濃度大豆異黃酮在體外對褐牙鲆外周血白細胞免疫力的影響
2.2.1 對褐牙鲆外周血白細胞氧呼吸爆發活力的影響
不同質量濃度大豆異黃酮顯著影響褐牙鲆外周血白細胞氧呼吸爆發活力(P<0.05),當培養液中大豆異黃酮質量濃度為0.5、1.0 mg/mL時,白細胞氧呼吸爆發活力顯著高于對照組(P<0.05);0.1、1.5 mg/mL處理組則與對照組差異不顯著(P>0.05)(圖4)。
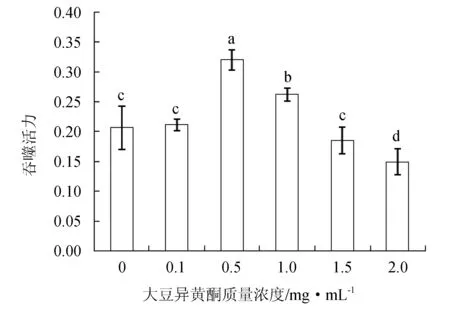
圖3 不同質量濃度大豆異黃酮在體外對褐牙鲆頭腎巨噬細胞吞噬活力的影響
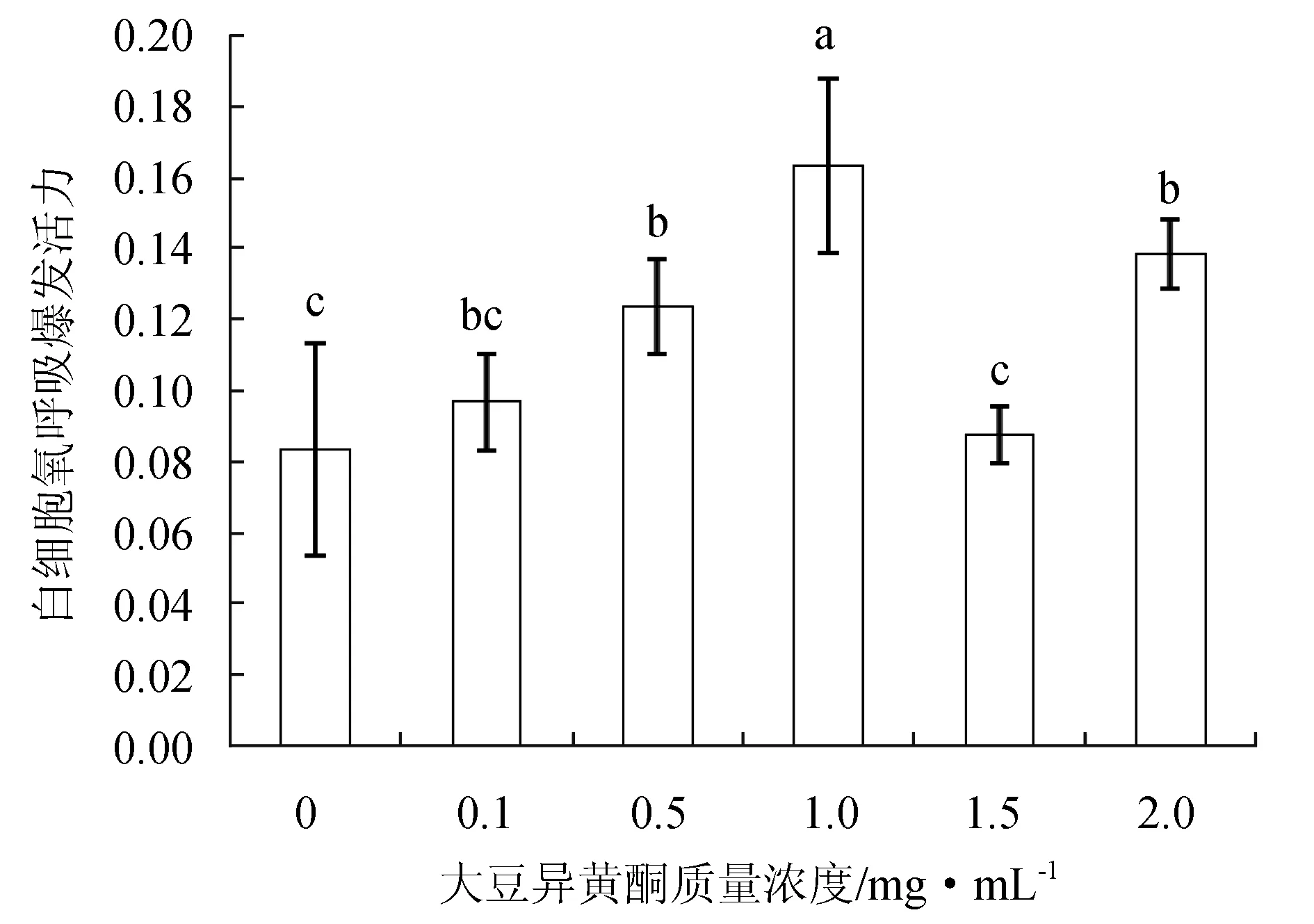
圖4 不同質量濃度大豆異黃酮下褐牙鲆外周血白細胞氧呼吸爆發活力的影響
2.2.2 對褐牙鲆外周血白細胞增殖活力的影響
培養液中添加不同質量濃度大豆異黃酮顯著增強了褐牙鲆外周血白細胞的增殖活力(P<0.05),且大豆異黃酮質量濃度為0.5 mg/mL時,白細胞增殖活力值最高(圖5)。
2.2.3 對褐牙鲆外周血白細胞吞噬活力的影響
不同質量濃度大豆異黃酮顯著影響了褐牙鲆外周血白細胞的吞噬活力(P<0.05)(圖6),大豆異黃酮質量濃度為0.5 mg/mL時褐牙鲆外周血白細胞吞噬活力最高,顯著高于其他試驗組(P<0.05);隨著培養液中大豆異黃酮質量濃度的增加,褐牙鲆外周血白細胞吞噬活力顯著降低,當大豆異黃酮質量濃度為2.0 mg/mL時,白細胞吞噬活力最低,顯著低于其他試驗組(P<0.05)。
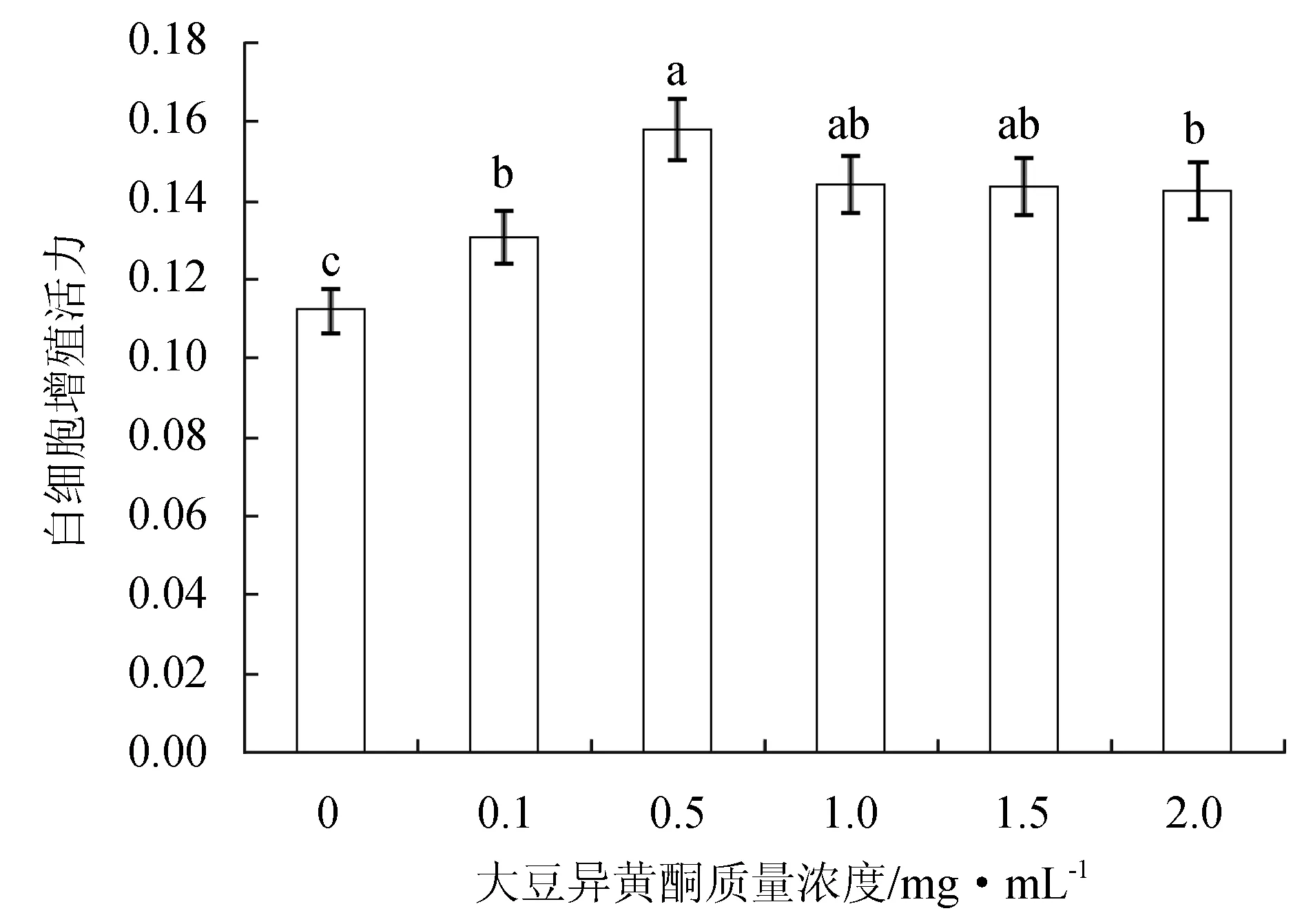
圖5 不同質量濃度大豆異黃酮下褐牙鲆外周血白細胞的增殖活力
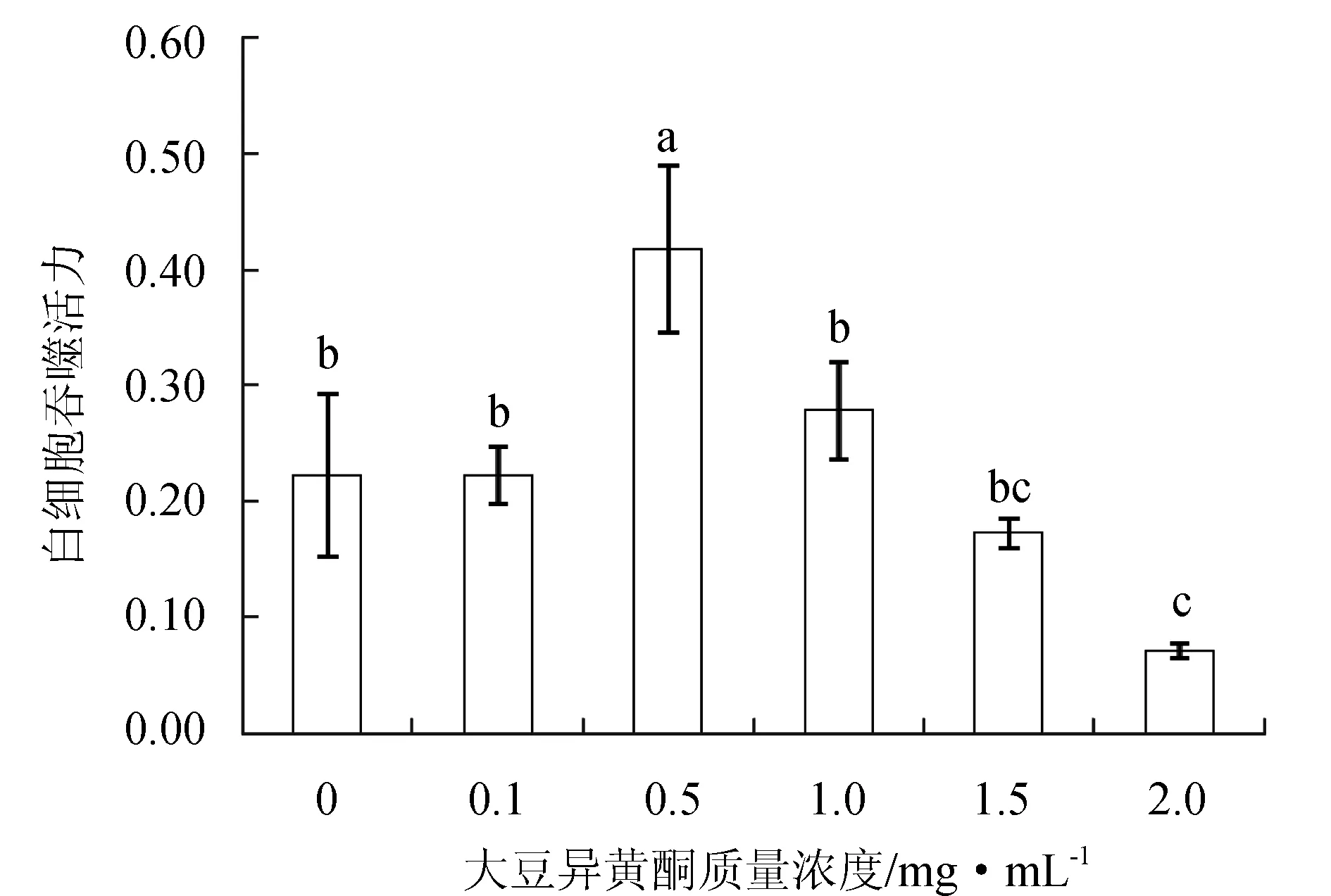
圖6 不同質量濃度大豆異黃酮下褐牙鲆外周血白細胞的體外吞噬活力
3 討 論
大豆異黃酮是大豆中主要的植物雌激素,是一種具有類雌激素性質的抗營養因子[7]。研究表明,動物飼糧中添加適量的大豆異黃酮能夠促進動物生長,降低飼料成本,增強機體免疫力[21]。日糧中添加大豆異黃酮能夠促進蛋雞免疫器官發育,提高免疫功能[22];大豆異黃酮顯著影響了仔豬生長、免疫性能等[8]。但是,大豆異黃酮在水產動物中的研究較少,Tzchori等[23]在飼料中添加2、20 μg/g的大豆異黃酮促進了歐洲鰻鱺(Anguillaanguilla)的生長;張偉[7]研究發現,當飼料中大豆異黃酮含量在4800 μg/g以下時,對異育銀鯽(Carassiusauratusgibelio)的生長無顯著影響,而當含量超過7200 μg/g時,則顯著抑制異育銀鯽的生長。在本試驗中,離體條件下大豆異黃酮顯著影響褐牙鲆頭腎巨噬細胞和外周血白細胞的免疫力。培養液中大豆異黃酮的質量濃度為0.5 mg/mL時,顯著促進了褐牙鲆相關免疫活力;但大豆異黃酮質量濃度進一步增加,褐牙鲆的免疫力反而下降,在本試驗條件下,當大豆異黃酮質量濃度為2.0 mg/mL時,褐牙鲆的細胞呼吸爆發活力、巨噬細胞增殖活力和吞噬活力降低,培養液中高質量濃度的大豆異黃酮對褐牙鲆的細胞免疫力表現出抑制作用。
頭腎巨噬細胞和外周血白細胞均屬于魚類主要的吞噬細胞,其對免疫的影響主要體現在呼吸爆發活力、增殖活力和吞噬活力。顆粒與吞噬細胞的結合或其它可溶性物質的刺激可以激發吞噬細胞產生大量的活性氧[超氧陰離子(O2-)、過氧化氫(H2O2)和單線態氧(1O2)等]。這些活性氧殺滅細菌和微生物的過程即為呼吸爆發[24]。在本試驗中,大豆異黃酮在體外增強了頭腎巨噬細胞和外周血白細胞氧呼吸爆發活力,增強效果隨質量濃度的增加先升后降。Disilvestro等[25]曾報道大豆異黃酮可以提高人體紅細胞內超氧化物歧化酶的活性;Zhou等[6]研究也表明,添加大豆異黃酮改善了機體抗氧化狀態,抑制自由基的形成,從而減少脂質超氧化物的形成。因此大豆異黃酮對細胞呼吸爆發活力的影響可能主要體現在對細胞內氧自由基的產生上。但大豆異黃酮對呼吸爆發活力的影響有一個閾值,當添加量超過一定值則產生抑制作用。吞噬細胞為魚體內主要的免疫細胞,外來微生物入侵后即開始增殖以殺死外來入侵微生物[26];吞噬作用是細胞內消化、殺滅和消化入侵的微生物過程,這包括了顆粒與細胞表面接觸、消化形成吞噬體以及分解吞噬體中的顆粒三個步驟[27]。本試驗結果表明,大豆異黃酮顯著影響頭腎巨噬細胞和外周血白細胞的增殖活力及吞噬活力。Tang等[28]發現,異黃酮衍生物可以通過抑制巨噬細胞和骨髓基質細胞中相關蛋白的信號通路,抑制破骨細胞的形成,可以推論大豆異黃酮可以通過介導與細胞增殖和吞噬作用相關的蛋白表達來影響其活力,或者是通過影響細胞內信號通路的完成來影響巨噬細胞和白細胞的增殖活力。
本試驗在離體條件下,在培養液中添加大豆異黃酮培養巨噬細胞和白細胞,顯示添加不同質量濃度的大豆異黃酮對褐牙鲆頭腎巨噬細胞和外周血白細胞的免疫效果具有顯著影響,推測存在一個促進魚類生長的適宜大豆異黃酮質量濃度,為進一步在飼料中添加大豆異黃酮,促進動物免疫的研究提供了參考。但飼料中大豆異黃酮的影響受機體更為復雜的調控機制作用,也與魚的種類、規格、性別、食性、生理狀態、養殖系統等多種因素影響,其作用效果和機理有待于進一步探討。
[1] 邢秀蘋,楊歡歡,韋慶勇,等.豆粕和膨化大豆粉對鯉魚生長及其肌肉營養成分的影響[J].西北農林科技大學學報,2015,43(12):13-18.
[2] Lilleeng E, Froystad M K, Vekterud K, et al. Comparison of intestinal gene expression in Atlantic cod (Gadusmorhua) fed standard fish meal or soybean meal by means of suppression subtractive hybridization and real-time PCR[J].Aquaculture, 2007,267(1/4):269-283.
[3] 陳棟,金秋燕.金雀異黃素對尼羅羅非魚(Oreochromisniloticus)生長及生長軸相關基因表達的影響[J].飼料工業,2016,37(6):32-37.
[4] Lin S, Luo L. Effects of different levels of soybean meal inclusion in replacement for fishmeal on growth, digestive enzymes and transaminase activities in practical diets for juvenile tilapia,Oreochromisniloticus×O.aureus[J]. Animal Feed Science and Technology, 2011, 168(1/2):80-87.
[5] Mai K S, Zhang Y J, Chen W, et al. Effects of dietary soy isoflavones on feed intake, growth performance and digestibility in juvenile Japanese flounder (Paralichthysolivaceus)[J]. Journal of Ocean University of China, 2012, 11(4):511-516.
[6] Zhou C P, Lin H Z,Ge X P, et al. The effects of dietary soybean isoflavones on growth, innate immune responses, hepatic antioxidant abilities and disease resistance of juvenile golden pompanoTrachinotusovatus[J]. Fish and Shellfish Immunology, 2015, 43(1):158-166.
[7] 張偉.大豆皂甙與大豆異黃酮對異育銀鯽生長、生理及腸道健康的影響[D]. 蘇州:蘇州大學,2010.
[8] 李方方,朱濤濤,朱宇旌,等.大豆異黃酮對斷奶仔豬生長性能、免疫性能、養分消化率和糞中微生物菌群的影響[J].養豬,2015(5):25-29.
[9] Bao Z S, Ling H, Yan G, et al. Inhibition of airway inflammation, hyperresponsiveness and remodeling by soy isoflavone in a marine model of allergic asthma[J]. International Immunopharmacology,2011, 11(8):899-906.
[10] Tezuka H, Imai S. Immunomodulatory effects of soybeans and processed soy food compounds[J]. Recent Patents Food Nutrition Agriculture, 2015, 7(2):92-99.
[11] Guo T L, White K L, Brown R D, et al. Genistein modulates splenic natural killer cell activity, antibody-forming cell response, and phenotypic marker expression in F(0) and F(1) generations of Sprague-Dawley rats[J]. Toxicology and Applied Pharmacology, 2002, 181(3):219-227.
[12] Masilamani M, John W, Shiven B, et al. Soybean isoflavones regulate dendritic cell function and suppress allergic sensitization to peanut[J]. The Journal of Allergy and Clinical Immunology, 2011, 128(6):1242-1250.
[13] 王波,張朝暉,左言明,等.牙鲆屬主要經濟魚類的生物學及養殖研究概況[J].海洋水產研究,2004,25(5):86-92.
[14] Baba T, Imamura J,Izawak, et al. Cell-mediated protection in carp,CyprinuscarpioL., againstAeromonashydrophila[J]. Journal of Fish Diseases, 1998, 11(2):171-179.
[15] 陳旭衍,侯亞義.魚類細胞因子研究進展[J].水生生物學報,2004,28(6):668-673.
[16] Ortuńo J,Esteban M.High dietary intake of α-tocopherol acetate enhances the non-specific immune response of gilthead seabream (SparusaurataL)[J].Fish and Shellfish Immunology,2000,10(4):293-307.
[17] Warr G W, Simon R C. The mitogen response potential of lymphocytes from the rainbow trout (Salmogairdneri) re-examined [J]. Developmental and Comparative Immunology, 1983, 7(2):379-384.
[18] Filman D J, Brown R J, Dandliker W B.Intracellular supravital stain delocalization as an assay for antibody dependent complement-mediated cell damage [J]. Journal of Immunological Methods, 1975, 6(3):189-207.
[19] Dolmatova L S, Eliseikina M G, Romashina V. Antioxidant enzymatic activity of coelomocytes of the fareast sea cucumberEupentactafraudatrix[J]. Journal of Evolutionary Biochemistry and Physiology,2004,40(2):126-135.
[20] Zhang Q, Ma H M, Mai K S.Interaction of dietaryBacillussubtilisand fructooligosaccharide on the growth performance, non-specific immunity of sea cucumber,Apostichopusjaponicas[J]. Fish and Shellfish Immunology, 2001, 29(2):204-211.
[21] 戴述誠,李志業,葉勇,等.新型綠色飼料添加劑——大豆異黃酮[J].中國動物保健,2013,15(9):15-18.
[22] 王英華,吳志明,張蕊,等.大豆異黃酮對蛋雞免疫性能的影響[J].中國獸醫雜志,2015,51(5):50-52.
[23] Tzchori I, Degani G. The influence of phytoestrogens and oestradiol-17β on growth and sex determination in the European eel (Anguillaanguilla) [J]. Aquaculture Research, 2004, 35(13):1213-1219.
[24] Hyung S C, Kim J W, Cha Y N. A quantitative nitroblue tetrazolium assay for determining intracellular superoxide anion production in phagocytic cells [J]. Journal of Immunoassay and Immunochemistry, 2006, 27(1):31-44.
[25] Disilvestro R A, Goodman J, Dy E, et al. Soy isoflavone supplementation elevates erythrocyte superoxide dismutase, but not plasma ceruloplasmin in postmenopausal breast cancer survivors [J]. Breast Cancer Res Treat, 2005, 89(3):251-255.
[26] Jyonouchi. Studies of immunomodulating actions of RNA/nucleotides: RNA/nucleotides enhance in vitro immunoglobulin production by human peripheral blood mononuclear cells in response to T-dependent stimuli [J]. Pediatrics, 2002, 33(5):458-465.
[27] Dannevig B H, Lauve A. Receptor-mediated endocytosis and phagocytosis by rainbow trout head kidney sinusoidal cell [J]. Fish and Shellfish Immunology, 1994, 4(1):3-18.
[28] Tang C H, Chang C S, Tan T W, et al. The novelisoflavone derivatives inhibit RANKL -induced osteoclast formation [J]. European Journal of Pharmacology, 2010, 648(1/3):59-66.

