TNF-α-1031 T/C基因多態性與精神分裂癥患者發病年齡、認知功能的關系
唐偉 溫娜 劉家洪 潘建設 章金良 詹敏梅 楊馥銀 陳潔 修梅紅
國內外研究表明,精神分裂癥患者存在持久且嚴重的認知功能損害,如言語記憶、注意、視空間能力和執行功能等[1-3]。同時認知功能損害在發病前就已存在,是精神分裂癥的獨立癥狀[4]。但目前關于其機制仍未清楚,有研究認為過度激活的免疫反應-慢性炎癥過程可能參與了精神分裂癥的認知功能損害[5]。關于神經系統疾病的研究發現,免疫-神經炎癥反應是認知功能下降的神經病理機制[6-8]。關于精神疾病的研究發現,雙相障礙患者執行功能中的抑制控制能力與外周血TNF-α水平呈正相關[9],且與TNF-α受體(可溶性sTNFR2)呈負相關。TNF-α在精神分裂癥發病與精神病性癥狀中的作用已被廣泛研究過[10],但它是否參與認知功能損害的研究較少。TNF-α基因位于6p21.3主要組織相容性復合物(MHC)-Ⅲ類分子區域內,此區域是精神分裂癥的易感位點。Zhang等[11]研究發現位于啟動子區域-1031位置處的T/C基因多態性與精神分裂癥的發病年齡相關,而與精神分裂癥的認知功能損害是否有關需要進一步研究。神經假說認為,精神分裂癥是一種神經發育缺陷的疾病,發病年齡可能與精神分裂癥患者認知功能損害的嚴重程度有關,患者發病年齡越早,其神經發育缺陷越嚴重,表現出的認知功能障礙越嚴重。亦有研究報道早發型精神分裂癥患者比晚發型精神分裂癥患者存在更為嚴重的認知功能損害,尤其在即刻記憶方面[12]。因此,本研究就TNF-α-1031 T/C基因多態性與精神分裂癥患者發病年齡、認知功能損害之間的復雜關系作一綜合分析,現報道如下。
1 對象和方法
1.1 對象 選擇溫州醫科大學附屬康寧醫院2009年4月至2016年10月住院的468例慢性精神分裂癥患者為觀察組,其中男313例,女 155例;年齡 20~70(50.8±9.8)歲;受教育年限 6~19(9.3±2.4)年;病程 5~52(26.7 ±9.5)年。入組標準:(1)符合《美國精神障礙診斷與統計手冊第四版》(DSM-Ⅳ)精神分裂癥的診斷標準;(2)病程 5 年以上;(3)年齡為 20~70 歲;(4)小學以上文化程度;(5)病情穩定,近3個月無換藥計劃。排除明確患有任何軀體疾病者、有過敏史者、妊娠期或哺乳期婦女。在醫院附近社區招募年齡、性別、受教育年限與觀察組相匹配的319例健康志愿者為對照組,其中男215例,女104 例;年齡 21~70(48.6±11.4)歲;受教育年限 5~19(9.6±2.9)年。入組標準:(1)既往或目前無精神疾病史及精神疾病家族史;(2)無中樞神經系統疾病;(3)無酒精或其他物質依賴史;(4)小學以上文化程度。排除標準與觀察組相同。本研究經溫州醫科大學附屬康寧醫院倫理委員會批準,研究對象或家屬均簽署知情同意書。
1.2 方法
1.2.1 認知功能評估 使用DSM-Ⅳ軸Ⅰ臨床定式檢查工具診斷精神分裂癥患者,收集其社會人口學資料。采用重復性成套神經心理狀態測驗(RBANS)評估被試者的認知功能,包括即刻記憶、視覺廣度、注意、言語功能、延遲記憶等5個分量表,由心理學專業的研究生操作;采用陽性與陰性癥狀量表(PANSS)評估患者精神病性癥狀,內容包括陽性癥狀、陰性癥狀、一般精神病理等3個方面,由臨床經驗豐富的精神科醫師給予評定。
1.2.2 基因組DNA的提取 采集靜脈血5ml,使用美國Promega公司提取DNA試劑盒,提取外周血基因組DNA,分裝后置-80℃保存。
1.2.3 TNF-α-1031 T/C多態性位點的檢測 采用聚合酶鏈式反應-限制性酶切片段長度多態性(PCR-RFLP)法。PCR擴增含有多態性位點長度為270bp的片段,上游引物:5′-GGGAGAACAAAAGGATAAG-3′,下游引物:5′-CCCCATACTCGACTTTCATA-3′。擴增后的 PCR產物經過Bbs I過夜酶切,經1.5%瓊脂糖電泳,根據消化所得片段大小分別檢出-1031T/C多態性位點的基因型。T等位基因為 270bp,C等位基因為 159bp和111bp。
1.3 統計學處理 應用SHEsis統計軟件,觀察組與對照組的Hardy-Weinberg遺傳平衡檢驗、兩組間等位基因及基因型分布頻率的比較,采用χ2檢驗。應用SPSS19.0統計軟件,TT基因型與TC/CC基因型的精神分裂癥患者性別比較,采用χ2檢驗;年齡、發病年齡、病程、PANSS及RBANS比較,采用配對樣本t檢驗。精神分裂癥患者發病年齡與認知功能的關系采用Pearson相關分析。中介效應分析采用溫忠麟等[13]基于依次檢驗和Sobel檢驗提出的一個使用的中介效應檢測程序,該程序主要包括Baron和Kenny部分中介檢驗、Judd和Kenny完全中介檢驗以及Sobel檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 Hardy-Weinberg遺傳平衡檢驗結果 觀察組(χ2=0.269,P=0.604)與對照組(χ2=0.693,P=0.405)TNF-α-1031 T/C位點分布符合遺傳平衡定律,提示該樣本具有一定的代表性。
2.2 兩組TNF-α-1031 T/C等位基因及基因型分布頻率比較 觀察組與對照組T/C等位基因及基因型分布頻率比較,差異均無統計學意義(均P>0.05),見表1。
2.3 精神分裂癥患者TNF-α-1031 T/C基因多態性與精神病性癥狀、認知功能的關系 TT基因型與TC+CC基因型的患者年齡,性別,病程,PANSS總分及各因子得分,RBANS的注意、言語功能及延遲記憶等分量表得分比較,差異均無統計學意義(均P>0.05)。TT基因型患者發病年齡小于TC+CC基因型患者,RBANS總分及即刻記憶、視覺廣度等分量表得分均低于TC+CC基因型患者,差異均有統計學意義(均P<0.05),見表2。

表1 兩組TNF-α-1031 T/C等位基因及基因型分布頻率比較[例(%)]
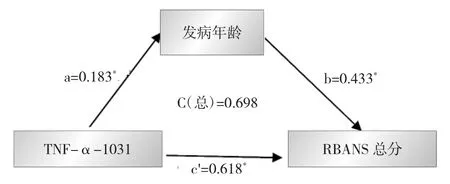
圖2 精神分裂癥患者TNF-α-1031 C/T基因多態性、發病年齡和認知功能間的中介效應分析模型(a、b、c'分別是指路徑分析中的標準回歸系數,C=c'+a×b)

表2 精神分裂癥患者TNF-α-1031 T/C等位基因與精神病性癥狀、認知功能的關系(n=468)
2.4 精神分裂癥患者發病年齡與認知功能的關系 對精神分裂癥患者發病年齡與認知功能的關系進行偏相關分析(校正年齡、性別、教育年限、抗精神病藥物等混雜因素),結果發現患者發病年齡與RBANS總分及注意、即刻記憶、延遲記憶等分量表得分均呈正相關(r=0.179、0.102、0.154 和 0.134,均 P<0.05),與視覺廣度、言語功能分量表得分均未見相關(r=0.149和0.138,均P >0.05),見圖 1(插頁)。
2.5 精神分裂癥患者TNF-α-1031 T/C基因多態性、發病年齡與認知功能間的中介效應分析 精神分裂癥患者TNF-α-1031 T/C基因多態性與發病年齡相關,發病年齡又與認知功能相關,因此本研究通過中介效應分析來探討TNF-α-1031 T/C基因多態性、發病年齡與認知功能間的復雜關系。以RBANS總分為因變量,TNF-α-1031 T/C基因多態性為自變量,發病年齡為調節變量,年齡、性別、受教育年限等為協變量作中介效應分析模型,差異有統計學意義(R2=0.13,P<0.01),說明發病年齡在認知功能損害中發揮了部分中介的作用。中介效應分析模型見圖2。
3 討論
認知功能是指個體認識事物和現象的能力,包括信息處理速度、記憶、注意、執行功能等。精神分裂癥患者的認知功能損害可能與過度激活的免疫反應-慢性炎癥狀態有關,但免疫系統與認知功能的關系只有極少的實驗室證據。細胞因子作為信號分子,介導免疫系統應對外界感染和應激過程,同時在免疫系統-神經系統間的交流中起著關鍵作用,從而參與精神分裂癥的病理、生理過程[14]。本研究探討TNF-α-1031 C/T基因多態性與精神分裂癥患者認知功能的關系,結果表明此位點基因多態性能夠對患者造成廣泛但不是所有神經認知領域的影響。
在中樞神經系統中,TNF-α主要是由小膠質細胞和星形膠質細胞分泌的促炎性細胞因子,能夠參與神經系統的免疫反應,同時還可以促進神經細胞的生長、分化和凋亡[15]。有文獻報道衰老和老年性癡呆患者的TNF-α水平明顯高于健康對照組[16]。多項研究結果發現精神分裂癥患者TNF-α水平發生明顯改變,并參與病理、生理過程[17]。最近GWAS研究發現,TNF-α和TNF-α受體相關的信號通路基因參與了精神分裂癥的發病[18]。TNF-α基因多態性位點可影響其基因的表達水平,而研究發現-1031 C/T基因多態性可影響蛋白水平的表達。本研究發現TNF-α-1031 C/T基因多態性與精神分裂癥患者的認知功能相關,提示TNF-α相關炎癥信號通路可能參與了精神分裂癥患者的認知功能損害。在中樞神經系統發育的關鍵時期,TNF-α水平的改變影響了神經發育的進程,從而引起腦部神經結構和功能的異常,并導致認知功能損害。本研究中,筆者確實也發現TNF-α-1031 C/T基因多態性與精神分裂癥患者的發病年齡有關,TT基因型的患者發病年齡明顯早于CC+TC基因型患者。可見,發病年齡與認知功能損害有關,發病年齡越早,其認知功能損害程度越嚴重。因此,筆者推測TNF-α-1031 C/T基因多態性可導致神經發育異常,攜帶T等位基因的精神分裂癥患者的發病年齡較小,這部分患者的認知功能損害就更為嚴重且廣泛。以上是本研究的推測,還需要建立動物模型的基礎研究給予更多的證據。
本研究探討了TNF-α-1031 C/T基因多態性與精神分裂癥患者發病年齡、認知功能的關系,為神經炎癥在認知功能損害中的作用機制提供了進一步的佐證。但本研究尚存在以下局限性:(1)本研究對象是慢性精神分裂癥患者,服用藥物及病程等混雜因素會潛在影響認知功能;(2)細胞因子在體內以網絡的形式協同工作的,本研究只分析一種促炎性細胞因子,無法說明整個免疫系統細胞因子對認知功能的影響;(3)TNF-α基因上有多個基因多態性位點,本研究中只選取了一個,且未檢測外周血TNF-α水平。因此,今后仍需收集首發精神分裂癥患者的臨床資料,且以更大的樣本量來研究多個細胞因子基因多態性對認知功能的影響。
[1]周晨輝,王志仁,劉小蕾,等.組胺能系統與精神分裂癥相關認知功能障礙的研究進展[J].中華精神科雜志,2015,48(6):372-374.
[2]劉璇,王惠玲,方悅,等.精神分裂癥首次發病患者的執行功能和學習能力[J].中華精神科雜志,2011,44(1):32-35.
[3]Condray R,Yao JK.Cognition,dopamine and bioactive lipids in schizophrenia[J].Frontiers in Bioscience,2011,3(1):298-330.
[4]Morrison G,O'Carroll R,McCreadie R.Long-term course of cognitive impairment in schizophrenia[J].Br J Psychiatry,2006,189(6):556-557.
[5]Ribeiro-Santos A,Lucio TA,Salgadoand JV.Evidence for an immune role on cognition in schizophrenia:a systematic review[J].Curr Neuropharmacol,2014,12(3):273-280.
[6]Gorelick PB.Role of inflammation in cognitive impairment:results of observational epidemiological studies and clinical trials[J].Ann N YAcad Sci,2010,1207(1):155-162.
[7]Passos GR,Douglas S,Jefferson B,et al.Th17cells pathways in multiple sclerosis and neuromyelitis optica spectrum disorders:pathophysiological and therapeutic implications[J].Mediators Inflamm,2016(7):1-11.
[8]Goldeck D,Douglas S,Jefferson B,et al.Peripheral immune signatures in alzheimer disease[J].Curr Alzheimer Res,2016,13(7):739.
[9]Barbosa IG,Rocha NP,Huguet RB,et al.Executive dysfunction in euthymic bipolar disorder patientsand its association with plasma biomarkers[J].J Affect Disord,2012,137(1-3):151-155.
[10]Goldsmith DR,Rapaport MH,Miller BJ.A meta-analysis of blood cytokine network alterations in psychiatric patients:comparisons between schizophrenia,bipolar disorder and depression[J].MolPsychiatry,2016,21(12):1696.
[11]Zhang XY,Haile CN,Tan YL,et al.Tumour necrosis factor alpha polymorphism (-1031T/C)is associated with age of onset of schizophrenia[J].MolPsychiatry,2005,10(10):897-899.
[12]邢曉萍,徐林群,盧衛紅,等.早發與非早發精神分裂癥認知功能比較研究[J].神經疾病與精神衛生,2012,12(1):9-11.
[13]溫忠麟,張雷,侯杰泰.中介效應檢驗程度及其應用[J].心理學報,2004,36(5):614-620.
[14]Altamura AC,BuoliM,PozzoliS.Role of immunologicalfactors in the pathophysiology and diagnosis of bipolar disorder:comparison with schizophrenia[J].Psychiatry Clin Neurosci,2014,68(1):21-36.
[15]Beattie MS,Hermann GE,Rogers RC,et al.Cell death in models of spinalcord injury[J].Prog Brain Res,2002,137:37-47.
[16]March R,Dieset I,Faerden A,et al.Persistent increase in TNF and IL-1 markers in severe mental disorders suggests trait-related inflammation:A one year follow-up study[J].Acta Psychiatr Scand,2017,136:400-408.
[17]Misiak B,Staczykiewicz B,Kotowicz K,et al.Cytokines and C-reactive protein alterations with respectto cognitive impairment in schizophrenia and bipolar disorder:A systematic review[J].Schizophr,Res,2017.doi:org/10.1016/j.schres.2017.04.015.
[18]Jia P,Wang L,Meltzer HY,et al.Common variants conferring risk of schizophrenia:A pathway analysis of GWAS data[J].Schizophr Res,2010,122(1-3):38-42.

