姜黃素對人巨細(xì)胞病毒感染人胚肺成纖維細(xì)胞后細(xì)胞凋亡的影響
賈陽杰 呂亞麗 劉麗宏
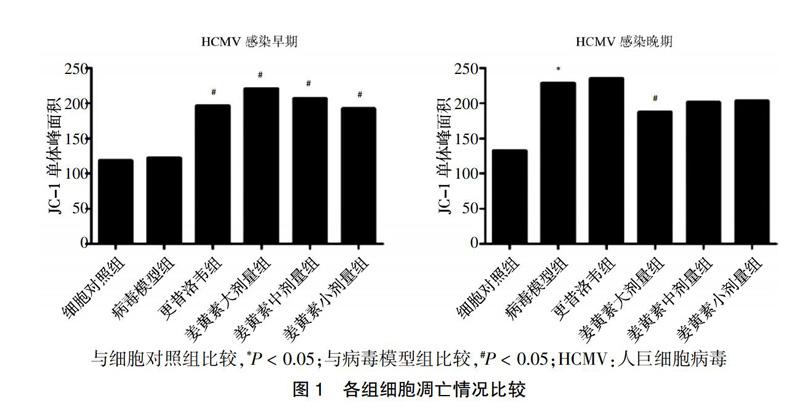
[摘要] 目的 探討人巨細(xì)胞病毒(HCMV)感染人胚肺成纖維細(xì)胞后細(xì)胞凋亡情況,以及姜黃素對HCMV感染細(xì)胞后細(xì)胞凋亡的影響。 方法 將細(xì)胞分為細(xì)胞對照組(細(xì)胞維持液),病毒模型組(細(xì)胞維持液+HCMV),姜黃素大(細(xì)胞維持液+HCMV+姜黃素0.8 μg/mL)、中(細(xì)胞維持液+HCMV+姜黃素0.4 μg/mL)、小(細(xì)胞維持液+HCMV+姜黃素0.2 μg/mL)劑量組,更昔洛韋組(細(xì)胞維持液+HCMV+更昔洛韋50 μg/mL),運(yùn)用線粒體膜電位檢測試劑盒(JC-1)和熒光染料碘化丙啶(PI)法檢測姜黃素對HCMV感染的細(xì)胞凋亡的影響。 結(jié)果 JC-1法實(shí)驗結(jié)果顯示:HCMV感染早期,病毒模型組細(xì)胞凋亡情況與細(xì)胞對照組比較,差異無統(tǒng)計學(xué)意義(P > 0.05);與病毒模型組比較,更昔洛韋組和姜黃素大、中、小劑量組細(xì)胞凋亡顯著增加(P < 0.05)。HCMV感染晚期,與細(xì)胞對照組比較,病毒模型組細(xì)胞凋亡顯著增加(P < 0.05);與病毒模型組比較,姜黃素大、中、小劑量組細(xì)胞凋亡均有不同程度降低,其中姜黃素大劑量組與病毒模型組比較差異有統(tǒng)計學(xué)意義(P < 0.05)。熒光染料PI法實(shí)驗結(jié)果顯示:在HCMV感染早期及晚期,與細(xì)胞對照組比較,病毒模型組S期細(xì)胞顯著增多(P < 0.01);與病毒模型組比較,姜黃素大、中、小劑量組S期細(xì)胞均明顯減少(P < 0.05)。 結(jié)論 姜黃素能夠?qū)笻CMV感染引起的細(xì)胞凋亡作用,可使HCMV感染早期誘導(dǎo)的抗凋亡作用和HCMV感染晚期誘導(dǎo)的促凋亡作用減弱。
[關(guān)鍵詞] 姜黃素;人巨細(xì)胞病毒;細(xì)胞周期;細(xì)胞凋亡
[中圖分類號] R285.5 [文獻(xiàn)標(biāo)識碼] A [文章編號] 1673-7210(2018)12(a)-0004-07
細(xì)胞凋亡(apoptosis),又稱程序性細(xì)胞死亡(programmed cell death,PCD)是指細(xì)胞主動死亡的現(xiàn)象。機(jī)體出現(xiàn)細(xì)胞凋亡主要是為了能夠保持組織、器官的正常形態(tài)、功能和內(nèi)環(huán)境的穩(wěn)態(tài)[1]。大量實(shí)驗研究發(fā)現(xiàn),機(jī)體感染人巨細(xì)胞病毒(HCMV)后產(chǎn)生的臨床表現(xiàn),跟PCD的發(fā)生密切相關(guān)[2]。
HCMV是β皰疹病毒亞科的雙鏈線狀DNA病毒。在大多數(shù)發(fā)達(dá)國家,大約50%的成年人既往感染HCMV,在世界發(fā)展中地區(qū),HCMV感染在大齡兒童和成年人群中甚至高達(dá)90%~100%[3]。HCMV一旦侵入人體將長期或終身存在于體內(nèi),正常人一般為潛伏感染或無癥狀的亞臨床感染,而在放化療后、器官移植術(shù)后的腫瘤患者等免疫功能不全或低下的易感人群中,感染HCMV后常常引起多系統(tǒng)的病變,甚至造成致死性的危險[4]。
研究發(fā)現(xiàn),HCMV感染后,機(jī)體的免疫系統(tǒng)并不能將其全部消滅清除,并且HCMV還可以潛伏于細(xì)胞中[5]。HCMV與PCD密切相關(guān)且兩者之間的聯(lián)系較為復(fù)雜,研究者發(fā)現(xiàn),HCMV感染后,在不同的條件下,既可表現(xiàn)為抑制細(xì)胞的凋亡,也可表現(xiàn)為加快細(xì)胞的凋亡[6]。姜黃素是從姜黃屬中提取出的一種酚性色素,具有抗炎、抗氧化、抗腫瘤、抗病毒等藥理作用。故本研究擬通過運(yùn)用線粒體膜電位檢測試劑盒(JC-1)和熒光染料碘化丙啶(PI)的方法來探討HCMV感染人胚肺成纖維細(xì)胞后細(xì)胞凋亡情況,以及姜黃素對HCMV感染細(xì)胞后細(xì)胞凋亡的影響。
1 材料與方法
1.1 病毒及細(xì)胞
HCMV AD169株由華中科技大學(xué)同濟(jì)醫(yī)學(xué)院附屬同濟(jì)醫(yī)院婦科和兒科臨床病毒研究室提供。人胚肺成纖維細(xì)胞(HELF株)購自國家實(shí)驗細(xì)胞資源中心,實(shí)驗所用細(xì)胞為20~25代細(xì)胞。
1.2 藥物
注射用更昔洛韋(GCV)(美國Sigma公司,貨號:Y0001129);姜黃素單體(批號:062-20170321,含量99.116%)由首都醫(yī)科大學(xué)附屬北京朝陽醫(yī)院(以下簡稱“我院”)藥事部自制;姜黃飲片來自江西江中中藥飲片有限公司,由我院中草藥房藥師鑒定為真品,批號:160801,GMP證號:贛JX20120017。
1.3 主要試劑及儀器
MEM培養(yǎng)基購自美國HyClone公司;二甲基亞砜(DMSO)、胎牛血清(FBS)、胰蛋白酶、青霉素G(Penicillin G)、Hank′s液、鏈霉素(Streptomycin)、羥乙基哌嗪乙硫磺酸(HEPES)均購自美國Sigma-Aldrich公司;JC-1購自北京泛博生物化學(xué)有限公司;PI染色液購自美國Sigma公司;流式細(xì)胞儀購自美國BD公司。細(xì)胞培養(yǎng)液為MEM培養(yǎng)基+Penicillin G(100 U/mL)+Streptomycin(100 μg/mL)+10%FBS。細(xì)胞維持液為MEM培養(yǎng)基+Penicillin G(100 U/mL)+Streptomycin(100 μg/mL)+2%FBS。
1.4 JC-1法檢測細(xì)胞凋亡
將HELF細(xì)胞在96孔板中培養(yǎng)成單層細(xì)胞,將細(xì)胞分為六組,分別為細(xì)胞對照組(細(xì)胞維持液),病毒模型組(細(xì)胞維持液+HCMV),姜黃素大劑量組(細(xì)胞維持液+HCMV+姜黃素0.8 μg/mL)、中劑量組(細(xì)胞維持液+HCMV+姜黃素0.4 μg/mL)和小劑量組(細(xì)胞維持液+HCMV+姜黃素0.2 μg/mL)、更昔洛韋組(細(xì)胞維持液+HCMV+GCV 50 μg/mL),更昔洛韋為陽性對照藥。病毒感染滴度為100 TCID50/孔,細(xì)胞孵育箱中培養(yǎng)1 h后去棄去病毒液。將以上六組細(xì)胞置于37℃、5% CO2培養(yǎng)箱中培養(yǎng),分別于感染早期(≤12 h)和感染晚期(≥48 h)收集細(xì)胞,依據(jù)試劑盒說明書操作,進(jìn)行細(xì)胞凋亡檢測。實(shí)驗過程至少進(jìn)行3次。
1.5 流式細(xì)胞術(shù)檢測細(xì)胞周期
將HELF細(xì)胞在96孔板中培養(yǎng)成單層細(xì)胞后,同步化培養(yǎng)12 h;約100 TCID50/孔病毒滴度感染細(xì)胞,于37℃、5% CO2培養(yǎng)箱中吸附1~2 h,棄上清;細(xì)胞對照組和病毒模型組更換維持液繼續(xù)培養(yǎng);姜黃素各組終濃度分別為大劑量組(細(xì)胞維持液+HCMV+姜黃素0.8 μg/mL)、中劑量組(細(xì)胞維持液+HCMV+姜黃素0.4 μg/mL)和小劑量組(細(xì)胞維持液+HCMV+姜黃素0.2 μg/mL);更昔洛韋組(細(xì)胞維持液+HCMV+GCV 50 μg/mL)。置于37℃、5% CO2培養(yǎng)箱中培養(yǎng),分別于感染早期(≤12 h)和感染晚期(≥48 h)收集細(xì)胞。將收集的細(xì)胞制成單層細(xì)胞懸液,用預(yù)冷的PBS漂洗2次,1000 r/min離心5 min,加入預(yù)冷的70%乙醇,于4℃固定過夜后,PBS洗滌,離心后去除固定液,加PI染色液(含50 μg/mL PI、100 μg/mL RNase A、0.2% Triton X-100)置于4℃避光孵育30 min后即可進(jìn)行細(xì)胞周期分析。實(shí)驗過程至少進(jìn)行3次。
1.6 統(tǒng)計學(xué)方法
應(yīng)用SPSS 21.0統(tǒng)計軟件處理數(shù)據(jù),計量資料以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,采用單因素方差分析(One-way ANOVA),兩兩比較采用LSD-t法和Dunnett-t法。以P < 0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 各組細(xì)胞凋亡情況比較
HCMV感染早期,病毒模型組與細(xì)胞對照組的細(xì)胞凋亡情況比較,差異無統(tǒng)計學(xué)意義(P > 0.05);與病毒模型組比較,更昔洛韋組和姜黃素大、中、小劑量組細(xì)胞凋亡明顯增加(P < 0.05)。HCMV感染晚期,與細(xì)胞對照組比較,病毒模型組細(xì)胞凋亡明顯增加(P < 0.05);與病毒模型組比較,姜黃素大、中、小劑量組細(xì)胞凋亡均有不同程度降低,其中姜黃素大劑量組與病毒模型組比較差異有統(tǒng)計學(xué)意義(P < 0.05)。見圖1。
2.2 不同感染時期各組細(xì)胞周期情況比較
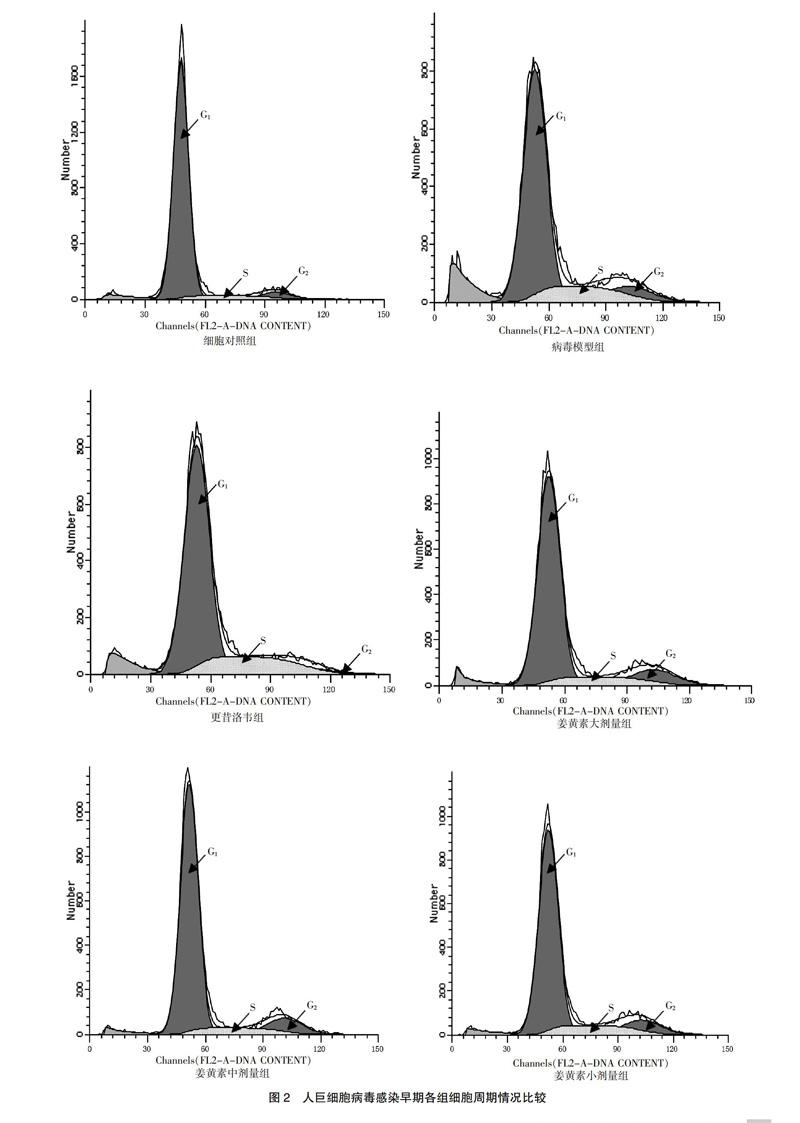
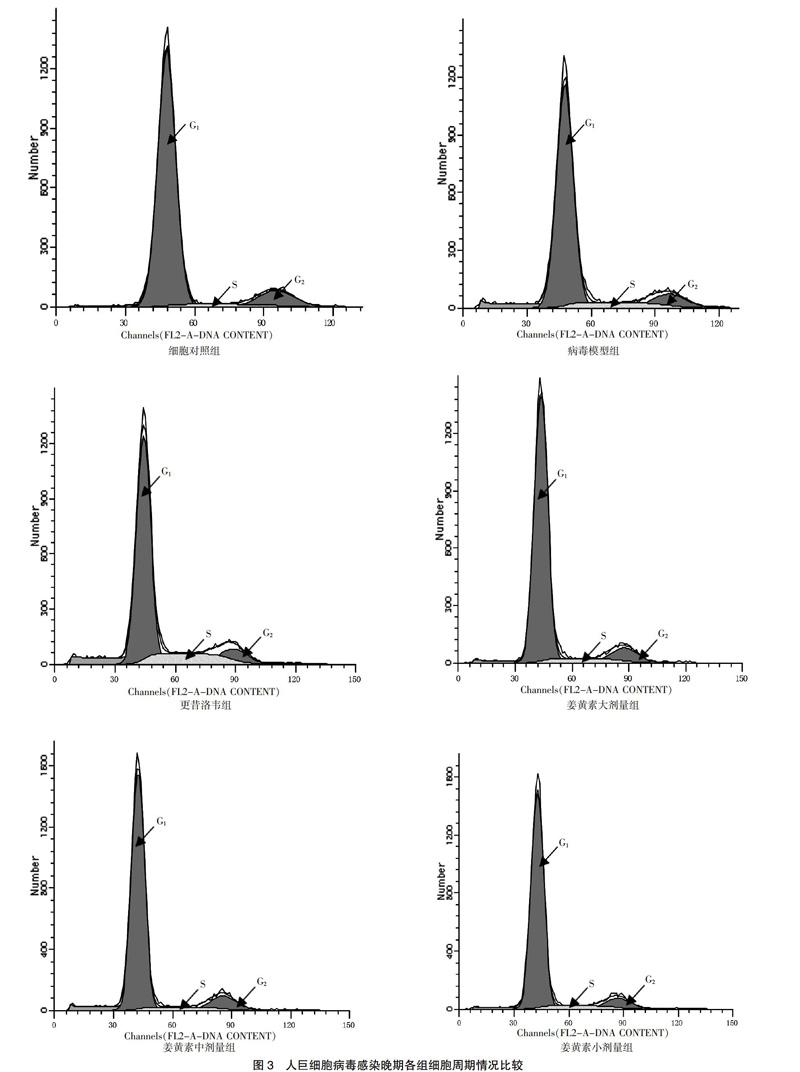
在HCMV感染早期及晚期,與細(xì)胞對照組比較,病毒模型組S期細(xì)胞顯著增多(P < 0.01);與病毒模型組比較,姜黃素大、中、小劑量組S期細(xì)胞均明顯減少,而更昔洛韋組S期細(xì)胞明顯增多,G0/G1期細(xì)胞明顯減少(P < 0.05)。見圖2~3、表1。
3 討論
HCMV感染機(jī)體后,感染的細(xì)胞一般都處于不同的細(xì)胞周期。如果HCMV感染了處于G0/G1期的細(xì)胞,則細(xì)胞只能進(jìn)入到G1/S期;如果HCMV感染了處于S期的細(xì)胞,則細(xì)胞會一直處于S期,表現(xiàn)為停滯狀態(tài),最終導(dǎo)致細(xì)胞的有絲分裂停止[7]。本研究結(jié)果顯示在HCMV感染早期,病毒模型組S期細(xì)胞較細(xì)胞對照組明顯增多,而處于G0/G1期的細(xì)胞較細(xì)胞對照組有所減少。隨著感染時間延長,宿主細(xì)胞均表現(xiàn)為G2/M期細(xì)胞有所減少。經(jīng)過姜黃素干預(yù)治療后,姜黃素各劑量組處于S期細(xì)胞均明顯少于病毒對照組,G0/G1期細(xì)胞均有所增多,細(xì)胞凋亡沒有增加。
HCMV感染機(jī)體后,機(jī)體細(xì)胞發(fā)生凋亡,細(xì)胞死亡后機(jī)體會清除這些細(xì)胞,這是機(jī)體抵抗病毒感染對機(jī)體造成損傷的一種機(jī)制。有研究發(fā)現(xiàn)在HCMV感染初期,HCMV為了阻止機(jī)體細(xì)胞凋亡,會轉(zhuǎn)錄表達(dá)某些蛋白以阻止細(xì)胞凋亡[8],從而保證病毒復(fù)制增殖能夠順利進(jìn)行,病毒的這種適應(yīng)性為其持續(xù)感染創(chuàng)建了有利的環(huán)境。機(jī)體感染HCMV后,病毒可能是通過作用于一些調(diào)節(jié)細(xì)胞周期的細(xì)胞因子從而造成細(xì)胞正常周期的改變,比如感染后使細(xì)胞內(nèi)細(xì)胞周期蛋白E(cyclin E)的表達(dá)上調(diào),使細(xì)胞周期蛋白依賴性激酶(CDK)和周期蛋白依賴性激酶抑制因子(CKIs)活性均發(fā)生改變等[9]。有研究發(fā)現(xiàn)處于S期的二倍體纖維母細(xì)胞感染HCMV后細(xì)胞表現(xiàn)出周期停滯,并且還出現(xiàn)病理性有絲分裂[10]。Murphy等[11]的實(shí)驗結(jié)果與上述研究結(jié)果一致。Lunaldi等[12]研究證實(shí)抗HCMV抗體與內(nèi)皮細(xì)胞激活和凋亡有關(guān)的分子基因程序的表達(dá)有關(guān),可以促進(jìn)熱休克蛋白60(HSP60)的釋放,這可能是抗HCMV抗體促凋亡的另一分子機(jī)制。黃晨等[13]研究發(fā)現(xiàn),HCMV可以導(dǎo)致人臍靜脈血管內(nèi)皮細(xì)胞增殖并且使宿主細(xì)胞處于G1期的細(xì)胞減少,進(jìn)而推測HCMV感染可能促進(jìn)了G0/Gl期細(xì)胞進(jìn)入S期和G2/M期,細(xì)胞最終表現(xiàn)為增殖。有研究者發(fā)現(xiàn)HCMV感染后,抗凋亡蛋白Bcl-2表達(dá)明顯增多,運(yùn)用更昔洛韋進(jìn)行治療后,Bcl-2含量明顯減少,并且HCMV引起的抗凋作用明顯下降[14]。在HCMV病毒感染晚期,病毒對細(xì)胞凋亡的抑制作用解除,反而促進(jìn)細(xì)胞發(fā)生凋亡,以便病毒釋放。細(xì)胞感染后HCMV可以潛伏于細(xì)胞中,造成免疫系統(tǒng)的長期激活,改變免疫狀態(tài),從而引發(fā)機(jī)體產(chǎn)生多種慢性炎癥性疾病[15-16]。HCMV感染機(jī)體后患者會表現(xiàn)出視網(wǎng)膜炎,用更昔洛韋治療此類患者后,視網(wǎng)膜上皮細(xì)胞凋亡明顯受到抑制。Zhou等[17]發(fā)現(xiàn),與感染前比較,感染HCMV的平滑肌細(xì)胞(SMCs)的增殖明顯提高。2005年,Reinhardt課題組[18]也得到了相同的實(shí)驗結(jié)果。有研究發(fā)現(xiàn),HCMV感染SMCs后,細(xì)胞內(nèi)p53的含量減少,SMCs的凋亡受到抑制[19]。同時Epstein等[20]也證實(shí)了這一點(diǎn),即HCMV可以調(diào)控SMCs p53的基因表達(dá),從而減少SMCs細(xì)胞的凋亡。Liao等[21]研究結(jié)果進(jìn)一步表明HCMV感染可以影響內(nèi)皮細(xì)胞和平滑肌細(xì)胞的自然凋亡過程。相關(guān)研究發(fā)現(xiàn),姜黃素具有顯著抗HCMV的作用[22-23],但具體機(jī)制不清。本研究發(fā)現(xiàn)姜黃素能夠?qū)笻CMV感染引起的細(xì)胞凋亡作用,可使HCMV感染早期誘導(dǎo)的抗凋亡作用和HCMV感染晚期誘導(dǎo)的促凋亡作用減弱。
[參考文獻(xiàn)]
[1] Wyllie AH,Kerr JF,Currie AR. Cell death:the significance of apoptosis [J]. Int Rev Cytol,1980,68:251-306.
[2] Cinatl J Jr,Scholz M,Doerr HW. Role of tumor cell immune escape mechanisms in cytomegalovirus-mediated oncomodulation [J]. Med Res Rev,2005,25(2):167-185.
[3] 郭麗麗,許紅梅.人巨細(xì)胞病毒感染的流行病學(xué)研究進(jìn)展[J].國際檢驗醫(yī)學(xué)雜志,2010,31(10):1131-1133.
[4] Ritter JT,Tang-Feldman YJ,Lochhead GR,et al. In vivo characterization of cytokine profiles and viral load during murine cytomegalovirus-induced acute myocarditis [J]. Cardiovasc Pathol,2010,19(2):83-93.
[5] Frantzeskaki FG,Karampi ES,Kottaridi C,et al. Cytomeg-alovirus reactivation in a general,nonimmunosuppressed intensive care unit population:Incidence,risk factors,associations with organ dysfunction,and inflammatory biomarkers [J]. J Crit Care,2015,30(2):276-281.
[6] Reuter JD. Cytomegalovirus induces T-cell independent apoptosis in brain during immunodeficiency [J]. J Clin Virol,2005,32(3):218-223.
[7] 劉志峰.巨細(xì)胞病毒對細(xì)胞周期的影響及其機(jī)制[J].國外醫(yī)學(xué)病毒學(xué)分冊,2002,9(4):104-107.
[8] Sedger LM,Shows DM,Blanton RA,et al. IFN-gamma mediates a novel antiviral activity through dynamic modulation of TRAIL and TRAIL receptor expression [J]. J Immunol,1999,163(2):920-926.
[9] Salvant BS,F(xiàn)ortunato EA,Spector DH. Cell cycle dysregulation by human cytomegalovirus influence of the cell cycle phase at the time of infection and effects on cyclin transcription [J]. J Virol,1998,72(5):3729-3741.
[10] Barsukova AS,F(xiàn)edorova NE,Medzhidova AA,et al. Effect of cytomegalovirus on cell cycle progression and formation of pathological mitoses in cultured human diploid fibroblasts [J]. Ontogenez,2001,32(1):29-34.
[11] Murphy EA,Streblow DN,Nelson JA,et al. The Human Cytomegalovirus IE86 Protein Can Block Cell Cycle Progression after Inducing Transition into the S Phase of Permissive Cells [J]. J Virol,2000,74(15):7108-7118.
[12] Lunardi C,Dolcino M,Peterlana D,et al. Endothelial Cells Activation and Apoptosis Induced by a Subset of Antibodies against Human Cytomegalovirus:Relevance to the Pathogenesis of Atherosclerosis [J]. PLoS One,2007,2(5):e473.
[13] 黃晨,張榮懷,王曉明,等.人巨細(xì)胞病毒感染對人臍靜脈內(nèi)皮細(xì)胞凋亡和周期的影響[J].中國臨床康復(fù),2005,9(27):56-58.
[14] Brice?觡o J,de la Torre-Cisneros J,Alvarez-Kindelan A,et al. Antiviral drigs can inhibit lymphocyte apoptosis induced by cytomegalovirus antigens [J]. Transplant Proc,2001,33(1-2):1799-1800.
[15] Popovic M,Smiljanic K,Dobutovic B,et al. Humancytomegalovirus infection and atherothrombosis [J]. J Thromb Thrombolysis,2012,33(2):160-172.
[16] Soderberg-Naucler C. HCMV microinfections in inflammatory diseases and cancer [J]. J Clin Virol,2008,41(3):218-223.
[17] Zhou YF,Yu ZX,Wanishsawad C,et al. The immediate early gene products of human cytomegalovirus increase vascular smooth muscle cell migration,proliferation,and expression of PDGF beta-receptor [J]. Biochem Biophys Res Commun,1999,256(3):608-613.
[18] Reinhardt B,Mertens T,Mayr-Beyrle U,et al. HCMV infection of human vascular smooth muscle cells leads to enhanced expression of functionally intact PDGF beta -receptor [J]. Cardiovasc Res,2005,67(1):151-160.
[19] Speir E,Shibutani T,Yu ZX,et al. Role of reactive oxygen intermediates in cytomegalovirus gene expression and in the response of human smooth muscle cells to viral infection [J]. Circ Res,1996,79(6):1143-1152.
[20] Epstein SE,Speir E,Zhou YF,et al. The role of infection in restenosis and atherosclerosis:focus on cytomegalovirus [J]. Lancet,1996,348(s1):s13-s17.
[21] Liao XH,Dong X,Wu C,et al. Human cytomegalovirus immediate early protein 2 enhances myocardin-mediated survival of rat aortic smooth muscle cells [J]. Virus Res,2014,192:85-91.
[22] Lv Y,An Z,Chen H,et al. Mechanism of Gxe062 resistance to human cytomegalovirus in HELF cells [J]. BMC complement Altern Med,2014,14:284.
[23] Lv Y,Lei N,Wang D,et al. Protective effect of Gxe062 againstcytomegalovirus infection in Balb/c mice [J]. Environ Toxicol Pharmacol,2014,37(3):1140-1147.
(收稿日期:2018-04-24 本文編輯:羅喬荔)

