急性腦出血患者早期外周血干擾素-γ分泌水平與預(yù)后關(guān)系的研究
肖 勇,夏正新,張?zhí)K寧,凌 云,張志飛,周紅娟,方玉明
(上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院急診科 201900)
腦出血系指非外傷性原發(fā)性腦實質(zhì)內(nèi)出血,是一種發(fā)病率、致殘率及病死率都很高的急性腦血管病[1]。一旦出現(xiàn)腦出血,患者往往承擔(dān)較大的致殘風(fēng)險,因此對于預(yù)后的早期判斷就顯得很重要[2]。大量研究表明機(jī)體內(nèi)細(xì)胞因子水平與腦出血的病程變化及預(yù)后密切相關(guān)[3-4]。已有研究發(fā)現(xiàn)T 細(xì)胞及其分泌的細(xì)胞因子亦參與腦出血后的炎性反應(yīng)[5-8]。腦出血的預(yù)后是否與輔助T細(xì)胞(Th)1/Th2 型細(xì)胞因子相關(guān),現(xiàn)在并未完全明確。本研究擬通過檢測腦出血患者早期外周血中Th1/Th2 類細(xì)胞因子的表達(dá)水平,并且隨訪患者發(fā)病第1天及第30天的病情,分析 Th1/Th2 型細(xì)胞因子與腦出血病情預(yù)后的相互關(guān)系,為臨床早期及時有效的治療腦出血患者提供理論依據(jù)。
1 資料與方法
1.1一般資料 選取2015年7月至2016年8月在本院急診科住院的急性腦出血患者66例作為試驗組,體檢中心健康人群60例作為空白對照組,收集兩組相關(guān)臨床樣本。腦出血患者入選標(biāo)準(zhǔn):按照《中華醫(yī)學(xué)會第四屆全國腦血管病學(xué)術(shù)會議》腦血管病診斷標(biāo)準(zhǔn)及相關(guān)臨床標(biāo)準(zhǔn)。并按美國國立衛(wèi)生研究院卒中量表(National Institute of Health stroke scale,NIHSS)對腦出血患者發(fā)病第1天及第30天進(jìn)行病情評估。選擇NIHSS 評分為15~20分的患者進(jìn)行預(yù)后相關(guān)性分析(評分為0~42分,0~1為正常,1~4分為輕微,5~15分為中度,15~20分為中重度,20分以上為重度,選擇15~20分組可以有效觀察治療后的病情變化,其他組因變化無該組明顯故排除)。
1.2方法
1.2.1主要試劑 RPMI1640 及胎牛血清購自美國Gibco 公司。人淋巴細(xì)胞分離液購自達(dá)科為生物工程有限公司。ELISA 試劑盒[干擾素-γ(IFN-γ)、白細(xì)胞介素(IL)-2、IL-4及IL-10]均購自美國R&D公司。異硫氰酸熒光素(FITC)標(biāo)記抗人CD4抗體,PE標(biāo)記抗人IFN-γ及同型對照均購自eBioscience 公司。細(xì)胞固定劑和破膜劑Invitrogen公司產(chǎn)品。
1.2.2標(biāo)本收集 試驗組在發(fā)病第 1 天內(nèi)采集患者外周血10 mL,對照組采集健康體檢人群外周血10 mL,肝素抗凝,使用人淋巴細(xì)胞分離液在24 h內(nèi)采用Ficoll 密度離心法分離外周血單個核細(xì)胞(peripheral blood mononuclear cell,PBMC),方法可見參考文獻(xiàn)[9],得到PBMC 用含10%胎牛血清(FBS)的RPMI 1640調(diào)成1×106/mL水平,然后接種于6孔培養(yǎng)板,用于胞內(nèi)細(xì)胞因子的分析(流式檢測),并吸取最上層血漿,用于細(xì)胞因子的分析(ELISA檢測)。住院患者常規(guī)留取血標(biāo)本送檢本院臨檢科,包括檢測降鈣素原(PCT)指標(biāo)。
1.2.3血漿細(xì)胞因子的檢測 采用ELISA檢測,嚴(yán)格按ELISA 試劑盒的說明書進(jìn)行操作。以A值為縱坐標(biāo),以標(biāo)準(zhǔn)品水平為橫坐標(biāo),繪制標(biāo)準(zhǔn)曲線。通過曲線根據(jù)A值計算出IFN-γ、IL-2、IL-4和IL-10的水平,檢測結(jié)果以pg/mL表示,方法可見參考文獻(xiàn)[10]。
1.2.4CD4+T細(xì)胞內(nèi)細(xì)胞因子檢測 采用流式細(xì)胞儀(美國Beckman公司)檢測,收集分離PBMC細(xì)胞,磷酸緩沖鹽溶液(PBS)洗滌2次后收集,加入5 μL FITC-CD4抗體常溫暗處孵育20 min后;加1 mL PBS洗液,500 r/min離心5 min,棄上清,洗滌2次,使用100 μL固定劑固定15 min,PBS洗滌后加破膜劑100 μL作用10 min,破膜劑作用后直接加熒光素PE標(biāo)記抗人IFN-γ抗體5 μL,室溫暗處孵育30 min;加1 mL PBS洗液,500 r/min離心5 min,棄上清,洗滌2次,用PBS重懸至500 μL,上機(jī)檢測細(xì)胞熒光強(qiáng)度,方法可見參考文獻(xiàn)[9]。
1.2.5相關(guān)性分析 試驗組按NIHSS量表對腦出血患者發(fā)病第1天及第30天進(jìn)行病情評估。將發(fā)病第30天NIHSS評分與IFN-γ水平水平進(jìn)行相關(guān)性分析。
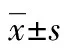
2 結(jié) 果
2.1兩組一般情況比較 試驗組與對照組在性別、年齡比較,差異無統(tǒng)計學(xué)意義(P>0.05),具有可比性,見表1。

表1 兩組一般臨床資料比較
2.2兩組外周血 IFN-γ、IL-2、IL-4及IL-10分泌水平比較 試驗組外周血中IFN-γ平均水平為(366.30±18.69)pg/mL高于對照組IFN-γ水平(178.30±25.83)pg/mL(t=13.18,P<0.05),見圖1A。試驗組外周血IL-2、IL-4、IL-10水平與對照組水平比較,差異無統(tǒng)計學(xué)意義(t=0.355、1.017、1.046;P=0.732、0.333、0.326),見圖1B、1C、1D。
2.3兩組外周血CD4+T細(xì)胞內(nèi)IFN-γ表達(dá)水平比較 試驗組外周血CD4+T細(xì)胞內(nèi)IFN-γ表達(dá)平均水平為(2.70±0.22)%,高于對照組(0.75±0.13)%,差異有統(tǒng)計學(xué)意義(t=15.50,P<0.05),見圖2。

a:P<0.05
圖1兩組外周血中的Th1/Th2類細(xì)胞因子分泌水平

a:P<0.05
圖2兩組外周血中CD4+T細(xì)胞內(nèi)IFN-γ表達(dá)水平

圖3 兩組體內(nèi)PCT水平
2.4兩組PCT表達(dá)水平比較 為了排除感染因素對外周血IFN-γ分泌水平影響,同時檢測兩組PCT水平,結(jié)果提示兩組PCT水平均在正常范圍,差異無統(tǒng)計學(xué)意義(P>0.05),見圖3。
2.5兩組外周血IFN-γ分泌水平與預(yù)后關(guān)系 為進(jìn)一步了解IFN-γ與預(yù)后的關(guān)系,對急性腦出血患者發(fā)病第1天NIHSS評分為(17.50±6.80)分,第30天評分為(6.32±4.30)分,并分析胞內(nèi)外IFN-γ分泌水平與第30天腦出血患者NIHSS評分相關(guān)性,發(fā)現(xiàn)腦出血患者早期外周血IFN-γ分泌水平與預(yù)后之間存在正向相關(guān)(r=0.741,P=0.014;r=0.687,P=0.045),見圖4。

圖4 病例組腦脊液中IFN-γ的水平與NIHSS評分相關(guān)性分析
3 討 論
腦出血是腦血管疾病中嚴(yán)重威脅人類健康的常見病,是最難治療的腦卒中之一[11]。腦出血造成腦組織損傷導(dǎo)致各種細(xì)胞因子水平異常,并通過體液作用于全身各個系統(tǒng)而發(fā)生全身炎性反應(yīng)綜合征,引起免疫功能紊亂和組織損傷[12]。大量研究表明Th1/Th2類細(xì)胞因子在調(diào)節(jié)各種急慢性腦出血炎癥變化過程中發(fā)揮極為重要的作用[13],Th1類細(xì)胞因子包括IFN-γ、IL-2、腫瘤壞死因子-α(TNF-α)和IL-12,主要介導(dǎo)細(xì)胞免疫反應(yīng)。Th2類細(xì)胞因子包括IL-4、IL-5、IL-6、IL-10和IL-13,主要參與體液免疫反應(yīng)。這些細(xì)胞因子根據(jù)機(jī)體不同狀態(tài)調(diào)節(jié)分泌水平保持機(jī)體免疫系統(tǒng)的動態(tài)平衡[14-15]。本研究發(fā)現(xiàn)急性腦出血患者外周血中IFN-γ 的水平較對照組顯著升高,差異有統(tǒng)計學(xué)意義(P<0.05),細(xì)胞因子IL-2、IL-4及IL-10差異無統(tǒng)計學(xué)意義(P>0.05)。為了排除感染因素對人體內(nèi)細(xì)胞因子水平影響,筆者同時分析了兩組PCT表達(dá)水平,結(jié)果提示兩組PCT均在正常范圍,差異無統(tǒng)計學(xué)意義(P>0.05)。進(jìn)一步研究發(fā)現(xiàn)急性腦出血患者外周血CD4+T細(xì)胞內(nèi)IFN-γ表達(dá)水平顯著升高(P<0.05),與上述結(jié)果一致,提示腦出血患者早期外周血IFN-γ分泌水平參與腦出血后的發(fā)病過程。
NIHSS是美國國立衛(wèi)生研究院卒中量表,為急性腦卒中的治療研究設(shè)計了一個15個項目的神經(jīng)功能檢查量表。它是從3個量表(Toronto Stroke Scale,Oxbury Initial Severity Scale,Cincinnati Stroke Scale)中選取有意義的項目組成一個量表,每個主要腦動脈病變可能對應(yīng)出現(xiàn)的神經(jīng)系統(tǒng)檢查項目(如視野評測大腦后動脈梗死),該量表已經(jīng)被國內(nèi)外多項研究作為判斷腦卒中預(yù)后的標(biāo)準(zhǔn)化量表[16]。
腦出血急性發(fā)作導(dǎo)致暫時性的缺血、缺氧,缺血、缺氧引起組織損傷導(dǎo)致細(xì)胞因子水平的動態(tài)平衡受到破壞[11]。研究表明IFN-γ在免疫炎癥中扮演重要角色,參與腦出血后的發(fā)病過程,可能是誘發(fā)急性腦出血病情惡化的原因之一[17-18]。為進(jìn)一步了解IFN-γ與預(yù)后的關(guān)系,在發(fā)病第30天對病例組人群進(jìn)行NIHSS評分,并與上述研究結(jié)果進(jìn)行相關(guān)性分析,結(jié)果發(fā)現(xiàn)急性腦出血患者早期外周血IFN-γ水平與發(fā)病第30天的NIHSS評分存在正相關(guān)(P<0.05),表明早期檢測急性腦出血患者外周血中 IFN-γ 水平可對判斷急性腦出血預(yù)后提供參考。
[1]LIU M,WU B,WANG W Z,et al.Stroke in China:epidemiology,prevention,and management strategies[J].Lancet Neurol,2007,6(5):456-464.
[2]趙冬.我國人群腦出血發(fā)病率、病死率的流行病學(xué)研究[J].中華流行病學(xué)雜志,2003,24(3):236-239.
[3]CHAMORRO,MEISEL A,PLANAS A M,et al.The immunology of acute stroke[J].Nat Rev Neurol,2012,8(7):401-410.
[4]CHEN T H,YANG Y C,WANG J C,et al.Curcumin treatment protects against renal ischemia and reperfusion Injury-Induced cardiac dysfunction and myocardial injury[J].Transplant Proc,2013,45(10):3546-3549.
[5]WANG X M,ZHANG Y G,LI A L,et al.Expressions of serum inflammatory cytokines and their relationship with cerebral edema in patients with acute basal ganglia hemorrhage[J].Eur Rev Med Pharmacol Sci,2016,20(13):2868-2871.
[6]SHI L J,QIN J,SONG B,et al.Increased frequency of circulating regulatory T cells in patients with acute cerebral hemorrhage[J].Neurosci Lett,2015,591(30):115-120.
[7]ZHU J F,PAUL W E.Peripheral CD4+ T-cell differentiation regulated by networks of cytokines and transcription factors[J].Immunol Rev,2010,238(1):247-262.
[8]KHANNA S,HEIGEL M,WEIST J,et al.Excessive α-tocopherol exacerbates microglial activation and brain injury caused by acute ischemic stroke[J].FASEB J,2015,29(3):828-836.
[9]TANG Y Y,WANG J L,ZHANG Y,et al.Correlation between low tapasin expression and impaired CD8+ T-cell function in patients with chronic hepatitis B[J].Mol Med Rep,2016,14(4):3315-3322.
[10]唐余燕,陳小華,湯正好,等.胞質(zhì)轉(zhuǎn)導(dǎo)肽-HBcAg18-27-Tapasin誘導(dǎo)C57BL/6小鼠T淋巴細(xì)胞分泌Th1型細(xì)胞因子及HBV特異性CTL的表達(dá)[J].細(xì)胞與分子免疫學(xué)雜志,2013,29(3):229-232.
[11]畢勝,劉群,范佳,等.腦出血患者外周血干擾素-γ、細(xì)胞免疫球蛋白黏蛋白分子-3 mRNA表達(dá)及意義[J].中國老年學(xué)雜志,2015,35(10):2674-2675.
[12]KESVB,SIMUNDICAM,NIKOLACN,etal.Pro-inflammatoryandanti-inflammatorycytokinesinacuteischemicstrokeandtheirrelationtoearly
neurological deficit and stroke outcome[J].Clin Biochem,2008,41(16):1330-1334.
[13]NAYAK A R,KASHYAP R S,PUROHIT H J,et al.Evaluation of the inflammatory response in sera from acute ischemic stroke patients by measurement of IL-2 and IL-10[J].Inflamm Res,2009,58(10):687-691.
[14]MORIYAMA M,NAKAMURA S.Th1/Th2 immune balance and other T helper subsets in IgG4-Related disease[J].Curr Top Microbiol Immunol,2017,401:75-83.
[15]MALAIYAN J,RAMANAN P V,SUBRAMANIAM D,et al.Analysis of serum Th1/Th2 cytokine levels in patients with acute mumps infection[J].J Glob Infect Dis,2016,8(2):87-92.
[16]NILANONT Y,PHATTHARAYUTTAWAT S,CHIEWIT P,et al.Establishment of the Thai version of National Institute of Health Stroke Scale(NIHSS) and a validation study[J].J Med Assoc Thai,2010,93(1):S171-S178.
[17]JENKINS B J.Transcriptional regulation of pattern recognition receptors by Jak/STAT signaling,and the implications for disease pathogenesis[J].J Interferon Cytokine Res,2014,34(10):750-758.
[18]SZABO S J,SULLIVAN B M,STEMMANN C,et al.Distinct effects of T-bet in TH1 lineage commitment and IFN-gamma production in CD4 and CD8 T cells[J].Science,2002,295(5553):338-342.

