熱休克轉錄因子2通過促進白細胞介素-10的表達對肺癌發生的影響*
范敏娟,鐘云華,沈 雯△,袁開芬,趙國厚,王蜀昆,溫林俏
(1.昆明醫科大學第二附屬醫院呼吸科,昆明 650101;2.云南省第一人民醫院干療科,昆明 650101)
肺癌發病機制較復雜,涉及多種細胞因子的改變,白細胞介素-10(IL-10)是一種重要的炎性細胞因子,主要來源于單核巨噬細胞和各種T細胞亞群,研究表明,隨著肺癌分期越晚,IL-10的表達水平越高[1],IL-10水平可預示肺癌病情的嚴重性。研究證實熱休克轉錄因子1(HSF1)與腫瘤的發生有關[2],過表達HSF1可激活巨噬細胞IL-10基因的啟動子誘導IL-10 mRNA的表達[3]。HSF2作為另一類轉錄因子,可以結合至熱休克蛋白(HSP)90的啟動子區域上調其表達[4],而HSP90α在肺癌中高表達[5]。可見,HSF2與肺癌的發生有關。而且,在潰瘍性結腸炎的研究中發現,HSF2既可直接啟動炎性因子的表達,也可通過炎性反應相關信號通路來調節炎性因子的生成[6]。本研究通過檢測肺癌組織和癌旁組織中HSF2、IL-10兩種因子的mRNA、蛋白的表達情況,觀察HSF2對IL-10表達的影響,探討HSF2通過促進IL-10的表達對肺癌發生的影響。
1 材料與方法
1.1材料 IL-10、HSF2試劑盒(上海艾博抗生物有限公司),組織總RNA提取試劑盒、引物、實時熒光定量PCR檢測試劑盒(北京天根生化科技有限公司),A549細胞(中國科學院昆明細胞庫),羅氏siRNA轉染試劑盒(廣州聚研生物科技有限公司),3%牛血清白蛋白、PVDF膜、蛋白酶抑制劑、DMEM培養基(上海維森特生物技術有限公司),生物素化山羊抗兔IgG、辣根過氧化物酶標記的鏈酶親和素、RIPA裂解液(上海碧云天生物技術有限公司),DMEM培養基、封閉用山羊血清、蘇木精-伊紅(HE)(北京索萊寶科技有限公司)等。
1.2方法
1.2.1標本來源及分組 標本從昆明醫科大學第二附屬醫院及云南省第一人民醫院獲取。在手術獲取腫瘤組織的同時,從距離腫瘤組織大于6 cm的組織中獲取相應癌旁組織作為對照組,各獲取標本50例。癌旁組織經過組織學分析確認沒有腫瘤細胞浸潤。所有患者術前均未經過任何治療,取材時將所取組織用預冷的DEPC處理后的雙蒸水沖洗兩遍后,置于液氮中冷凍保存備用。標本的采集均征得患者本人及其家屬的同意并簽署手術同意書。
1.2.2RT-PCR檢測mRNA 使用組織總RNA提取試劑盒提取組織RNA,第一鏈cDNA合成采用cDNA合成試劑盒。HSF2 RT-PCR引物,如下:正向引物5′-AAG TTC AGG CAG TGA TGG CA-3;反向引物5′-TGC ACA GAA CTA GTG AAA AGA TCA-3′。IL-10 RT-PCR引物,如下:正向引物5′-ACA TCA AGG CGC ATG TGA AC-3′;反向引物5′-TAG AGT CGC CAC CCT GAT GT-3′。RT-PCR以GAPDH為內參,其引物序列如下:正向引物5′-GAA GGT CGG AGT CAACGG AT-3′;反向引物5′-GAG GGA TCT CGC TCC TGG AAG-3′。PCR條件如下:預變性95 ℃ 1 min;變性95 ℃ 15 s,退火60 ℃ 15 s,延伸72 ℃ 20 s,循環45次。熒光數據用Opticon Monitor軟件進行分析。
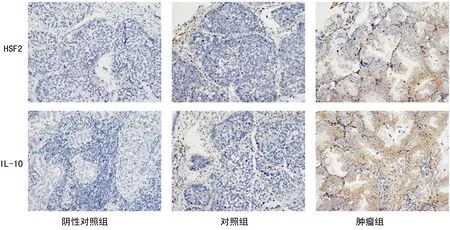
圖1 免疫組織化學檢測肺癌組織及癌旁組織中HSF2、IL-10的表達(200×)
1.2.3Western blot檢測蛋白質 肺癌及癌旁組織在勻漿后用RIPA裂解液進行裂解,裂解液中包含蛋白酶抑制劑。取50 μg蛋白質樣品進行十二烷基硫酸鈉-聚丙烯酰胺(SDS-PAGE)電泳,電轉移至PVDF膜上。電泳條件為80 V 15~20 min,待樣品進入分離膠后120 V電泳40~60 min。電轉移條件為200 mA 1 h。轉移后的PVDF膜用3%牛血清白蛋白封閉1 h,一抗(1∶1 000)室溫孵育過夜,洗滌后用辣根過氧化物酶(HRP)標記的羊抗兔二抗孵育1 h,洗滌顯影。
1.2.4免疫組織化學檢測組織蛋白質 病理標本取材后,經10%中性甲醛固定、組織脫水、二甲苯透明、石蠟包埋切片,接著進行HE染色和免疫組織化學染色,標志物為HSF2和IL-10,光學顯微鏡下觀察免疫組織化學檢測結果。抗體表達于細胞膜、細胞質或細胞核,呈棕黃色或棕褐色顆粒者為陽性細胞。每例切片陽性細胞數占同類細胞數的10%以上者視為陽性,于200×鏡下拍照。
1.2.5細胞培養和轉染 培養基為10%胎牛血清的DMEM培養基。將細胞培養于含有5% CO2的37 °C培養箱中。待細胞成對數期生長時轉移于6孔板中,每孔細胞數約2×105個,細胞生長至60%~80%視野時,開始轉染試驗。以Lipofectamine 2000為載體,具體操作步驟按照Invitrogen公司提供的實驗方案。
2 結 果
2.1HSF2在肺癌組織中表達上調 比較50例肺癌組織和其癌旁組織,RT-PCR檢測發現,癌組織中HSF2 mRNA的表達明顯高于癌旁組織,占比為76%(38/50)(P<0.01)。Western blot和免疫組織化學檢測發現,癌組織中HSF2蛋白水平也明顯上調,蛋白水平和mRNA水平一致,見圖1、2。
2.2IL-10在肺癌組織中表達上調 比較50例肺癌組織和其癌旁組織,RT-PCR檢測發現,癌組織中IL-10 mRNA的表達明顯高于癌旁組織,占比為80%(40/50)(P<0.01)。Western blot和免疫組織化學檢測發現,癌組織中IL-10蛋白水平也明顯上調,蛋白水平和mRNA水平一致,見圖1、3。
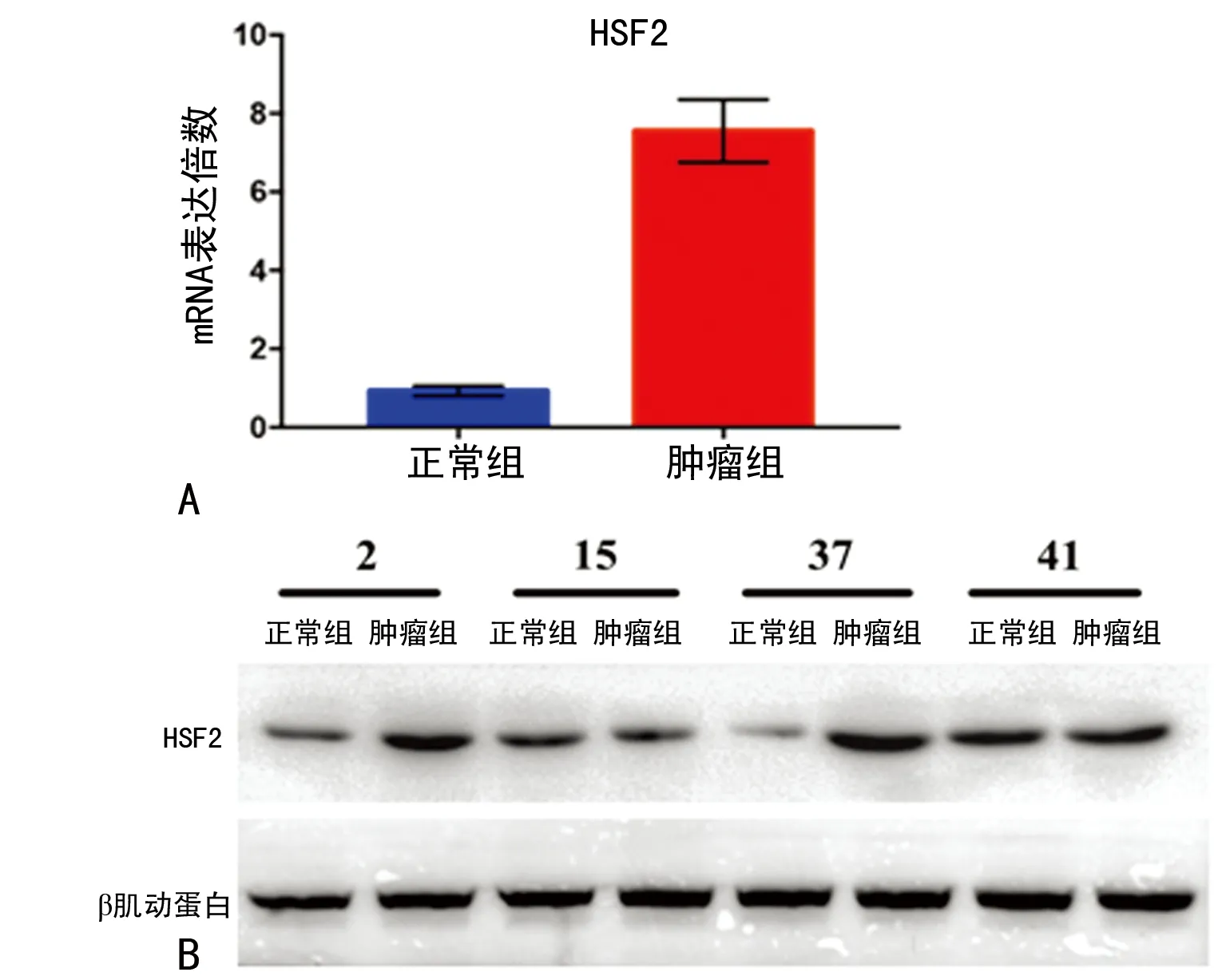
A:RT-PCR檢測HSF2的mRNA水平;B:Western blot檢測HSF2的蛋白水平
圖2肺癌組織及癌旁組織中HSF2的表達
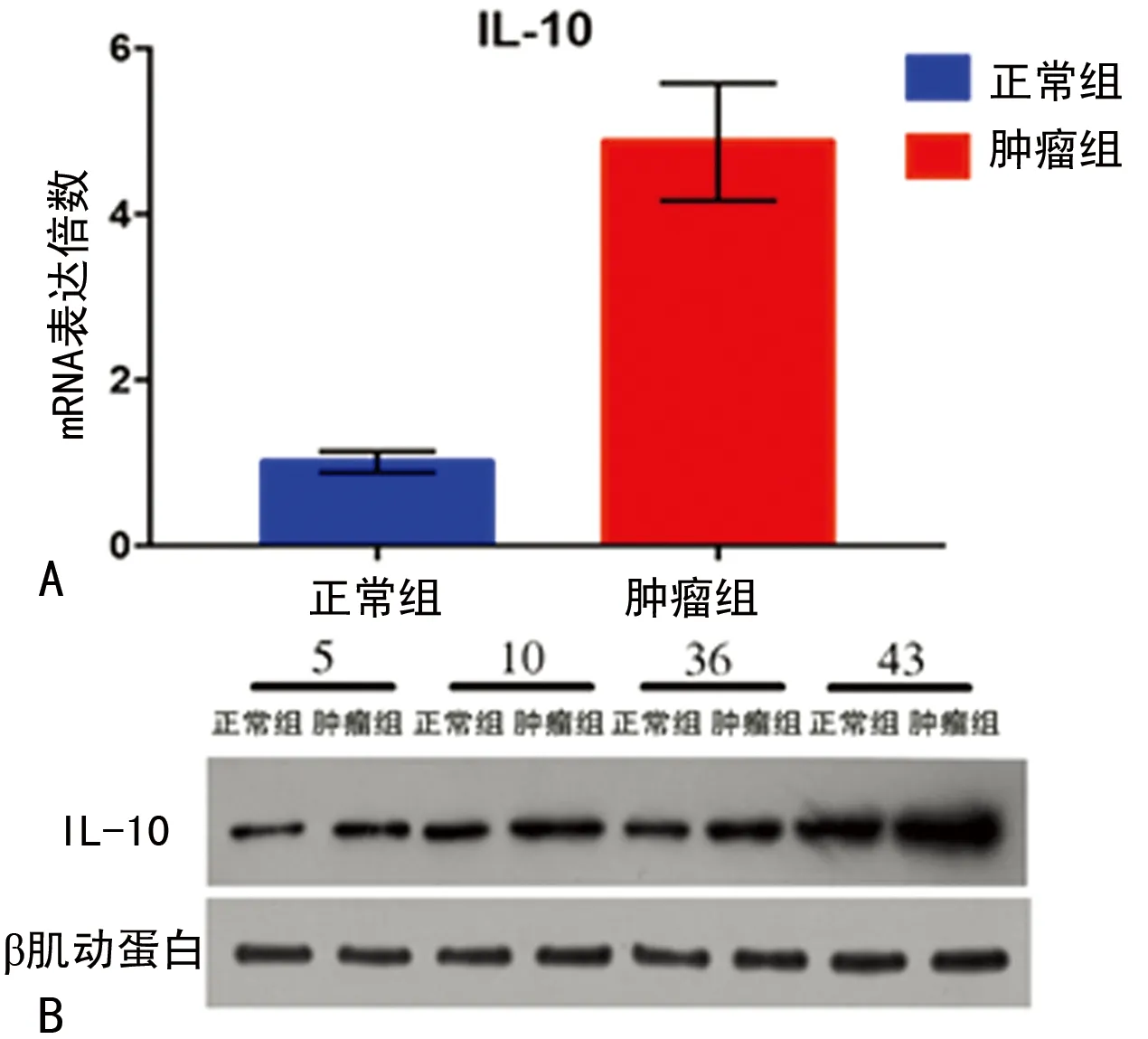
A:RT-PCR檢測IL-10的mRNA水平;B:Western blot檢測IL-10的蛋白水平
圖3肺癌組織及癌旁組織中IL-10的表達
2.4肺癌組織中IL-10的表達上調與HSF2的表達上調呈正相關 對肺癌組織的IL-10與HSF2的表達進行相關分析,發現IL-10的表達上調和HSF2的表達上調呈線性正相關(R2=0.9216),見圖4。
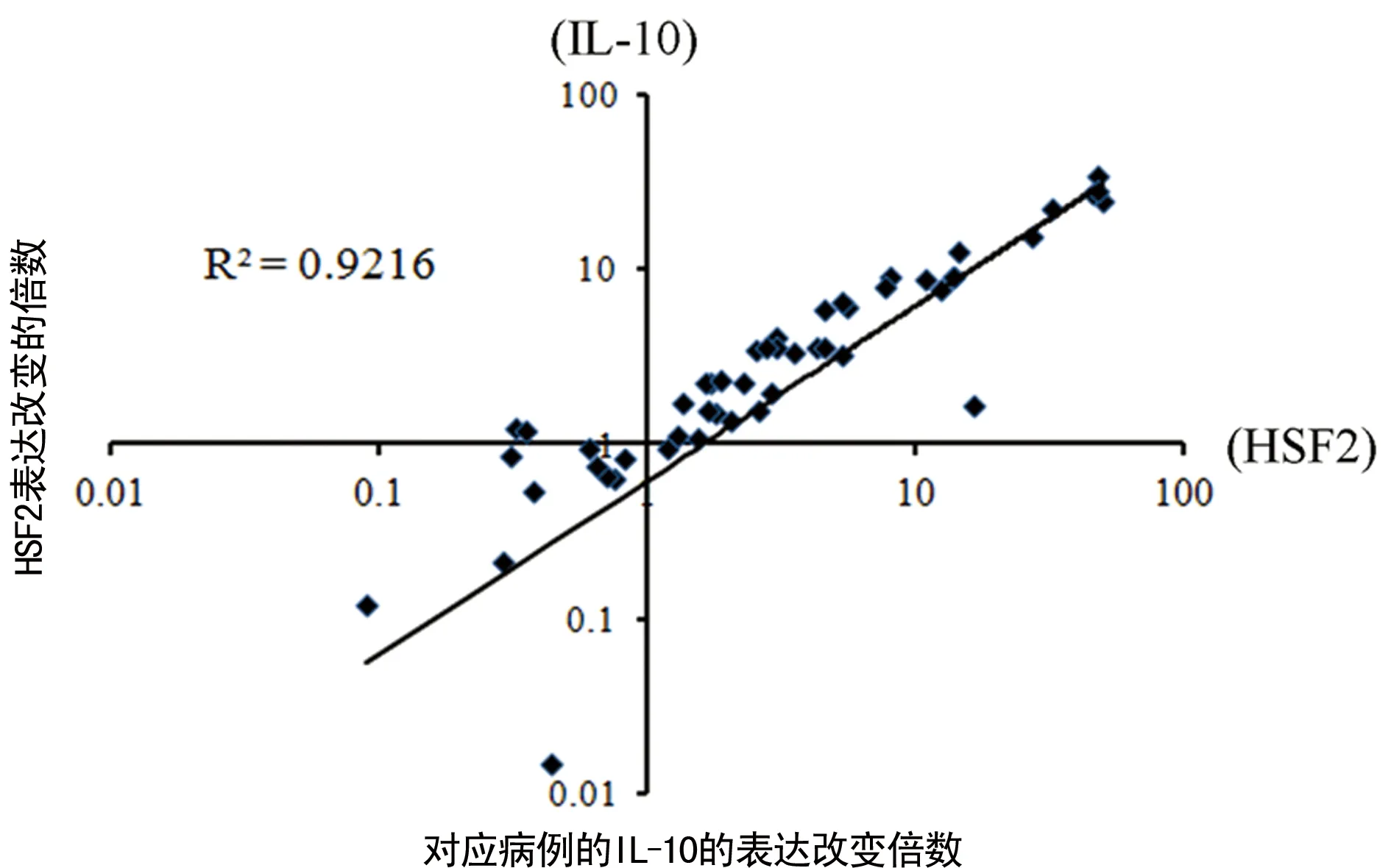
圖4 肺癌組織中HSF2與 IL-10表達的相關分析
2.5siRNA干擾HSF2降低A549 中IL-10表達 在A549細胞中,以siRNA干擾HSF2的表達,Western blot檢測發現,A549表達siRNA后,HSF2和IL-10的表達均明顯降低,見圖5。
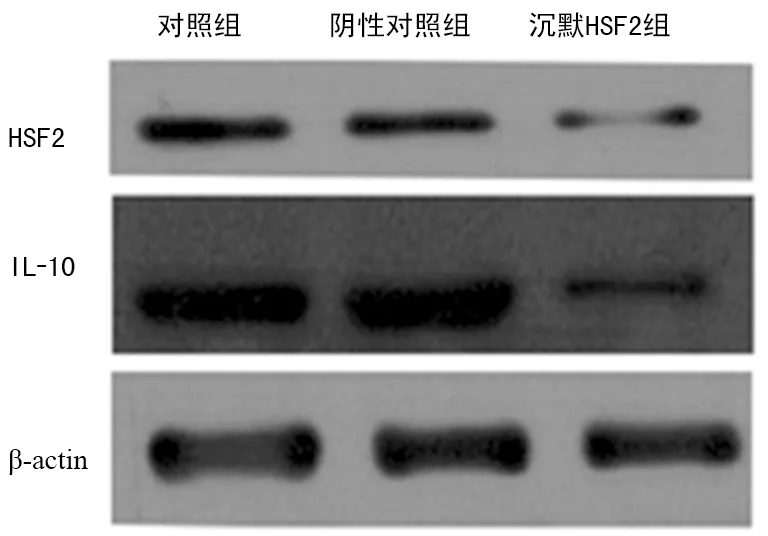
圖5 siRNA干擾HSF2后IL-10的表達
3 討 論
肺癌對人類健康危害極大,細胞微環境的改變可以促進腫瘤的發生[7]。在細胞微環境的改變中,熱休克反應是以基因表達變化為特征的一種防御適應反應,研究表明,HSF在腫瘤的發生發展中扮演了重要角色。本研究發現HSF2在肺癌組織中高表達,表明HSF2與肺癌的發生有關。HSF2被認為主要與機體的發育有關,近年來的研究發現腫瘤的發生和胚胎發育的早期有著非常多的相似性[8],因此,肺癌中HSF2的表達上調也就顯得較合理。
在腫瘤的發生過程中,另一個微環境的改變就是促炎性和抗炎性細胞因子比例的改變。IL-10作為一種抗炎性細胞因子,在腫瘤的發病中具有重要作用,既可直接影響腫瘤細胞和間接抑制免疫細胞而有利于腫瘤生長,還可通過抑制腫瘤定居的巨噬細胞來抑制血管生成。在哺乳動物體內,IL-10和自身受體結合可以磷酸化Janus激酶1(JAK1)和酪氨酸激酶2(TYK2),進而激活信號傳導及轉錄激活因子3(STAT3)。活化的STAT3通過激活淋巴細胞活化信號分子(SLAM)、小異源二聚體基因1(SHP-1)和細胞因子信號傳導抑制蛋白3(SOCS3)等介導IL-10的生物學功能[9-10]。IL-10可以抑制輔助性T細胞1(Th1)細胞的生成和增殖,還可以抑制巨噬細胞、自然殺傷細胞(NK細胞)的功能,使腫瘤得以逃逸而進一步發展。隨著腫瘤發展,IL-10的水平又會進一步升高。
研究發現血清IL-10的表達水平與非小細胞肺癌的發生成正相關,血清IL-10的水平可預示肺癌的預后[11],也可為腫瘤的復發提供依據[12]。當非小細胞肺癌患者的腫瘤切除后,血清IL-10水平會降低,認為肺癌組織本身可能促進了IL-10的生成,從而有利于腫瘤躲避機體的免疫監視,繼而使腫瘤易于發展及轉移[13]。梁晶[14]研究發現IL-10參與肺癌患者微環境的構成,是導致肺癌免疫功能抑制的原因之一,可作為監控晚期肺癌患者免疫功能的參考指標。本研究發現肺癌組織中IL-10高表達,進一步說明肺癌組織可以促進IL-10的生成。因此,在肺癌患者中進行IL-10的監測,可間接掌握肺癌患者的病情,便于及時調整治療方案,IL-10的水平可作為肺癌病情嚴重性的生物標志物。
夏蜀嫻等[15]研究發現,潰瘍性結腸炎患者中HSF2的表達水平增加,HSF2可通過調控核因子-KB(NF-kB)和絲裂原活化蛋白激酶(MAPK)中的家族成員,參與炎性細胞因子的轉錄調控,而多種炎性細胞因子又可激活NF-kB、MAPK通路,其之間關系較緊密。本研究對50例肺癌組織的HSF2和IL-10的表達水平進行了相關分析,發現二者的表達呈正相關,siRNA干擾HSF2可以降低A549 中IL-10的表達,進一步說明HSF2可以調節肺癌細胞IL-10的表達。HSF2促進IL-10的表達,可能有利于肺癌細胞躲避機體的免疫監視,進一步促進腫瘤的發生,但相關分子機制還有待深入研究。
綜上所述,HSF2和IL-10在肺癌組織中表達上調,HSF2可促進IL-10的表達,可能有促于肺癌的發生、發展,而肺癌中HSF2是否可以直接結合到IL-10的啟動子區域調控其表達還有待進一步的研究來揭示。
[1]翟晉芳,杜鳳蘭,繩晉雅,等.肺癌患者外周血調節性T細胞和IL-10的檢測及其意義[J].中國腫瘤臨床,2012,39(6):325-327.
[2]JIANG S F,TU K L,FU Q,et al.Multifaceted roles of HSF1 in cancer[J].Tumour Biol,2015,36(7):4923-4931.
[3]ZHANG H L,ZHANG L L,YU F X,et al.HSF1 is a transcriptional activator of IL-10 gene expression in RAW264.7 macrophages[J].Inflammation,2012,35(4):1558-1566.
[4]WILKERSON D C,SKAGGS H S,SARGE K D,et al.HSF2 binds to the Hsp90,Hsp27,and c-Fos promoters constitutively and modulates their expression[J].Cell Stress Chaperones,2007,12(3):283-290.
[5]江倩,金蒙蒙,黃銳,等.肺癌患者血漿熱休克蛋白90α的表達及意義[J].實用醫學雜志,2016,32(13):2129-2132.
[6]CHEN Y Y,MA Z B,XU H Y,et al.IL-6/STAT3/SOCS3 signaling pathway playing a regulatory role ulcerative colitis carcinogenesis[J].Int J Clin Exp Med,2015,8(8):12009-12017.
[7]HU M,YAO J,CAI L,et al.Distinct epigenetic changes in the stromal cells of breast cancers[J].Nat Genet,2005,37(8):899-905.
[8]MA Y L,ZHANG P,WANG F,et al.The relationship between early embryo development and tumourigenesis[J].J Cell Mol Med,2010,14(12):2697-2701.
[9]LOBO-SILVA D,CARRICHE G M,CASTRO A G,et al.Balancing the immune response in the brain:IL-10 and its regulation[J].J Neuroinflammation,2016,13(1):297.
[10]MANNINO M H,ZHU Z W,XIAO H P,et al.The paradoxical role of IL-10 in immunity and cancer[J].Cancer Lett,2015,367(2):103-107.
[11]UMEKAWA K,KIMURA T,KUDOH S,et al.Plasma RANTES,IL-10,and IL-8 levels in non-small-cell lung cancer patients treated with EGFR-TKIs[J].BMC Res Notes,2013,6:139.
[12]WANG Y C,SUNG W W,WU T C,et al.Interleukin-10 haplotype May predict survival and relapse in resected non-small cell lung cancer[J].PLoS One,2012,7(7):e39525.
[13]陳婺.非小細胞肺癌患者血清IL-12、IL-10測定的臨床意義[D].合肥:安徽醫科大學,2012.
[14]梁晶.肺癌患者外周血Treg細胞與IL-10、TGF-β檢測及其臨床意義[J].臨床肺科雜志,2015,20(11):1980-1983.
[15]夏蜀嫻,繆應雷.HSF2和促炎性細胞因子在潰瘍性結腸炎中的表達[J].世界華人消化雜志,2014,22(30):4683-4690.

