經食管心電圖測量冠狀動脈粥樣硬化性心臟病患者左房室間期的臨床研究*
于 楊,劉 筱,陳 玲,周 煒,黃 喆,陳曼華
(華中科技大學同濟醫學院附屬武漢中心醫院心功能科,武漢 430014)
左房室(AR)間期是指從左心房激動到左心室激動的時間[1]。正常情況下,左房收縮射血期持續100 ms左右,使左心房血回流至左心室。因此,AR間期應大于100 ms,以保證左房收縮期和左房左室的機械同步性,維持良好的心臟泵血功能[2]。目前,關于AR間期與冠狀動脈粥樣硬化性心臟病(簡稱冠心病)之間相關性的研究較為缺乏。本研究通過食管心電圖測量冠心病患者AR間期,了解冠心病患者除冠狀動脈嚴重病變以外可能存在的電機械活動異常。
1 資料與方法
1.1一般資料 回顧性分析2012年1月至2014年12月于本院行食管心電圖檢查并經冠脈造影確診為冠心病的患者48例,其中男29例,女19例,年齡范圍46~81歲,平均年齡(62.4±10.7)歲。NYHA分級Ⅰ~Ⅱ級,并排除以下疾病:先天性心臟病,肺源性心臟病,心肌病,嚴重性瓣膜病等其他心臟器質性疾病,嚴重感染性疾病,既往心肌梗死史或冠狀動脈介入治療史,病態竇房結綜合征,房室傳導阻滯和室內傳導阻滯。
1.2方法
1.2.1食管心電圖檢查 采用雙極食管導聯,經鼻腔插入食管,插入深度為:男36~40 cm、女34~38 cm。記錄到穩定、最大負正雙向或直立P波時,表明此時食管電極位于左心房水平。食管導聯左心房除極波的起點(A)代表左心房激動,QRS波起點基本可以代表左心室激動,測量兩者之間的距離即為AR間期[2-3]。
1.2.2冠狀動脈造影檢查 采用Judkins法穿刺橈動脈或股動脈,多體位行選擇性左右冠狀動脈造影。主要觀察左主干、前降支、回旋支和右冠狀動脈的狹窄或閉塞病變,1個分支受累定為單支病變,累及2個分支的為雙支病變,3個或以上分支受累為多支病變,左主干病變為雙支病變。結果由2名經驗豐富的心臟介入醫師共同判定。冠狀動脈陽性標準為管腔狹窄超過50%[4]。
1.2.3超聲心動圖檢查 患者左側臥位,平靜呼吸。應用飛利浦IU22型超聲心動儀及S5-1單晶體探頭,采集頻率2.0~4.0 MHz,配備PW-TDI技術。由同一名超聲科醫師測量患者各心腔大小、室壁厚度、左心室射血分數(EF%)及瓣膜口血流動力學等參數。
1.2.4分組 根據經食管心電圖記錄到的AR間期結果,將患者分為AR間期縮短組(AR≤100 ms)和AR間期正常組(AR>100 ms)。
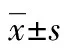
2 結 果
2.1一般資料比較 48例冠心病患者中,AR≤100 ms組20例,AR>100 ms組28例。兩組患者年齡比較差異有統計學意義(P<0.05),其他指標比較差異無統計學意義(P>0.05),見表1。

表1 兩組患者臨床特征比較
2.2冠狀動脈病變情況及超聲心動圖結果分析 冠狀動脈造影顯示,48例患者中單支病變35例,雙支及多支病變共13例。右冠狀動脈病變的比例,AR≤100 ms組和AR>100 ms組分別為10例和6例,兩組之間比較差異有統計學意義(P<0.05);而兩組患者左前降支、左回旋支和冠狀動脈病變大于1支相比較,差異無統計學意義(P>0.05),見表2。對比分析兩組患者超聲心動圖結果,AR≤100 ms組左心房內徑較AR>100 ms組增大(P<0.05),兩組患者二尖瓣口舒張早期血流速度E峰與舒張晚期血流速度A峰的比值(E/A)、EF%比較,差異無統計學意義(P>0.05),見表3。

表2 兩組患者冠脈病變情況比較[n(%)]

表3 兩組患者超聲心動圖結果比較
3 討 論
影響心臟的泵血功能除心肌的形態結構外,還有以電活動為基礎的興奮機能和以機械活動為基礎的收縮機能。心臟的電活動,引發心肌的機械性收縮,從而推動心臟泵血功能。因此,心臟的電機械活動同步性對良好心功能至關重要,包括房室同步性與心室同步性。其中,心臟最重要的功能與左房和左室的同步性密切相關。由于AR間期在體表心電圖上的幾乎是盲區,容易被臨床所忽視。在無創的研究情況下,AR間期需借助經食管心電圖記錄P波和QRS波來測量。引起AR間期過短的原因包括房間傳導阻滯、右心房起搏、左側顯性房室旁路和短PR間期等,其中房間傳導時間與AR間期關系最密切[2]。理論上,在無室內傳導阻滯時,AR間期值=PR間期-PA,PA指右房向左房傳導的時間。正常情況下左右心房傳導時間為60~70 ms,當大于120 ms時房間傳導延遲[5]。房間傳導阻滯而房室傳導正常時,AR間期將縮短。臨床上房間傳導阻滯出現AR間期縮短并非少見,據統計正常人群中房間傳導阻滯的發病率約為1%,心血管病患者中發病率為2%,永久起搏器植入者中占10%,而在病態竇房結伴慢快綜合征的患者中則高達30%[6]。房間傳導的主要纖維束為Bachmann束,主要由右冠狀動脈供血。冠心病由于冠狀動脈的阻塞或長時間的痙攣,將會造成房間束的缺血缺氧,發生電活動傳導異常[7]。SAREMI等[8]回顧性分析了健康人和住院患者的Bachmann束的解剖及其血供,認為Bachmann束在心房性心律失常疾病的發生、發展中可能起一定的作用。ARIYARAJAH等[9]研究發現有房間傳導阻滯的冠心病患者,病變多發生于右冠狀動脈,尤其是近段和中段。本研究中,AR≤100 ms組右冠狀動脈的病變多于AR>100 ms組,兩組差異有統計學意義(P<0.05),表明冠心病患者存在心臟電活動傳導的異常,AR間期縮短的冠心病患者多為右冠狀動脈病變。
冠心病由于心肌缺血、結間束和房間束的纖維化改變,加重電導率的不均勻分布,使心房節律性、傳導性表現異常[10]。因此,冠心病的危險因素有可能引起房間傳導延遲而影響AR間期,包括糖尿病、高血脂、高血壓、肥胖、吸煙、年齡等。ARIYARAJAH等[11]對404例非急診原因入院的患者評估心電圖結果,研究表明高血壓、糖尿病和高膽固醇血癥是因非急性病因入院患者存在房間傳導阻滯的危險因素。劉同等[12]對比分析了40例肥胖患者與20例正常對照組患者的心電圖結果,發現肥胖組患者房間傳導阻滯發生率明顯高于正常對照組(77.5%vs. 30.0%,P<0.01),結果證實肥胖會增加房間傳導阻滯的發病率。本研究中,AR≤100 ms組年齡高于AR>100 ms組(P<0.05),表明冠心病患者中高齡患者更易發生AR間期的異常。除了冠心病相關危險因素外,心臟本身的器質性病變如二尖瓣重度狹窄和肥厚性心肌病等,同樣也會產生心電活動的異常[13]。有關研究表明系統性硬化癥和其他自身免疫性疾病易損傷包括冠狀動脈在內的動脈血管,從而導致房間傳導阻滯而使AR間期縮短[14]。此外,共濟失調和淋巴瘤也會出現房間傳導延長,影響房室收縮同步性[15-16]。
當出現房間傳導阻滯時,AR間期縮短,左心房收縮時二尖瓣即將關閉或已關閉,造成左房收縮期射血中斷,左心室舒張期充盈顯著減少,左室舒張功能下降,嚴重時發生左房擴大、肺靜脈淤血和活動耐量下降等左房功能低效綜合征的表現[17-18]。本研究結果顯示,AR≤100 ms組的左房內徑較AR>100 ms組增大(P<0.05),提示AR間期異常會加重房室機械收縮活動的非同步性,導致左房增大,引起冠心病患者心房結構及功能的改變。而E/A比值可能受房室壓差的影響,在嚴重舒張功能障礙時表現為假性正常化,由于缺少正常對照組,尚需進一步研究證實。除了影響心功能外,AR間期長期過短還易導致左房擴大而增加心房顫動的發病率[19]。左房增大以及左房收縮力減低進一步促進血栓的形成,從而增加栓塞性卒中發生的風險[13,20]。因此,為了保證良好的血流動力學效果,AR間期應大于100 ms。然而,AR間期過長也同樣不利于左心房的輔助泵功能。當AR間期超過180 ms時,左心室仍處于舒張期而左心房開始舒張,由于房內壓的下降導致左心室的血回流至心房,引起舒張期二尖瓣反流,若長期存在將嚴重損害心功能。因此,早期識別AR間期的異常,并及時干預和治療引起的心功能不全及心率失常,保持良好的心臟電機械活動同步性,是防止心功能惡化的重要手段。
本研究尚存在不足,未納入正常對照組,未對冠心病患者混雜因素進行控制,且病例數有限,仍需要加大樣本量對相關因素分層后進一步研究分析。
[1]邸成業,林文華.左心房室間期及其臨床意義[J].中華心率失常學雜志,2013,17(2):159-160.
[2]郭繼鴻.左房室間期[J].臨床心電學雜志,2008,17(5):382-388.
[3]許原.食管導聯心電圖主要優點及其臨床應用[J].心電圖雜志,2014,3(1):51.
[4]喬樹賓.冠心病診療進展[M].北京:人民衛生出版社,2013:86-98
[5]CONDE D,BARANCHUK A,BAYES D.Advanced interatrial block as a substrate of supraventricular tachyarrhythmias:A well recognized syndrome[J].J Electrocardiol,2015,48(2):135-140.
[6]郭繼鴻.左房室間期續[J].臨床心電學雜志,2008,17(6):456-466.
[7]蔡思宇,周少坤,吳祥.房間阻滯與左心房擴大的關系及其臨床意義[J].心電與循環,2015,34(2):130-134.
[8]SAREMI F,CHANNUAL S,KRISHNAN S,et al.Bachmann bundle and its arterial supply:Imaging with multidetector ct--implications for interatrial conduction abnormalities and arrhythmias[J].Radiology,2008,248(2):447-457.
[9]VIGNENDRA A,JAXON F,SIRIN A,et al.Angiographic localization of potential culprit coronary arteries in patients with interatrial block following a positive exercise tolerance test[J].Am J Cardiol,2007,99(1):58-61.
[10]YU C M,FUNG J W,ZHANG Q,et al.Tissue doppler echocardiographic evidence of atrial mechanical dysfunction in coronary artery disease[J].Int J Cardiol,2005,105(2):178-185.
[11]ARIYARAJAH V,APIYASAWAT S,MOORTHI R,et al.Potential clinical correlates and risk factors for interatrial block[J].Cardiology,2006,105(4):213-218.
[12]TONG L,ZILI F,PANAGIOTIS K,et al.Effect of obesity on p-wave parameters in a chinese population[J].Ann Noninvasive Electrocardiol,2010,15(3):259-263.
[13]MURAT Y,DAVUTOGLU V,AKKOYUN C,et al.Interatrial block and p-terminal force:A reflection of mitral stenosis severity on electrocardiography[J].J Heart Valve Dis,2011,20(6):619-623.
[14]RAMAN M,DAVID H,SPODICK M,et al.Interatrial block a virtual pandemic requiring attention[J].Iran J Med Sci,2014,39(2):84-93.
[15]ENGELEN M A,KAI U J,ECKARDT L.Interatrial conduction delay and atrioventricular block due to primary cardiac lymphoma[J].J Cardiovasc Electrophysiol,2005,16(16):926.
[16]MARIOS P,KOSTAS S,THEODORE G.Papaioannou Prevalence of interatrial block in patients with friedreich′s ataxia[J].Elsevier Ireland Ltd,2010,145(2):387.
[17]BURRI H,BENNANI I,DOMENICHINI G,et al.Biatrial pacing improves atrial haemodynamics and atrioventricular timing compared with pacing from the right atrial appendage[J].Europace,2011,13(9):1262-1267.
[18]BAYES L A,PLATONOVl P,COSIO F G,et al.Interatrial blocks.A separate entity from left atrial enlargement:A consensus report[J].J Electrocardiol,2012,45(5):445-451.
[19]BARANCHUK A,LUNA A B,BREITHARDT G.The role of advanced interatrial block pattern as a predictor of atrial fibrillation[J].Heart Rhythm,2015,13(3):87.
[20]CHHABRA L,DEVADOSS R,CHAUBEY V K,et al.Interatrial block in the modern era[J].Curr Cardiol Rev,2014,10(3):181-189.

