穿龍薯蕷皂苷元對小鼠T淋巴細胞影響的體外研究
王 燁,付聰敏,賈麗榮,李松燃,黨曉偉,馬秀芬,秦博文△
(1.承德護理職業學院,河北承德 067000;2.空軍軍醫大學,陜西西安 710032)
穿龍薯蕷皂苷元(diosgenin,Dio)是從薯蕷科植物穿龍薯蕷的干燥根莖即穿山龍中提取、水解產生,是穿山龍的主要有效成分[1-3]。現代藥理學研究證明,Dio具有抗腫瘤、調節免疫、祛痰平喘、抗變態反應、抗骨質疏松等多種藥理作用[4-9],還具有激素類作用,是合成甾體激素類藥物的重要原料[10]。本實驗以正常小鼠脾臟T淋巴細胞為研究對象,研究Dio在體外對T淋巴細胞增殖活性的影響及對白細胞介素-2(IL-2)、干擾素-γ(IFN-γ)mRNA表達的影響,為揭示Dio的免疫調節機制提供實驗依據。
1 材料與方法
1.1材料
1.1.1受試動物 清潔級C57近交系小鼠,雄性,8~10周齡,由中國醫學科學院實驗動物中心提供。
1.1.2藥品與試劑 Dio(南京澤朗醫藥科技有限公司,純度98%,批號:20132516),刀豆蛋白A(ConA)(美國Sigma公司),氫化可的松(HC,天津生物化學制藥有限公司),CCK-8試劑(碧云天生物技術研究所),反轉錄PCR試劑盒[寶生物工程(大連)有限公司],IL-2、IFN-γ引物[生工生物工程(上海)股份有限公司]。
1.1.3儀器 DNP-9052型電熱恒溫培養箱(上海精宏實驗設備有限公司)、YT-CJ-1N 超凈工作臺(北京亞泰科隆實驗科技開發中心)、Multiskan MK3酶聯儀(芬蘭雷勃公司)、PTC-100PCR儀(美國MJ RESEARCH公司)、反轉錄擴增儀(美國Applied Biosytems公司)等。
1.2方法
1.2.1溶液配制 (1)Dio溶液配制:將Dio干粉加入無水乙醇,充分溶解混勻制成原液。按比例加入RPMI-1640培養基及用RPMI-1640培養基配置的15%乙醇進行稀釋,制成(終濃度分別為:0.937 5、1.875 0、3.750 0、7.500 0、15.000 0 μg/mL)工作液,工作液中乙醇濃度為0.5%。(2)ConA溶液配制:稱取3 mg ConA干粉,加入RPMI-1640培養基10 mL,充分溶解混勻,制成工作液,終濃度為2.5 μg/mL。(3)完全培養液配制:按比例在RPMI-1640培養基中加入10%的胎牛血清、1%的青鏈霉素溶液,混合均勻,制成完全培養液。

表1 Dio對各組T淋巴細胞增殖抑制率比較

續表1 Dio對各組T淋巴細胞增殖抑制率比較
a:P<0.01,與ConA組比較;b:P<0.01,與陽性對照組比較;c:P<0.01,與7.500 0 μg/mL組比較

表2 Dio對IFN-γ mRNA、IL-2 mRNA表達的影響
a:P<0.01,與對照組比較;b:P<0.01,與ConA組比較;c:P<0.01,與7.500 0 μg/mL 濃度組比較
1.2.2T淋巴細胞制備 斷頸處死小鼠,無菌取脾,制備脾淋巴細胞混懸液,用尼龍毛柱對其進行分離,收取T淋巴細胞,臺盼藍染色判斷細胞存活率(要求存活率均在97%以上)。調整T淋巴細胞密度為2×106個/mL[11]。
1.2.3CCK-8檢測Dio對T淋巴細胞增殖的影響[11-12]實驗設對照組:T細胞懸液+完全培養液,ConA組:T細胞懸液+ConA溶液(2.5 μg/mL)+完全培養液,陽性對照組:T細胞懸液+ConA溶液(2.5 μg/mL)+HC溶液(1.0 μg/mL)+完全培養液,藥物組:T細胞懸液+ConA溶液(2.5 μg/mL)+Dio溶液(0.937 5、1.875 0、3.750 0、7.500 0、15.000 0 μg/mL)+完全培養液,每組6個復孔,將鋪好的96孔培養板放置于培養箱(37 ℃、5% CO2)中培養,總時間分別為24、48、72 h,待培養至20、44、68 h時取出,加入CCK-8試劑,充分混勻后置培養箱中繼續培養4 h。用酶聯儀測定各組吸光度值(OD值):450 nm處,計算Dio對T淋巴細胞增殖的抑制率(PI):PI=[1-(AConA+Dio-A對照組)/(AConA-A對照組)]×100%。
1.2.4反轉錄PCR法檢測Dio對IL-2、IFN-γ mRNA表達的影響 實驗設對照組、ConA組、陽性對照組、藥物組(Dio溶液濃度3.750 0、7.500 0、15.000 0 μg/mL),每組6個復孔,將鋪好的培養板置于培養箱(37 ℃、5% CO2)中,48 h后離心收集T淋巴細胞,洗滌后以TRizol提取總RNA,反轉錄成cDNA,用反轉錄PCR試劑盒檢測各組T淋巴細胞IL-2、IFN-γ mRNA的表達情況[13-14]。
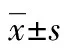
2 結 果
2.1Dio對T淋巴細胞增殖的影響 Dio濃度在0.937 5~7.500 0 μg/mL范圍內,對T淋巴細胞增殖有抑制作用,隨藥物濃度遞增抑制作用增強,7.500 0 μg/mL為最佳抑制濃度,超過最佳抑制濃度后抑制作用逐漸減弱,見表1。

M:Mark;1:對照組;2:ConA組;3:陽性對照組;4:15.000 0 μg/mL組;5:7.500 0 μg/mL組;6:3.750 0 μg/mL組
圖1各組IFN-γ mRNA的表達
2.2Dio對IL-2、IFN-γ mRNA的影響 Dio濃度在3.750 0~7.500 0 μg/mL時,對T淋巴細胞IL-2、IFN-γ mRNA的表達具有抑制作用,隨藥物濃度增加抑制作用增強,Dio 7.500 0 μg/mL時抑制作用最明顯,為最佳抑制濃度。超過最佳抑制濃度后,對IL-2、IFN-γ mRNA的表達抑制作用逐漸減弱,見表2,圖1、2。

M:Mark;1:對照組;2:ConA組;3:陽性對照組;4:15.000 0 μg/mL組;5:7.500 0 μg/mL組;6:3.750 0 μg/mL組
圖2各組IL-2 mRNA的表達
3 討 論
T淋巴細胞可介導細胞免疫應答,對機體免疫應答的調節起著至關重要的作用,其活化和增殖是執行免疫功能的基礎,但過度活化增殖有可能導致自身免疫性疾病和器官移植排斥反應的發生,以T淋巴細胞為靶向的免疫干預能有效地控制對機體有害的免疫應答[15]。因此,能抑制T淋巴細胞活化增殖的藥物在控制對機體有害的免疫應答方面具有積極的作用。本研究先用ConA作為刺激劑,使T淋巴細胞在體外顯著增殖,再用Dio進行干預,結果顯示Dio各濃度組對T淋巴細胞增殖均有抑制作用,且抑制作用隨濃度增加而增強,并具有一定的量效關系。
IL-2是引起T淋巴細胞增殖的主要細胞因子,可通過提高T淋巴細胞的數量和功能達到增強機體免疫功能的效果,在機體復雜的免疫網絡中起調節作用[15]。IFN-γ即Ⅱ型干擾素,具有促進T淋巴細胞的分化、激活單核巨噬細胞、誘導和增加組織相容性復合體(MHC)分子的表達等功能,可以介導并且調節機體的特異性免疫[15]。IL-2、IFN-γ mRNA的表達水平與IL-2、IFN-γ水平呈正相關,因此可間接反映T淋巴細胞增殖的情況。在本研究中,T淋巴細胞經ConA刺激、Dio干預后,各濃度組T淋巴細胞IL-2、IFN-γ mRNA的表達與ConA組相比較均有明顯下降,且抑制作用隨藥物濃度增加而增強。經Dio干預后IL-2、IFN-γ mRNA的表達情況與T淋巴細胞增殖實驗中的結果相符,從而進一步印證了Dio對T淋巴細胞增殖影響的結果。
綜上所述,Dio對T淋巴細胞的增殖及對IL-2、IFN-γ mRNA的表達均有抑制作用。研究Dio在體外對正常T淋巴細胞的增殖、活化的影響,以及其對IL-2、IFN-γ mRNA表達的影響,可反映出Dio發揮免疫調節功能的過程及機制,其結果為揭示Dio的免疫調節機制奠定基礎,并為進一步開發其作為免疫調節劑應用于自身免疫性疾病的治療提供實驗依據。
[1]國家藥典委員會.中華人民共和國藥典:一部[M].北京:中國醫藥科技出版社,2010:250.
[2]龐曉東,龐發忠,林耀庚,等.穿地龍的成分、藥理及臨床應用[J].山西中醫,2002,18(5):50-51.
[3]趙景嬋,郭治安,成小飛,等.穿山龍薯蕷中薯蕷皂苷元的高效液相色譜法測定[J].藥物分析雜志,2000,20(1):27.
[4]張數鑫,周錄英,于元杰.穿龍薯蕷研究進展[J].分子植物育種,2005,3(1):107-111.
[5]宋宇,梁長青,何忠梅,等.薯蕷皂苷元體外抗腫瘤作用的研究[J].中國腫瘤,2004,13(10):651-653.
[6]MOALIC S,LIAGRE B,CORBIRE C,et al.A plant steroid,diosgenin,induces apoptosis,cell cycle arrest and COX activity in osteosarcoma cells[J].FEBS Lett,2001,506(3):225-230.
[7]高志捷,陳信義,劉江濤,等.薯蕷皂苷體外抑制白血病細胞增殖研究[J].中國中醫基礎醫學雜志,2003,9(8):17-19.
[8]江洋珍,王俊俊,梁繼超,等.薯蕷皂苷元對大鼠成骨細胞增殖、分化及OPG/RANKL mRNA表達的影響[J].中華中醫藥雜志,2010,25(1):134-136.
[9]雷勵.穿山龍注射液穴位注射治療重癥支氣管哮喘臨床觀察[J].中國中醫急癥,2005,14(5):419-419,424.
[10]HAFEZ N A,BENGHUZZI H,TUCCI M.Histomorphometric evaluation of renal glomeruli exposed to sustained delivery of estrogen using adult ovariectomized rats[J].Biomed Sci Instrum,2003,39(1):487-492.
[11]郝樹彬,溫紅玲,尹玉霞,等.BALB/c 鼠脾臟T 淋巴細胞體外轉化試驗條件的優化研究[J].中國醫療器械信息,2011,17(8):31-34.
[12]侯春梅,李新穎,葉偉亮,等.MTT法和CCK-8法檢測懸浮細胞增殖的比較[J].軍事醫學科學院院刊,2009,33(4):400.
[13]林仁勇,丁劍冰,溫浩,等.半定量反轉錄PCR檢測細胞因子表達的研究[J].新疆醫科大學學報,2003,26(5):427-429.
[14]唐微,景冬梅,董蘭,等.小鼠IL-2基因的反轉錄PCR克隆[J].湖北農業科學,2013,52(14):3367-3369.
[15]陳慰峰.醫學免疫學[M].北京:人民衛生出版社,2004:27-33.

