18F-FPA的合成及對荷前列腺癌裸鼠的顯像研究*
譚支娥,王 朋,崔邦平,代文莉,鄧鵬裔,田金玲,胡 偉
(三峽大學第一臨床醫學院/宜昌市中心人民醫院核醫學科/宜昌市核醫學分子影像重點實驗室,湖北宜昌 443003)
前列腺癌是全球男性發病率第2位的惡性腫瘤,在美國發病率居首位,病死率僅次于肺癌,近年來,其發病率在亞洲國家明顯上升[1-2]。用于前列腺癌的影像學檢查有超聲、CT、磁共振(MRI)和正電子發射計算機斷層顯像(positron emission tomography/computer tomography,PET/CT)等,它們各自的適應證不同,各有優缺點。18F-氟代脫氧葡萄糖(2-deoxy-2-18F-fluoro-D-glueose,18F-FDG)是最常用的PET/CT顯像劑,但由于前列腺癌原發病灶較小,分化較好,生長緩慢,腫瘤細胞糖酵解水平較低[3],導致多數前列腺癌病灶對18F-FDG的攝取不高,因此,18F-FDG 顯像劑對前列腺癌的診斷靈敏度存在明顯不足。除18F-FDG以外,還有多種顯像劑可用于前列腺癌的檢測,但其應用價值均有待提高。如11C-膽堿和11C-乙酸鹽的檢測靈敏度雖比18F-FDG高[4],但半衰期較短(t1/2=20 min),在沒有醫用回旋加速器的醫院很難推廣使用。18F-氟乙酸的半衰期(t1/2=110 min)較11C-乙酸鹽長,卻在體內存在脫氟現象[5]。2-18F-氟丙酸(2-18F-fluoropropionic acid,18F-FPA)的分子結構與丙酸相似,在體內和丙酸有類似的生物化學行為,初步研究結果顯示其可以作為脂肪酸顯像劑用于腫瘤的診斷[6]。本研究旨在探討利用CFN-multi-200型多功能藥物合成模塊合成18F-FPA的可行性,并進一步評價18F-FPA對前列腺癌的顯像價值。
1 材料與方法
1.1材料
1.1.1實驗動物 BALB/c型無特殊病原體(SPF)級裸鼠20只,購于北京華阜康生物技術有限公司[許可證號:SCXK(京)2009-0015],雄性,鼠齡4~5周,體質量20~24 g。PC3前列腺癌細胞株由三峽大學實驗中心提供,22RV1前列腺癌細胞株購于武漢博士德生物工程有限公司。
1.1.2主要試劑與儀器 2-溴代丙酸甲酯(純度大于97%)、無水K2CO3(純度大于99.5%)購自武漢意得生物公司;無水乙腈(純度99.9%)購自美國Sigma公司;氨基聚醚(純度98%)購自德國ABX公司;其余試劑均為國產分析純。HM-10HC型回旋加速器、CFN-multi-200型多功能藥物合成模塊購自日本住友重工公司;離子交換柱QMA(Sep-pak Light)、486型高效液相色譜紫外檢測器購自美國Waters公司;YMC-Pack ODS-AM色譜柱(250 mm×10 mm)購自美國Grace公司;除菌過濾器(Millex-GS,0.22 μm)購自美國Millipore公司;高效液相色譜放射性檢測器、薄層色譜法掃描儀購自美國Bio-Scan公司;Biograph mCT-S64 PET/CT購自德國西門子公司;ATOMLAB 400 X2型放射性活度計購自美國Biodex公司;F11004型電子天平購自上海良平儀器儀表公司。
1.2方法
1.2.118F-FPA的合成 使用CFN-multi-200型多功能藥物合成模塊,根據18F-FPA的合成路線編寫合成控制程序。合成基本過程如下:將0.7 mL氨基聚醚溶于1 mL乙腈,再加入0.2 mL 0.25 mol/L無水K2CO3和18Fˉ混勻,然后加入0.8 mL乙腈共沸除水獲得產物一。配制25 mg 2-溴丙酸甲酯與1.3 mL無水乙腈的混和物二。將二加入產物一中封瓶,在80 ℃條件下持續反應6 min,生成中間產物2-18F-氟丙酸甲酯。待反應瓶降到室溫,用1 mL蒸餾水稀釋,經高效液相色譜純化,以0.2%乙酸∶乙腈(60∶40)混合物為洗脫液,3 mL/min的流速通過YMC-Pack ODS-AM色譜柱(250 mm×10 mm),保留時間約8 min,收集純化產物。加入50 μL 10 mol/L的NaOH到純化產物中,加熱到80 ℃,反應10 min生成2-18F-氟丙酸鈉。低壓條件下蒸干溶劑,加入1 mL蒸餾水溶解產物,再加入85 μL 6 mol/L HCl中和,除菌過濾后收集終產物18F-FPA。測量放射性計數,計算其產率。
1.2.2產品的質量控制 目測產品的顏色和澄清度,用pH試紙測定其pH值。使用薄層色譜法測定18F-FPA的放射化學純度,取18F-FPA溶液0.1 mL加入0.4 mL胎牛血清中,輕微混勻,放置37 ℃室溫下,然后分別于1、2、4和6 h取樣并測定放射化學純度,檢測18F-FPA的穩定性。
1.2.3細胞培養及荷瘤裸鼠模型的制備 選用PC3和22RV1兩種前列腺癌細胞株,用添加10%胎牛血清和雙抗(青霉素100 U/mL,硫酸鏈霉素100 μg/mL)的RPMI-1640作為培養基,置于37 ℃、5% CO2的培養箱中培養,取對數生長期的PC3和22RV1細胞用胰蛋白酶進行消化,制成單細胞懸液,調整細胞濃度至2×106個/mL,每只裸鼠取0.2 mL接種于右前肢皮下,其中PC3細胞接種裸鼠16只,22RV1細胞接種4只,并飼養于SPF級動物房,待腫瘤生長至直徑1~2 cm時用于實驗。
1.2.4荷瘤裸鼠PET/CT顯像 荷PC3和22RV1前列腺癌裸鼠各取4只,腹腔注射10%的水合氯醛(4 mL/kg)進行麻醉,然后尾靜脈注射18F-FPA 7.4 MBq,并固定于硬紙板上,采集注射后0.5、1.0和2.0 h時的PET/CT圖像。能量窗口設定為450~560 keV,符合時間設定為6 ns,采集時間設定為5 min,采集完成后對圖像進行后處理。第2、3天分別行18F-FDG 和11C-膽堿顯像。
1.2.5荷瘤裸鼠體內生物分布測定 將16只荷PC3前列腺癌裸鼠分為4組,每組4只,均自尾靜脈注射18F-FPA 3.7 MBq,分別于注射后0.5、1.0、2.0和4.0 h脫頸處死,收集重要器官組織(腫瘤、血液、腦、心臟、肺、肝臟、脾臟、胰腺、腸道、腎臟、股骨、肌肉),測其質量及放射性計數,經衰減校正后,計算每克組織百分注射劑量率(percentage activity of injection dose per grain of tissue,%ID/g)和腫瘤與非腫瘤的放射性攝取比值。荷22RV1前列腺癌裸鼠由于數量較少,未行生物分布實驗。
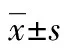
2 結 果
2.118F-FPA的合成18F-FPA的整個合成時間約40 min,產率為(38±2)%(未經時間校正)。
2.218F-FPA的質量控制18F-FPA為無色透明液體,pH值為6.5~7.0,薄層色譜法測得放射化學純度大于97%。產品放置6 h后,放射化學純度仍大于95%。
2.3荷PC3前列腺癌裸鼠18F-FPA PET/CT顯像 荷PC3前列腺癌裸鼠于注射18F-FPA后0.5 h可見清晰顯像,膀胱有明顯的放射性濃聚,右前肢腫瘤攝取明顯,腸道和肝臟有不同程度攝取。注射18F-FPA后2 h,腸道和肝臟攝取明顯減少,骨骼和肌肉攝取始終較少,見圖1。
2.418F-FPA、18F-FDG和11C-膽堿對比顯像 荷PC3和22RV1前列腺癌裸鼠分別于注射18F-FPA、18F-FDG和11C-膽堿后顯像,18F-FPA顯像中腫瘤有明顯的放射性攝取,18F-FDG和11C-膽堿顯像中腫瘤僅見輕微攝取,見圖2、3。

A、B、C分別為尾靜脈注射18F-FPA后0.5、1.0和2.0 h顯像
圖1荷PC3前列腺癌裸鼠18F-FPA PET/CT顯像(箭頭示腫瘤)

A:尾靜脈注射18F-FPA后1.0 h顯像;B:尾靜脈注射18F-FDG后1.0 h顯像;C:尾靜脈注射11C-膽堿后20 min顯像
圖2荷PC3前列腺癌裸鼠18F-FPA、18F-FDG和11C-膽堿對比顯像(箭頭示腫瘤)

A:尾靜脈注射18F-FPA后1.0 h顯像;B:尾靜脈注射18F-FDG后1.0 h顯像;C:尾靜脈注射11C-膽堿后20 min顯像
圖3荷22RV1前列腺癌裸鼠18F-FPA、18F-FDG和11C-膽堿對比顯像(箭頭示腫瘤)
2.5荷PC3前列腺癌裸鼠的生物分布 腫瘤在注射18F-FPA后0.5、1.0、2.0和4.0 h的生物分布分別為(6.91±0.72)、(6.99±0.55)、(7.17±0.25)和(6.49±0.74)%ID/g,差異無統計學意義(P>0.05);血液和腸道早期有較高的放射性攝取值,但隨著時間延長明顯降低;腫瘤與非腫瘤的放射性攝取比值較高,尤其是腫瘤與肌肉的比值在注射18F-FPA后0.5、1.0、2.0和4.0 h分別為2.29、2.42、2.48和2.75,見圖4。

圖4 18F-FPA注射后不同時間荷PC3前列腺癌裸鼠體內生物分布
3 討 論
代謝研究表明,丙酸通過琥珀酸進入三羧酸循環與糖、蛋白質、脂肪代謝聯系起來,參與脂肪酸和其他一些物質的合成,并提供能量[7]。前列腺癌組織中脂肪酸合成酶的活性增強,脂肪酸及能量的需求增加,丙酸的利用率相應增加[8-9]。18F-FPA的分子結構與丙酸相似,在體內的分布能反應丙酸的代謝情況,有成為前列腺癌顯像劑的潛在價值。本實驗通過CFN-multi-200型多功能藥物合成模塊全自動合成18F-FPA,避免合成過程中人工操作,合成時間較短,合成路徑簡單易行,產率及放射化學純度較高,體外穩定性好,符合顯像劑質量要求。
荷PC3前列腺癌裸鼠的PET/CT顯像可見,18F-FPA注射后0.5 h就能獲得較清晰的圖像,在腫瘤部位有明顯的濃聚。生物分布也證實,腫瘤在此時有較高的%ID/g,隨后有逐漸增加的趨勢,2.0 h達到峰值,4.0 h略有下降,各時間點差異無統計學意義(P>0.05),說明18F-FPA注射入生物體內后,其分布較快趨于穩定,短時間內就可以進行顯像,且腫瘤與非腫瘤組織的放射性攝取比值表明有良好的顯像背景。本實驗中可見腸道有輕微攝取,可能與腸道微生物的活動、短鏈脂肪酸的代謝吸收有關[10]。18F-FDG和11C-膽堿均為目前臨床應用的前列腺癌顯像劑,但在本實驗與18F-FPA的對比顯像中,荷PC3和22RV1前列腺癌裸鼠多次顯像腫瘤均只見輕微的放射性攝取,可能與這兩種顯像劑的靈敏度不高有關,上述現象也進一步證實了18F-FPA在前列腺癌的應用上可能具有良好的價值。骨骼攝取較低,無明顯脫氟現象,提示18F-FPA在體內有較好的穩定性。因腸道對18F-FPA的攝取不利于對腸道腫瘤的檢測,但在腦、肺和腎等組織中始終未見18F-FPA明顯濃聚,推測18F-FPA也能用于這些部位腫瘤的診斷。有學者利用MicroPET對荷乳腺癌和荷Lewis肺癌小鼠模型進行了18F-FPA顯像和小鼠體內分布測定,提出18F-FPA可用于乳腺癌和肺癌的顯像[11-12]。
大多數前列腺癌在經過1年至1年半的內分泌治療后,會由雄激素依賴型前列腺癌演變為非雄激素依賴性前列腺癌[13],本實驗選取的PC3和22RV1細胞株均為非雄激素依賴型的前列腺癌上皮細胞。兩種細胞株荷瘤裸鼠行18F-FPA顯像,腫瘤均出現高攝取,預示18F-FPA可能對不同的前列腺癌細胞株成瘤裸鼠均具有較好地顯像優勢,這有待深入研究。
綜上所述,利用CFN-multi-200型多功能藥物合成模塊能自動化合成18F-FPA,方法簡單,符合質量要求,能較好的顯示前列腺癌,是一種有潛力的前列腺癌顯像劑。
[1]TONRYCL,DOHERTYD,O′SHEAC,
et al.Discovery and Longitudinal Evaluation of Candidate Protein Biomarkers for Disease Recurrence in Prostate Cancer[J].J Proteome Res,2015,14(7):2769-2783.
[2]OH J J,PARK S,LEE S E,et al.Genome-wide detection of allelic genetic variation to predict advanced-stage prostate cancer after radical prostatectomy using an exome SNP chip[J].J Cancer Res Clin Oncol,2015,141(8):1493-1501.
[3]MERTENS K,SLAETS D,LAMBERT B,et al.PET with18F-labelled choline-based tracers for tumour imaging:a review of the literature[J].Eur J Nucl Med Mol Imaging,2010,37(11):2188-2193.
[4]KITAJIMA K,MURPHY R C,NATHAN M A,et al.Update on positron emission tomography for imaging of prostate cancer[J].Int J Urol,2014,21(1):12-23.
[5]PONDE D E,DENCE C S,OYAMA N,et al.18F-fluoroacetate:a potential acetate analog for prostate tumor imaging--in vivo evaluation of18F-fluoroacetate versus11C-acetate[J].J Nucl Med,2007,48(3):420-428.
[6]PILLARSETTY N,PUNZALAN B,LARSON S M.2-18F-Fluoropropionic acid as a PET imaging agent for prostate cancer[J].J Nucl Med,2009,50(10):1709-1714.
[7]CHANDLER R J,ASWANI V,TSAI M S,et al.Propiony-CoA and adenosylcobalamin metabolism in caenorhabditis elegans:evidence for a role of methylmalonyl-CoA epimerase in intermediary metabolism[J].Mol Genet Metab,2006,89(1):64-73.
[8]MANSOUR M,SCHWARTZ D,JUDD R,et al.Thiazolidinediones/PPARγ agonists and fatty acid synthase inhibitors as an experimental combination therapy for prostate cancer[J].Int J Oncol,2011,38(2):537-546.
[9]CURRIE E,SCHULZE A,ZECHNER R,et al.Cellular fatty acid metabolism and cancer[J].Cell Metab,2013,18(2):153-161.
[10]FURUSAWA Y,OBATA Y,FUKUDA S,et al.Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J].Nature,2013,504(7480):446-450.
[11]黨永紅,蔡炯,李欣,等.18F-FPA在荷乳腺癌小鼠模型中的顯像性能和體內分布[J].中國醫學科學院學報,2015,37(3):320-324.
[12]黨永紅,蔡炯,李欣,等.Lewis肺癌小鼠2-18F-氟丙酸microPET顯像[J].中華核醫學與分子影像學雜志,2016,36(2):180-183.
[13]SCHNADING I D,BEER T M.Optimal timing of chemotherapy in androgen independent prostate cancer[J].Urol Oncol,2009,27(1):97-100.

