HIF-2α及VEGF在結直腸癌組織中的表達及與患者預后的關系
黃澄澄,唐成佳, 余天霧
(重慶醫科大學附屬永川醫院:1.老年病科;2.肝膽外;3.普外科 402160)
HIF-2α及VEGF在結直腸癌組織中的表達及與患者預后的關系
黃澄澄1,唐成佳2△, 余天霧3
(重慶醫科大學附屬永川醫院:1.老年病科;2.肝膽外;3.普外科 402160)
目的探討HIF-2α及VEGF在結直腸癌中的表達情況,HIF-2α及VEGF與臨床病理間的關系。方法免疫組織化學技術檢測67例結直腸癌及癌旁組織中HIF-2α及VEGF蛋白的表達情況。結果在結直腸癌組織中HIF-2α、VEGF的表達明顯高于癌旁組織; HIF-2α及VEGF的表達率隨著腫瘤臨床分期、淋巴結轉移逐漸增加;HIF-2α的表達率隨著腫瘤體積增大逐漸增加,而VEGF表達率與腫瘤體積大小無相關性;HIF-2α及VEGF表達率與患者的年齡、性別、腫瘤發生部位及腫瘤分化程度等無關。HIF-2α與VEGF表達呈正相關; Kaplan-Meier生存分析發現HIF-2α表達與患者生存有關,即高表達患者預后差。結論HIF-2α參與了結直腸癌生長、浸潤及轉移過程,這一過程可能與調節VEGF的表達有關。
結直腸腫瘤;缺氧誘導因子2α;血管內皮生長因子A
結直腸癌作為消化道常見的實體腫瘤,其生長迅速,可致腫瘤內部慢性缺氧。缺氧誘導因子2α(hypoxia inducible factor 2α,HIF-2α)在腫瘤細胞的慢性缺氧適應性方面起著重要作用。HIF-2α 的活性可能與血管生成的持續生成相關。HIF-2α可能通過調節血管內皮生長因子(vascular endothelial growth factor,VEGF)持續表達而維持血管生成[1]。本研究通過免疫組織化學檢測結直腸癌組織中HIF-2α及VEGF表達情況,并分析二者與臨床病理的關系。
1 資料與方法
1.1一般資料 收集2009年6月至2010年9月期間重慶醫科大學附屬永川醫院普外科行手術切除的,術后病理診斷為結直腸癌的標本67例,全部病例術前均未接受放療和化療,均無炎癥性腸病病史,所有入組人員均被告知檢查目的,并簽署知情同意書。病理分型及分級按WHO分類標準,將高和中分化歸為分化較好的低級別組;將低分化、黏液腺癌和印戒細胞癌歸為分化較差的高級別組。其中男41例,女26例,平均年齡63.8歲。黏液腺癌22例,印戒細胞癌4例,低分化腺癌10例、高和中分化腺癌31例。分期按TNM標準:Ⅰ~Ⅱ期34例,Ⅲ~Ⅳ期33例。有淋巴結轉移32例,無淋巴結轉移35例。所有標本經固定、脫水、包埋、切片。
1.2主要試劑 HIF-2α單克隆抗體及免疫組織化學試劑盒及顯色試劑盒均購于北京中杉金橋生物有限公司,VEGF多克隆抗體購于武漢博士德生物工程有限公司。
1.3免疫組織化學染色檢測HIF-2α及VEGF表達情況 染色按試劑盒說明書操作。以PBS液代替一抗作空白對照。切片脫蠟,pH 9.0乙二胺四乙酸(EDTA)加熱修復抗原,3%雙氧水37 ℃孵育15 min滅活內源性過氧化物酶,PBS沖洗,正常山羊血清封閉30 min,PBS沖洗,加HIF-2α及VEGF一抗(稀釋度均為1∶150)。4 ℃過夜;次日復溫,PBS沖洗,加生物素化二抗37 ℃孵育30 min,PBS沖洗,HRP標記鏈酶卵白素37 ℃孵育30 min,加DAB顯微鏡下顯色,蘇木素復染,鹽酸乙醇分化,碳酸鋰返藍,梯度乙醇脫水,二甲苯透明,中性樹膠封片。
1.4結果判斷 HIF-2α及VEGF表達以細胞染色強度得分×細胞陽性百分率得分進行判定。無染色0分,淡黃色1分,棕黃色2分,深黃色3分;細胞陽性率小于5%為0分,5%~<25%為1分,25%~<50%為2分,≥50%為3分。上述二項得分相乘,<3分為陰性,≥3分為陽性。統計計算時,0~1分為陰性,其余均為陽性。

2 結 果
2.1免疫組織化學染色檢測HIF-2α及VEGF表達情況 結直腸癌組織中HIF-2α主要為細胞質及細胞核表達。HIF-2α陽性率腫瘤組織(62.7%)高于癌旁組織(13.4%)。VEGF主要為細胞質表達(圖1),VEGF陽性率腫瘤組織(65.7%)高于癌旁組織(35.8%),差異有統計學意義(P<0.05)。見圖1。
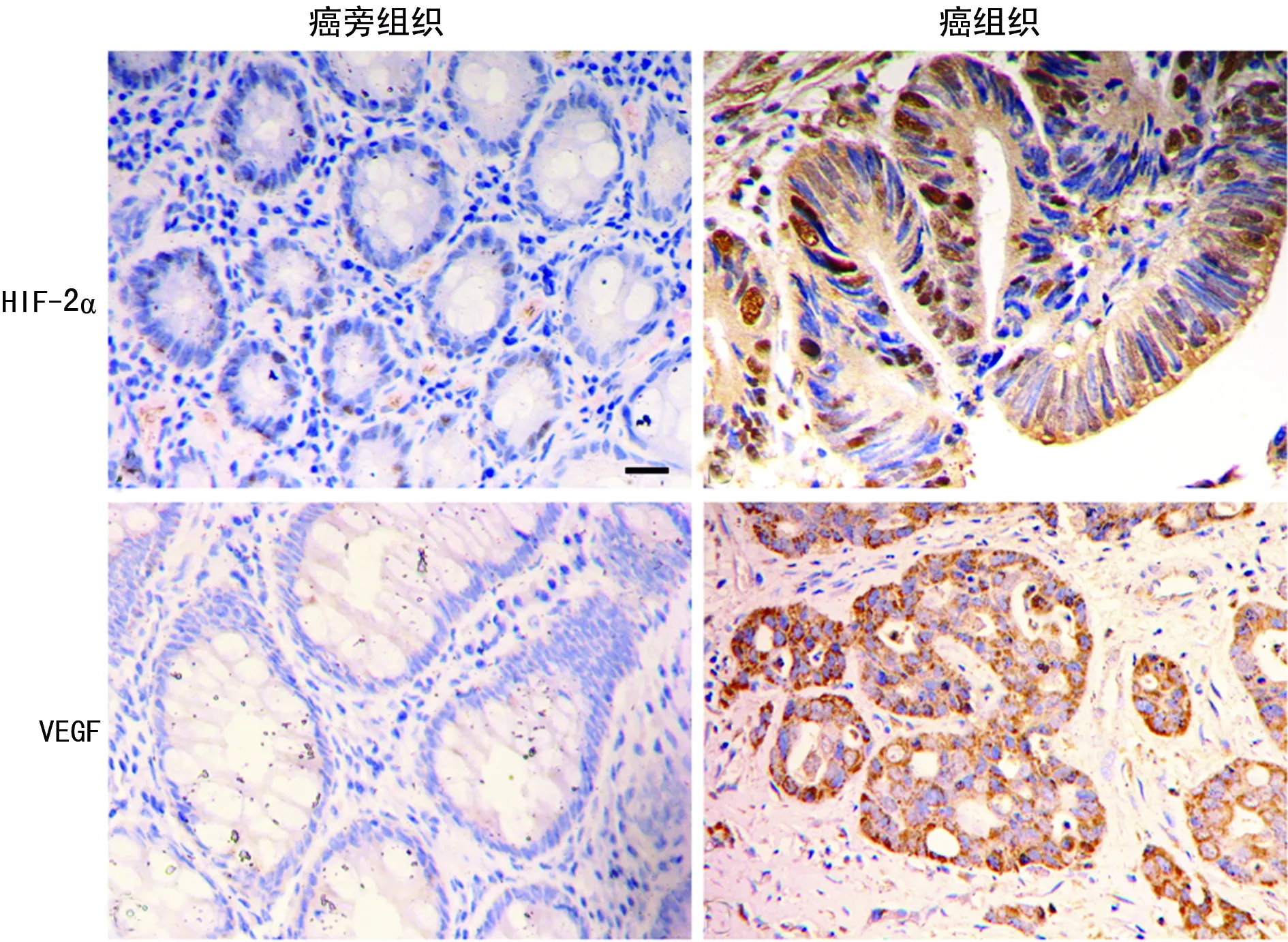
圖1 結直腸癌及癌旁組織中HIF-2α及VEGF 的表達(免疫組織化學×200)
2.2HIF-2α及VEGF蛋白在結直腸癌中的表達與患者臨床病理聯系 HIF-2α及VEGF的表達隨著結直腸癌TNM分期的增加逐漸增加,HIF-2α及VEGF的陽性表達率在Ⅲ~Ⅳ期組(75.8%、81.8%)高于Ⅰ~Ⅱ期組(50.0%、50.0%),差異有統計學意義(P=0.03,P=0.01);有淋巴結轉移組(75.0%、78.1%)高于無淋巴結轉移組(51.4%、54.3%),差異有統計學意義(P=0.05,P=0.04)。HIF-2α陽性表達率在腫瘤直徑大于或等于5 cm組(73.8%)高于小于5 cm組(44.0%),差異有統計學意義(P=0.02)。HIF-2α及VEGF表達率與患者的年齡、性別、腫瘤發生部位及腫瘤分化程度無關(P>0.05),且VEGF表達率與腫瘤大小無關(P>0.05),見表1。
2.3結直腸癌中HIF-2α及VEGF相關性分析 經Spearman相關分析,HIF-2α及VEGF的表達呈正相關(r=0.352,P<0.05)。
2.4生存分析 對67例結直腸癌患者進行6年隨訪調查,其中失訪13例,進行Kaplan-Meier生存分析,HIF-2α陽性組及其陰性組的中位生存期分別為64.0、49.0個月,生存曲線顯示HIF-2α陽性組的生存時間明顯低于HIF-2α陰性組(P=0.04);VEGF陽性組及其陰性組的中位生存期分別為49.0、54.0個月(圖2A),而VEGF表達水平與患者生存時間無明顯相關性(P=0.18),見圖2B。
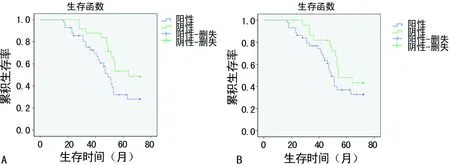
A:HIF-2α;B:VEGF
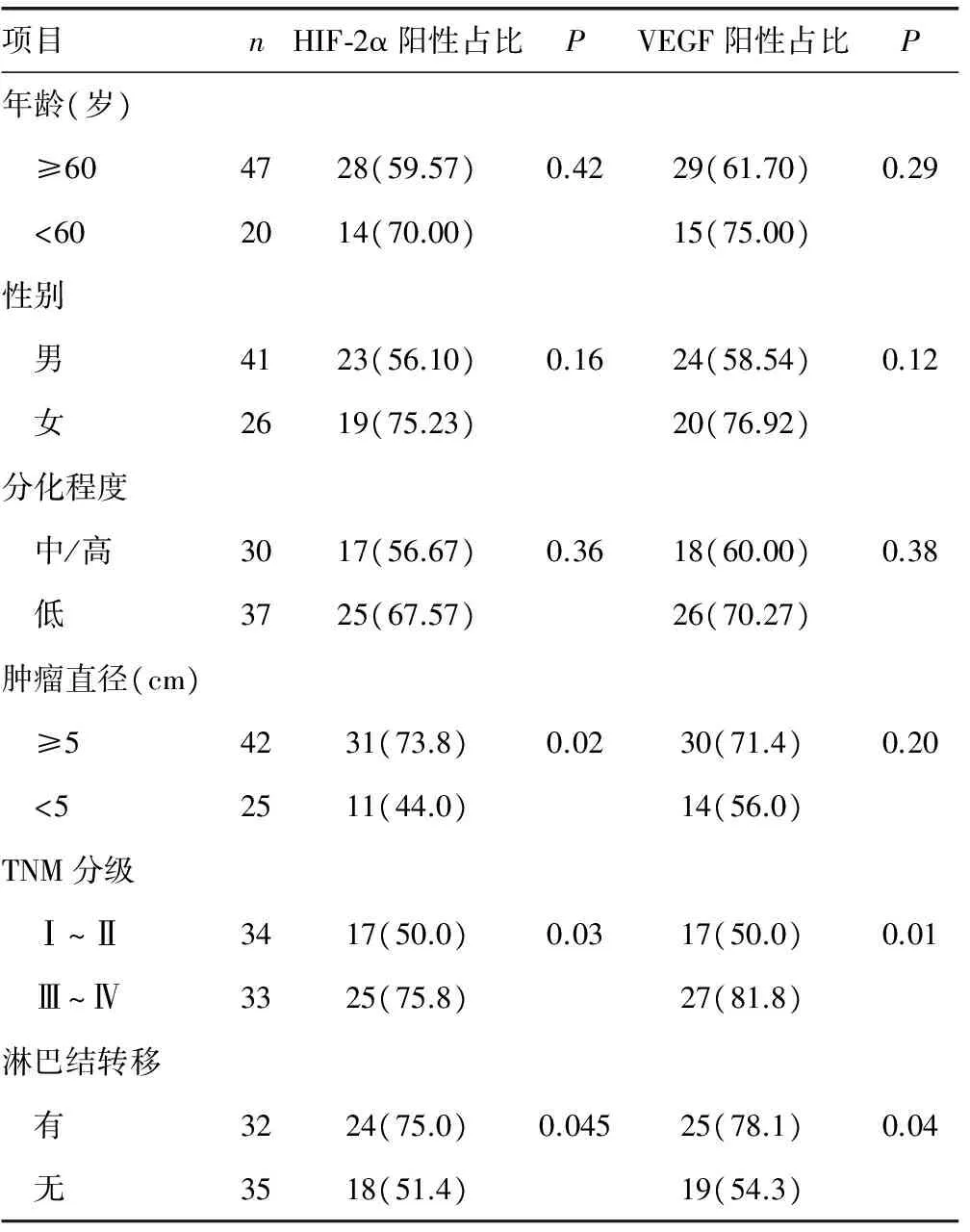
圖2 HIF-2α及VEGF的表達與結直腸癌患者的生存曲線表1 結直腸癌中HIF-2α及VEGF蛋白表達與臨床病理特征的關系[n(%)]
3 討 論
結直腸癌作為常見的實體腫瘤,新陳代謝旺盛,瘤體生長速度大于其內新生血管的生長速度,必然會導致其組織氧供不足,低氧誘導因子(HIF)是近年研究的熱點基因,HIF包括HIF-1、HIF-2、HIF-3,三者均由調節亞基α和結構亞基β組成的異源二聚體。HIF-2α是HIF-2的功能性調節亞基,在慢性缺氧適應性方面起著重要作用。
HIF-2α的調節途徑分為氧依賴及非氧依賴調節途徑;氧依賴調節途徑:常氧條件下,HIF-2α ODD結構域特定的脯氨酰殘基Pro405和Pro531被脯氨酰羥化酶(prolylhydroxylases,PHD)羥化后,與腫瘤抑制蛋白pVHL結合并發生泛素化,并被26s蛋白酶體降解;非氧依賴調節途徑:在缺氧情況下,PHD活性降低,HIF-2α不能被羥化,影響其泛素化,從而不能被降解,HIF-2α聚集于細胞質,轉移至細胞核,與HIF-β形成HIF異二聚體復合物,調節靶基因的轉錄活性[2-4]。促進腫瘤細胞的能量代謝、增殖、分化及血管生成[5]。而缺氧條件下,HIF-2α的降解主要通過SUMO化修飾(small ubiquitin-related modifier)進行降解,負性調控HIF-2α的表達,SUMO化修飾的HIF-2α可經泛素-蛋白酶體途徑降解[6]。近年國內外研究表明,HIF-2α與胃癌、乳腺癌、胰腺癌、腎癌的浸潤轉移密切相關[7-10]。Kourakis等[11]通過免疫組織化學檢測結腸癌中HIF-2α與BNP3,發現二者過表達均與局部浸潤及淋巴結轉移有關。Esteban等[12]發現,HIF-2α通過抑制E-cadherin的表達,使細胞間黏附減低促進結直腸癌細胞的浸潤轉移。但也有人發現,HIF-2α在癌旁組織中表達明顯高于肝癌組織,且與包膜或門靜脈浸潤無關[13]。本研究發現,HIF-2α在結直腸癌組織中主要為細胞核及細胞質表達,且在結直腸癌組織中HIF-2α表達率明顯高于癌旁組織,HIF-2α陽性表達率在Ⅲ~Ⅳ期組高于Ⅰ~Ⅱ期組,在有淋巴結轉移組高于無淋巴結轉移組,差異有統計學意義(P<0.05),提示HIF-2α可能參與結直腸癌細胞的浸潤、轉移過程,且HIF-2α表達還與腫瘤大小有關,大于或等于5 cm組HIF-2α表達率明顯高于小于5 cm組,差異有統計學意義(P<0.05),可能與腫瘤內部缺氧有關,快速生長的實體瘤,瘤體內部不能得到足夠的血供,導致供需氧失衡[14],推測瘤體大小與其內部缺氧程度相關。
VEGF是目前已知的最強的血管生成促進因子,它與受體結合活化磷脂酶B,使細胞內磷酸肌醇水平升高,刺激內皮細胞增殖,利于血管生成,腫瘤細胞脫落進入血管和結締組織基質中導致擴散。本研究發現,結直腸癌組織中VEGF表達明顯高于癌旁組織,VEGF陽性表達率在Ⅲ~Ⅳ期組高于Ⅰ~Ⅱ期組,在有淋巴結轉移組高于無淋巴結轉移組,差異有統計學意義(P<0.05)。
VEGF是HIF-2α重要的下游基因,HIF-2α不僅可以增加VEGF轉錄,還可增強其穩定性,Xiong等[15]通過shRNA慢病毒載體敲除HeLa細胞HIF-2α表達發現COX-2及VEGF明顯下降,且在缺氧條件下,此作用更明顯。本研究相關性分析表明HIF-2α與VEGF成正相關,說明HIF-2α可能通過促進結腸癌組織中VEGF表達來增加結直腸癌細胞的浸潤與轉移能力。經長期隨訪調查顯示,HIF-2α陽性的結直腸癌患者的生存時間明顯低于HIF-2α陰性的結直腸癌患者,HIF-2α陽性組的中位生存期明顯低于HIF-2α陰性組,提示HIF-2α的表達與患者的預后密切相關。而本研究中發現VEGF的表達與患者生存時間無明顯相關性,可能與樣本量較小有關。
綜上所述,檢測結直腸癌組織中HIF-2α的表達情況對評估結直腸癌患者的預后及危險程度提供參考。HIF-2α參與了結直腸癌生長、浸潤和轉移過程,這一過程可能與調節VEGF的表達有關。
[1]Koh MY,Lemos R,Liu X,et al.The hypoxia-associated factor switches cells from HIF-1α- to HIF-2α-dependent signaling promoting stem cell characteristics,aggressive tumor growth and invasion[J].Cancer Res,2011,71(11):4015-4027.
[2]Aragonés J,Fraisl P,Baes M,et al.Oxygen sensors at the crossroad of metabolism[J].Cell Metab,2009,9(1):11-22.
[3]胡瑛.缺氧誘導因子-1α、2α在惡性腫瘤中不同作用的研究進展[J].癌癥進展,2014,12(2):122-125.
[4]Bertout JA,Patel SA,Simon MC.The impact of O2availability on human cancer[J].Nat Rev Cancer,2008,8(12):967-975.
[5]Zhao J,Du F,Shen G,et al.The role of hypoxia-inducible factor-2 in digestive system cancers[J].Cell Death Dis,2015,6(1):e1600.
[6]van Hagen M,Overmeer RM,Abolvardi SS,et al.RNF4 and VHL regulate the proteasomal degradation of SUMO-conjugated Hypoxia-Inducible Factor-2alpha[J].Nucleic Acids Res,2010,38(6):1922-1931.
[7]Li N,Wang HX,Qin C,et al.Relationship between clinicopathological features and HIF-2α in gastric adenocarcinoma[J].Genet Mol Res,2015,14(1):1404-1413.
[8]Gilkes DM,Semenza GL.Role of hypoxia-inducible factors in breast cancer metastasis[J].Future Oncol,2013,9(11):1623-36.
[9]Wang M,Chen MY,Guo XJ,et al.Expression and significance of HIF-1α and HIF-2α in pancreatic cancer.[J] J Huazhong Univ Sci Technolog Med Sci,2015,35(6):874-879.
[10]Rankin EB,Biju MP,Liu Q,et al.Hypoxia-inducible factor-2 (HIF-2) regulates hepatic erythropoietin in vivo[J].J Clin Invest,2007,117(4):1068-1077.
[11]Kourakis MI,Giatromanolaki A,Polychronidis A,et al.Endogenous markers of hypoxia/anaerobic metabolism and anemia in primary colorectal cancer[J].Cancer Sci,2006,97(7):582-588.
[12]Esteban MA,Tran MG,Harten SK,et al.Regulation of E-cadherin expression by VHL and hypoxia-inducible factor[J].Cancer Res,2006,66(7):3567-3575.
[13]Yang SL,Liu LP,Jiang JX,et al.The correlation of expression levels of HIF-1α and HIF-2α in hepatocellular carcinoma with capsular invasion,portal vein tumor thrombi and patients′ clinical outcome[J].Jpn J Clin Oncol,2014,44(2):159-167.
[14]劉芳.缺氧微環境與實體瘤[J].現代診斷與治療,2007,18(1):36-39.
[15]Xiong J,Zhu FF,Nie MF.Hypoxia-inducible factor-2α (HIF-2α) mediates the effects of hypoxia on the promotion of HeLa cell viability,colony formation,and invasion capacity in vitro[J].Genet Mol Res,2015,14(2):3281-3292.
ExpressionofHIF-2αandVEGFincolorectalcanceranditsrelationshipwithprognosis
HuangChengcheng1,TangChengjia2△,YuTianwu2
(1.DepartmentofGeriatrics;2.DepartmentofHepatologicalSurgery;3.DepartmentofHepatobiliarySurgery,theAffiliatedYongchuanHospitalofChongqingMedicalUniversity,Chongqing402160,China)
ObjectiveTo study the expression of HIF-2α and VEGF in colorectal cancer and to investigate the relationship between them and clinicopathologic parameter.MethodsImmunohistochemistry staining was conducted to detect the expression of HIF-2α and VEGF protein in 67 samples of colorectal tumor tissues and 67 samples of normal adjacent tissue.ResultsThe expression of HIF-2α and VEGF in colorectal cancer tissues was significantly higher than that in adjacent tissues.The expression of HIF-2α and VEGF increased with the clinical stage and lymph node metastasis.The expression of HIF-2α increased with the tumor volume.The expression of HIF-2α and VEGF was not related to the age,sex,tumor location and tumor differentiation of the patients.HIF-2α was positively correlated with VEGF expression.Kaplan-Meier survival analysis showed that HIF-2α expression was associated with survival,that is,the higher expression of HIF-2α the worse of prognosis was obtained.ConclusionHIF-2α is involved in the process of growth,invasion and metastasis of colorectal cancer.This process may be related to the regulation of VEGF expression.
colorectal neoplasms;hypoxia-inducible factor 2α;vascular endothelial growth factor A
黃澄澄(1986-),住院醫師,碩士,主要從事消化系統疾病研究。△
,E-mail:285993446@qq.com。
10.3969/j.issn.1671-8348.2017.34.015
R735
A
1671-8348(2017)34-4802-03
2017-08-01
2017-09-05)

